研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)= 2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1;
C(石墨)+CO2(g)= 2CO(g)ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3(s)的热化学方程式为________________________
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①该反应的平衡常数表达式为K=_____________ 。
②取一定体积的CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图Z76(a)所示,则该反应的ΔH________ 0(填“>”“<”或“=”)。
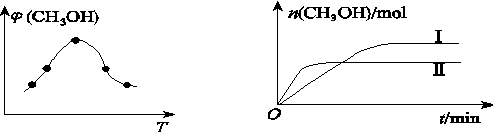
(a) (b)
图Z76
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间的变化关系如图(b)所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KI________ KⅡ(填“>”“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为:____________
2NH3+CO2 CO(NH2)2+H2O当氨碳比
CO(NH2)2+H2O当氨碳比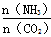 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_________ 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为________ 。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)= 2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1;
C(石墨)+CO2(g)= 2CO(g)ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3(s)的热化学方程式为
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH①该反应的平衡常数表达式为K=
②取一定体积的CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图Z76(a)所示,则该反应的ΔH

(a) (b)
图Z76
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间的变化关系如图(b)所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KI
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为:
2NH3+CO2
 CO(NH2)2+H2O当氨碳比
CO(NH2)2+H2O当氨碳比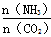 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为
更新时间:2016-12-09 10:34:40
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】乙苯催化脱氢制苯乙烯反应:
(1)已知:
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=___________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________ 。
②控制反应温度为600℃的理由是____________ 。

(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实
②控制反应温度为600℃的理由是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】第一题:已知:
①CH4(g) +H2O(g) CO(g) +3H2(g) ∆H1 =+206.4 kJ/mol
CO(g) +3H2(g) ∆H1 =+206.4 kJ/mol
②CO(g) + H2O(g) CO2(g) +H2(g) ∆H2 =-41.0 kJ/mol
CO2(g) +H2(g) ∆H2 =-41.0 kJ/mol
③CH4 (g) +2H2O(g) CO2(g) +4H2(g) ∆H3
CO2(g) +4H2(g) ∆H3
请回答:
(1)反应①属于________ (填“吸热”或“放热”)反应。
(2)反应①消耗8 g CH4 (g)时,∆H =________ kJ/mol。
(3)反应②生成2 mol H2(g)时,∆H ="___________ " kJ/mol。
(4)反应③的∆H3="___________ " kJ/mol。
第二题:在容积为1.00 L的密闭容器中,通入一定量的N2O4,发生反应:N2O4(g) 2NO2(g)。100℃时,各物质浓度随时间变化如下图所示。
2NO2(g)。100℃时,各物质浓度随时间变化如下图所示。

请回答:
(1)60 s内,v(N2O4) =__________ mol/(L·s)。
(2)若升高温度,混合气体的颜色变深,则正反应是__________ (填“放热”或“吸热”)反应。
(3)100℃时,该反应的化学平衡常数数值为_________________ 。
(4)平衡时,N2O4的转化率是_______________ 。
①CH4(g) +H2O(g)
 CO(g) +3H2(g) ∆H1 =+206.4 kJ/mol
CO(g) +3H2(g) ∆H1 =+206.4 kJ/mol②CO(g) + H2O(g)
 CO2(g) +H2(g) ∆H2 =-41.0 kJ/mol
CO2(g) +H2(g) ∆H2 =-41.0 kJ/mol③CH4 (g) +2H2O(g)
 CO2(g) +4H2(g) ∆H3
CO2(g) +4H2(g) ∆H3请回答:
(1)反应①属于
(2)反应①消耗8 g CH4 (g)时,∆H =
(3)反应②生成2 mol H2(g)时,∆H ="
(4)反应③的∆H3="
第二题:在容积为1.00 L的密闭容器中,通入一定量的N2O4,发生反应:N2O4(g)
 2NO2(g)。100℃时,各物质浓度随时间变化如下图所示。
2NO2(g)。100℃时,各物质浓度随时间变化如下图所示。
请回答:
(1)60 s内,v(N2O4) =
(2)若升高温度,混合气体的颜色变深,则正反应是
(3)100℃时,该反应的化学平衡常数数值为
(4)平衡时,N2O4的转化率是
您最近一年使用:0次
填空题
|
较难
(0.4)
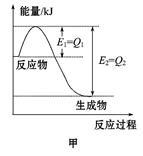
【推荐3】Ⅰ.图甲是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):___________________________ 。
Ⅱ.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,
已知:N2(g)+3H2(g) 2NH3(g) ΔH="-92.4" kJ·mol-1,
2NH3(g) ΔH="-92.4" kJ·mol-1,
2H2(g)+O2(g)====2H2O(l) ΔH="-571.6" kJ·mol-1,
则2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=
4NH3(g)+3O2(g) ΔH=_____ ;
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
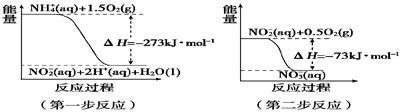
①第一步反应是________ 反应(填“放热”或“吸热”),判断依据是______________________________________ 。
②1 mol NH4+ (aq) 全部氧化成NO3-(aq)的热化学方程式是___________________ 。

Ⅱ.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,
已知:N2(g)+3H2(g)
 2NH3(g) ΔH="-92.4" kJ·mol-1,
2NH3(g) ΔH="-92.4" kJ·mol-1,2H2(g)+O2(g)====2H2O(l) ΔH="-571.6" kJ·mol-1,
则2N2(g)+6H2O(l)
 4NH3(g)+3O2(g) ΔH=
4NH3(g)+3O2(g) ΔH=(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO。两步反应的能量变化示意图如下:

①第一步反应是
②1 mol NH4+ (aq) 全部氧化成NO3-(aq)的热化学方程式是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】汽车尾气和燃煤造成空气污染。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如下:
写出该反应平衡常数表达式:K=__________。
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)________V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是__________。
A. 容器中密度不变
B. 容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2) :v(H2) =1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
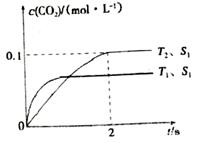
①在T2温度下,0~2 s内的平均反应速率v(N2)=__________;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1〉S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线。
(3)工业上用CO和H2合成 CH3OH:CO (g) +2H2(g) CH3OH (g)
CH3OH (g)
①现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是____________
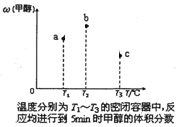
A.正反应的△H>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
达到平衡时CO的转化率为__________。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
CH3OCH3(g)+3H2O(g)△H=+QkJ/mol①反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K=__________。
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)________V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是__________。
A. 容器中密度不变
B. 容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2) :v(H2) =1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
①在T2温度下,0~2 s内的平均反应速率v(N2)=__________;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1〉S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线。
(3)工业上用CO和H2合成 CH3OH:CO (g) +2H2(g)
 CH3OH (g)
CH3OH (g)①现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是____________

A.正反应的△H>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为__________。
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】1.
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
窗体顶端
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成________ 而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_____ 。
①阴极上的产物是________ 。
②阳极生成Cu2O,其电极反应式为_________ 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________ 。
(5)肼又称联氨,易溶于水,是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因______ 。
(6)向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应N2H4(g) N2(g)+2H2(g),测得混合物体系中,
N2(g)+2H2(g),测得混合物体系中, (用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=
(用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____ mol/(L·min);该温度下,反应的平衡常数=_______ 。
(7)肼-空气清洁燃料电池是一种碱性燃料电池,电解质溶液时20%-30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式是_________ 。电池工作一点时间后,电解质溶液的pH将_______ (填“增大”、“减小”、“不变”)。
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
窗体顶端
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O Cu2O+H2↑。 Cu2O+H2↑。 |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,电解装置如下图所示。

①阴极上的产物是
②阳极生成Cu2O,其电极反应式为
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为
(5)肼又称联氨,易溶于水,是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因
(6)向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应N2H4(g)
 N2(g)+2H2(g),测得混合物体系中,
N2(g)+2H2(g),测得混合物体系中, (用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=
(用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=
(7)肼-空气清洁燃料电池是一种碱性燃料电池,电解质溶液时20%-30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。反应达平衡后,若再通入一定量CO2,则平衡常数K将________,CO2的转化率________。(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是 。
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 600 | 800 | 830 | 1000 | 1200 |
| K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。反应达平衡后,若再通入一定量CO2,则平衡常数K将________,CO2的转化率________。(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是 。
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)═CO2(g)△H=-394k J/mol
2C(石墨,s)+O2(g)═CO(g)△H=-222k J/mol
H2(g)+ 1/2O2(g)═H2O(g)△H=-242k J/mol
则CO还原H2O(g)的热化学方程式为_________________ 。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池的工作时的负极电极反应:_______ 。
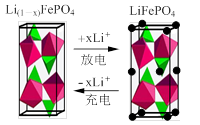
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应__________ 。
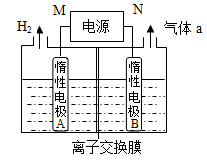
(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如上图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的________ (填“正”或“负”)极,B极区电解液为_______ 溶液(填化学式),该离子交换膜是________ (填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因______________________ 。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)═CO2(g)△H=-394k J/mol
2C(石墨,s)+O2(g)═CO(g)△H=-222k J/mol
H2(g)+ 1/2O2(g)═H2O(g)△H=-242k J/mol
则CO还原H2O(g)的热化学方程式为
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池的工作时的负极电极反应:
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应


(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如上图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的
您最近一年使用:0次
填空题
|
较难
(0.4)
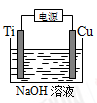
【推荐2】(1)对于Ag2S(s) 2Ag+(aq)+ S2-(aq),其Ksp=____________(写表达式)。
2Ag+(aq)+ S2-(aq),其Ksp=____________(写表达式)。
(2)下列说法错误的是_______:
E.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
(3)自然界原生铜的硫化物经氧化、淋滤作用后重生成CuSO4溶液,当这种溶液流向地壳深层遇到闪锌矿(ZnS)时,便会慢慢转化为铜蓝(CuS)[已知 Ksp(ZnS)=2.93×10-25、Ksp(CuS)=6.3×10-36],发生这种变化的原理是 。
(4)用右图装置,碱性条件下可以电解制备纳米Cu2O。反应为:2Cu+H2O Cu2O+H2↑,如下图所示。该电解池的阳极反应式为 。
Cu2O+H2↑,如下图所示。该电解池的阳极反应式为 。
 2Ag+(aq)+ S2-(aq),其Ksp=____________(写表达式)。
2Ag+(aq)+ S2-(aq),其Ksp=____________(写表达式)。(2)下列说法错误的是_______:
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| B.多数物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的; |
C.对于Al(OH)3(s)  Al(OH)3(aq) Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大; |
E.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
(3)自然界原生铜的硫化物经氧化、淋滤作用后重生成CuSO4溶液,当这种溶液流向地壳深层遇到闪锌矿(ZnS)时,便会慢慢转化为铜蓝(CuS)[已知 Ksp(ZnS)=2.93×10-25、Ksp(CuS)=6.3×10-36],发生这种变化的原理是 。
(4)用右图装置,碱性条件下可以电解制备纳米Cu2O。反应为:2Cu+H2O
 Cu2O+H2↑,如下图所示。该电解池的阳极反应式为 。
Cu2O+H2↑,如下图所示。该电解池的阳极反应式为 。
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】按要求填空。
(1)利用铅蓄电池电解氯化钠溶液,其在充电时阳极反应为____ ,放电生成的固体会附聚在电极表面,工作过程中若正极质量增重96g时,理论上电路中转移的电子数为____ 。
(2)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为_______ 。
(3)某实验小组同学对电化学原理进行了一系列探究活动。
①如图1为某实验小组依据氧化还原反应:(用离子方程式表示)_____ 设计的原电池装置
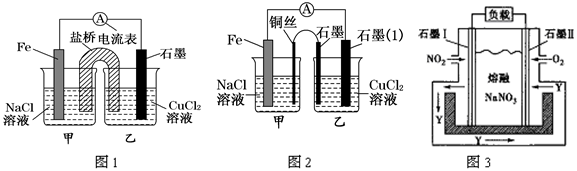
②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图2所示。
在甲装置中铜电极反应为_______________ ;乙装置中石墨(1)为________ 极(填“正”、“负”、“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为_________________ .
③某课题组利用图3所示装置,探究NO2和O2化合生成N2O5形成原电池的过程,该电池的正极反应式应为___________ 。
(1)利用铅蓄电池电解氯化钠溶液,其在充电时阳极反应为
(2)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为
(3)某实验小组同学对电化学原理进行了一系列探究活动。
①如图1为某实验小组依据氧化还原反应:(用离子方程式表示)

②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图2所示。
在甲装置中铜电极反应为
③某课题组利用图3所示装置,探究NO2和O2化合生成N2O5形成原电池的过程,该电池的正极反应式应为
您最近一年使用:0次



