Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
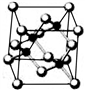
(1)下列说法正确的是__________ (填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能As>Ga
C.电负性As>Ga D.原子半径As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_____________________________ ;
(3)AsH3空间形状为___________ ;已知(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为____________ ;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因_______________________ ,Cu2+的核外电子排布式为_______________________ 。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有_________ 和_________ 。

(1)下列说法正确的是
A.砷化镓晶胞结构与NaCl相同 B.第一电离能As>Ga
C.电负性As>Ga D.原子半径As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为
(3)AsH3空间形状为
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
更新时间:2011-03-25 16:31:10
|
【知识点】 物质结构与性质综合考查解读
相似题推荐
【推荐1】下表是某些短周期元素的电负性(x)值:
(1)根据表中数据归纳元素的电负性与原子在化合物中吸引电子的能力的关系: _______ 。
(2)试推测,元素周期表所列元素中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为________ 。
(3)已知:Cl—Br+H—OH H—Cl+HO—Br。
H—Cl+HO—Br。
①若NCl3最初水解产物是NH3和HOCl,则x(Cl)的最小范围:_____ (填表中数值);
②PCl3水解的化学反应方程式是______________________________ 。
(4)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(3)①,分析BeCl2属于_______ (填“离子化合物”或“共价化合物”)。可设计实验_______________ 证明。
元素符号 | Li | Be | N | O | F | Na | Mg | Al | P | S |
x值 | 1.0 | 1.5 | 3.0 | 3.5 | 4.0 | 0.9 | 1.2 | 1.5 | 2.1 | 2.5 |
(2)试推测,元素周期表所列元素中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为
(3)已知:Cl—Br+H—OH
 H—Cl+HO—Br。
H—Cl+HO—Br。①若NCl3最初水解产物是NH3和HOCl,则x(Cl)的最小范围:
②PCl3水解的化学反应方程式是
(4)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(3)①,分析BeCl2属于
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】B、N、O、Na、Mg、Cu六种元素及其化合物是生活和工业、国防中的重要材料。
(1)上述6种元素在元素周期表中位于ds区的元素有_______ 。(填元素符号)
(2)下表列出的是某元素的第一至第四电离能(单位: )的数据。
)的数据。
上述6种元素中元素的电离能有类似变化的是_______ (填元素符号)。
(3)自然界中不存在单质硼,主要存在的是硼的含氧化合物,从键能角度分析其原因是_______ 。
(4)肼( )可视为
)可视为 分子中的一个氢原子被
分子中的一个氢原子被 取代所形成的一种物质。肼可用作火箭燃料,燃烧时发生的反应是:
取代所形成的一种物质。肼可用作火箭燃料,燃烧时发生的反应是: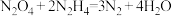 ,若该反应中有2molN—H键断裂,则形成的π键有
,若该反应中有2molN—H键断裂,则形成的π键有_______ mol。
(5)氮和磷相结合能形成一类偶磷氮烯的化合物,其链状高聚物的结构为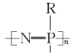 ,则N、P的杂化方式分别为
,则N、P的杂化方式分别为_______ 。
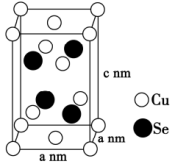
(6)铜硒化合物是一种优异的电化学性能材料,某铜硒形成化合物的晶胞结构如图所示。其中有4个铜离子和4个硒离子位于体内,Cu元素以 和
和 存在,晶胞中
存在,晶胞中 和
和 的个数比为:
的个数比为:_______ 。
(1)上述6种元素在元素周期表中位于ds区的元素有
(2)下表列出的是某元素的第一至第四电离能(单位:
 )的数据。
)的数据。 |  |  |  |
| 420 | 3100 | 4400 | 5900 |
上述6种元素中元素的电离能有类似变化的是
(3)自然界中不存在单质硼,主要存在的是硼的含氧化合物,从键能角度分析其原因是
(4)肼(
 )可视为
)可视为 分子中的一个氢原子被
分子中的一个氢原子被 取代所形成的一种物质。肼可用作火箭燃料,燃烧时发生的反应是:
取代所形成的一种物质。肼可用作火箭燃料,燃烧时发生的反应是: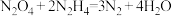 ,若该反应中有2molN—H键断裂,则形成的π键有
,若该反应中有2molN—H键断裂,则形成的π键有(5)氮和磷相结合能形成一类偶磷氮烯的化合物,其链状高聚物的结构为
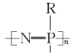 ,则N、P的杂化方式分别为
,则N、P的杂化方式分别为(6)铜硒化合物是一种优异的电化学性能材料,某铜硒形成化合物的晶胞结构如图所示。其中有4个铜离子和4个硒离子位于体内,Cu元素以
 和
和 存在,晶胞中
存在,晶胞中 和
和 的个数比为:
的个数比为:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】硼的化合物有重要应用。
(1)写出基态B的电子排布式___________ 。
(2)硼酸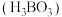 的结构如图所示。在水溶液中硼酸的电离方程式:
的结构如图所示。在水溶液中硼酸的电离方程式: ,25℃时
,25℃时 。
。
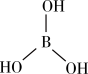
①将“ ”视为一个原子,硼酸分子的空间结构名称为
”视为一个原子,硼酸分子的空间结构名称为___________ 。
② 中,
中, 原子的杂化轨道类型为
原子的杂化轨道类型为___________ ;其中一条 键是配位键,电子对由
键是配位键,电子对由___________ 原子提供。
(3)硼砂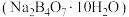 在水溶液中可以解离出等物质的量浓度的
在水溶液中可以解离出等物质的量浓度的 和
和 ,该溶液在一定温度下具有固定的pH,可作为校准pH计的标准溶液。计算常温下
,该溶液在一定温度下具有固定的pH,可作为校准pH计的标准溶液。计算常温下 硼砂溶液的
硼砂溶液的
___________ 。
(4)氨硼烷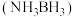 含氢量高、热稳定性好,是一种具有潜力的固体储攽材料。
含氢量高、热稳定性好,是一种具有潜力的固体储攽材料。
①氨硼烷中N为-3价,B为+3价。H、B、N的电负性由大到小依次为___________ 。
②氨硼烷在催化剂作用下水解释放氢气,用单线桥表示该反应的电子转移。

___________
③氨硼烷分子间存在“双氢键”使氨硼烷的熔点明显升高。“双氢键”能形成的原因是___________ 。
(1)写出基态B的电子排布式
(2)硼酸
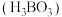 的结构如图所示。在水溶液中硼酸的电离方程式:
的结构如图所示。在水溶液中硼酸的电离方程式: ,25℃时
,25℃时 。
。
①将“
 ”视为一个原子,硼酸分子的空间结构名称为
”视为一个原子,硼酸分子的空间结构名称为②
 中,
中, 原子的杂化轨道类型为
原子的杂化轨道类型为 键是配位键,电子对由
键是配位键,电子对由(3)硼砂
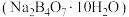 在水溶液中可以解离出等物质的量浓度的
在水溶液中可以解离出等物质的量浓度的 和
和 ,该溶液在一定温度下具有固定的pH,可作为校准pH计的标准溶液。计算常温下
,该溶液在一定温度下具有固定的pH,可作为校准pH计的标准溶液。计算常温下 硼砂溶液的
硼砂溶液的
(4)氨硼烷
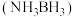 含氢量高、热稳定性好,是一种具有潜力的固体储攽材料。
含氢量高、热稳定性好,是一种具有潜力的固体储攽材料。①氨硼烷中N为-3价,B为+3价。H、B、N的电负性由大到小依次为
②氨硼烷在催化剂作用下水解释放氢气,用单线桥表示该反应的电子转移。

③氨硼烷分子间存在“双氢键”使氨硼烷的熔点明显升高。“双氢键”能形成的原因是
您最近一年使用:0次



