钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质).
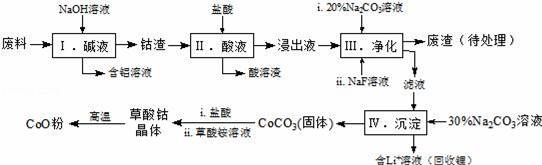
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
请回答:
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: 。
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过 ;废渣中的主要成分除了LiF外,还有 。
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是 。
(4)在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4·2H2O)=183g/mol
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是 。温度高于890℃时,固体产物发生分解反应,固体产物为 。

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: 。
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过 ;废渣中的主要成分除了LiF外,还有 。
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是 。
(4)在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4·2H2O)=183g/mol
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
更新时间:2019-01-30 18:14:09
|
【知识点】 化学实验基础
相似题推荐
解答题-实验探究题
|
困难
(0.15)
解题方法
【推荐1】无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将5.60 g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88 g。
(1)产生的氢气的体积为_________ mL(标准状况下)。
(2)将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量。____________
(3)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________ 。T的化学式为____________ 。
(4)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为______________ 。
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
(5)有机高分子材料聚酯纤维可由二酸与二醇通过缩聚形成。如100个乙二酸分子与100个乙二醇分子发生缩聚,当形成一条聚酯链时,其(平均)式量达到最大(如图所示,其式量为11618)。
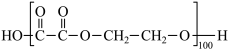
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长。现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长。
①共形成_____ 条聚酯链。
②计算所得聚酯的平均式量。_______________
(1)产生的氢气的体积为
(2)将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量。
(3)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为
(4)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% |
(5)有机高分子材料聚酯纤维可由二酸与二醇通过缩聚形成。如100个乙二酸分子与100个乙二醇分子发生缩聚,当形成一条聚酯链时,其(平均)式量达到最大(如图所示,其式量为11618)。
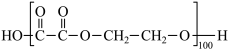
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长。现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长。
①共形成
②计算所得聚酯的平均式量。
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐2】某兴趣小组设计如下图实验装置进行实验。
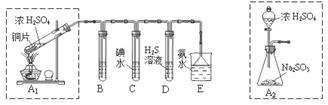
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ,C中反应的离子方程式为 ,D中反应的化学方程式为 。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:

(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是_____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程式为 。
(6)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、
2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:

Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ,C中反应的离子方程式为 ,D中反应的化学方程式为 。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:

(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是_____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程式为 。
(6)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、
2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则“吸收液” 中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 | , 则“吸收液”中存在 SO32-。 |
| 步骤3: 。 | , 则“吸收液”中存在 HSO3-。 |
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐3】二氧化铈(CeO2)是一种重要的稀土氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
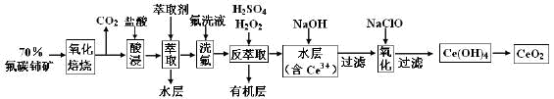
已知:①Ce4+既能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是__________________________ 。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:_________________________________ ;为避免产生上述污染,请提出一种解决方案:________ 。
(3)“萃取”时存在反应:Ce4++n(HA)2 Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为___________ ;
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+,H2O2在该反应中作_________ (填“催化剂”、“氧化剂”或“还原剂”),每有1mol H2O2参加反应,转移电子的物质的量为________________ 。
(5)“氧化”步骤的化学方程式为________________________________ 。
(6)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗25.00mL标准溶液。该产品中CeO2的质量分数为________ 。

已知:①Ce4+既能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:
(3)“萃取”时存在反应:Ce4++n(HA)2
 Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+,H2O2在该反应中作
(5)“氧化”步骤的化学方程式为
(6)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗25.00mL标准溶液。该产品中CeO2的质量分数为
您最近一年使用:0次



