无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将5.60 g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88 g。
(1)产生的氢气的体积为_________ mL(标准状况下)。
(2)将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量。____________
(3)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________ 。T的化学式为____________ 。
(4)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为______________ 。
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
(5)有机高分子材料聚酯纤维可由二酸与二醇通过缩聚形成。如100个乙二酸分子与100个乙二醇分子发生缩聚,当形成一条聚酯链时,其(平均)式量达到最大(如图所示,其式量为11618)。
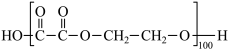
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长。现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长。
①共形成_____ 条聚酯链。
②计算所得聚酯的平均式量。_______________
(1)产生的氢气的体积为
(2)将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量。
(3)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为
(4)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% |
(5)有机高分子材料聚酯纤维可由二酸与二醇通过缩聚形成。如100个乙二酸分子与100个乙二醇分子发生缩聚,当形成一条聚酯链时,其(平均)式量达到最大(如图所示,其式量为11618)。
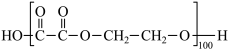
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长。现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长。
①共形成
②计算所得聚酯的平均式量。
2013·上海·零模 查看更多[1]
(已下线)上海市八校2013届高三下学期联合调研考试化学试题
更新时间:2020-03-29 11:05:51
|
相似题推荐
解答题-工业流程题
|
困难
(0.15)
名校
【推荐1】硫化钡(BaS)是一种用于制取含钡化合物和含硫化合物的化工原料。一种以BaS为原料生产氢氧化钡并获得某种副产品X和硫代硫酸钠( )的工艺流程如下:
)的工艺流程如下:
Ⅰ. 是黄色的离子,其化学性质与
是黄色的离子,其化学性质与 类似,具有一定的还原性,在酸性环境下会分解。
类似,具有一定的还原性,在酸性环境下会分解。
Ⅱ. 在碱性环境下稳定,在酸性环境下会分解。
在碱性环境下稳定,在酸性环境下会分解。 在水中溶解度很小。
在水中溶解度很小。
回答下列问题:
(1)制备BaS的方法是在高温下用无烟煤粉(主要成分为C)还原重晶石( ),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为
),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
(2)粗制BaS溶解于温热水中配制成BaS溶液,往其中通入 可发生反应生成
可发生反应生成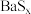 和
和 。下图是
。下图是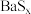 和
和 的溶解度随温度变化曲线,根据后面的流程推测,图中
的溶解度随温度变化曲线,根据后面的流程推测,图中_______ (填“甲”或“乙”)代表 的溶解度曲线。
的溶解度曲线。 中的x可变,当
中的x可变,当 时,
时,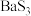 晶体的晶胞如下:
晶体的晶胞如下: ,则
,则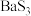 的密度为
的密度为_______  (用含a、b、c、
(用含a、b、c、 的式子表示)。
的式子表示)。
(4) 粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有
粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有_______ (填标号)。
a.NaClO溶液 b.稀 溶液 c.KI溶液
溶液 c.KI溶液
(5)往母液A中加入 溶液可得到副产品X,X的化学式为
溶液可得到副产品X,X的化学式为_______ 。已知温度较低时, 在水中溶解度会迅速减小。在这一步操作中
在水中溶解度会迅速减小。在这一步操作中 的用量一般为略微过量,原因是
的用量一般为略微过量,原因是_______ 。
(6)在碱性条件下往母液B中通入 可将
可将 氧化为
氧化为 ,若
,若 (即用
(即用 表示
表示 ),请写出该反应的离子方程式:
),请写出该反应的离子方程式:_______ 。
 )的工艺流程如下:
)的工艺流程如下: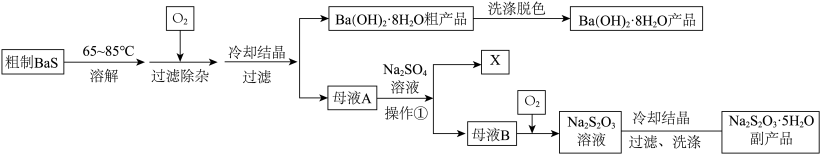
Ⅰ.
 是黄色的离子,其化学性质与
是黄色的离子,其化学性质与 类似,具有一定的还原性,在酸性环境下会分解。
类似,具有一定的还原性,在酸性环境下会分解。Ⅱ.
 在碱性环境下稳定,在酸性环境下会分解。
在碱性环境下稳定,在酸性环境下会分解。 在水中溶解度很小。
在水中溶解度很小。回答下列问题:
(1)制备BaS的方法是在高温下用无烟煤粉(主要成分为C)还原重晶石(
 ),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为
),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(2)粗制BaS溶解于温热水中配制成BaS溶液,往其中通入
 可发生反应生成
可发生反应生成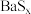 和
和 。下图是
。下图是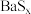 和
和 的溶解度随温度变化曲线,根据后面的流程推测,图中
的溶解度随温度变化曲线,根据后面的流程推测,图中 的溶解度曲线。
的溶解度曲线。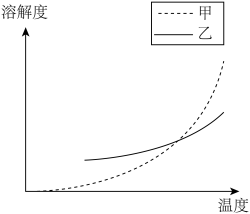
 中的x可变,当
中的x可变,当 时,
时,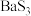 晶体的晶胞如下:
晶体的晶胞如下:
 ,则
,则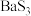 的密度为
的密度为 (用含a、b、c、
(用含a、b、c、 的式子表示)。
的式子表示)。(4)
 粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有
粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有a.NaClO溶液 b.稀
 溶液 c.KI溶液
溶液 c.KI溶液(5)往母液A中加入
 溶液可得到副产品X,X的化学式为
溶液可得到副产品X,X的化学式为 在水中溶解度会迅速减小。在这一步操作中
在水中溶解度会迅速减小。在这一步操作中 的用量一般为略微过量,原因是
的用量一般为略微过量,原因是(6)在碱性条件下往母液B中通入
 可将
可将 氧化为
氧化为 ,若
,若 (即用
(即用 表示
表示 ),请写出该反应的离子方程式:
),请写出该反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐2】雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中的主要离子方程式为___________ 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中。
向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:___________ 。
(3)装置Ⅱ中,发生了两个氧化还原反应,产物分别为NO2-和NO3-,写出酸性条件下生成NO3-的反应的离子方程式____________ 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。

①生成Ce4+从电解槽的___________ (填字母序号)口流出。
②写出阴极的反应式___________ 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___________ L。(用含a代数式表示)

(1)装置Ⅰ中的主要离子方程式为
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中。
向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:
(3)装置Ⅱ中,发生了两个氧化还原反应,产物分别为NO2-和NO3-,写出酸性条件下生成NO3-的反应的离子方程式
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。

①生成Ce4+从电解槽的
②写出阴极的反应式
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2
您最近一年使用:0次
【推荐3】某兴趣小组对化合物X开展实验探究。
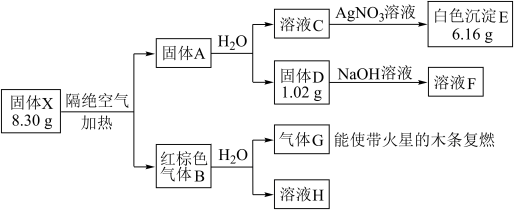
其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是_______________ (填元素符号),E的化学式是______________ 。
(2)固体X隔绝空气加热分解的化学方程式____________________________ 。
(3)写出溶液F与少量溶液H反应的离子方程式____________________________ 。
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为_______ mol/L (设溶质不扩散,)。
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:______________ 。

其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是
(2)固体X隔绝空气加热分解的化学方程式
(3)写出溶液F与少量溶液H反应的离子方程式
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:
您最近一年使用:0次
【推荐1】天然气(以甲烷计)在工业生产中用途广泛。
(1)Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸气转化法制H2的主要转化反应如下:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)ΔH=+206.2kJ/mol
CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)ΔH=+165.0kJ/mol
上述反应所得原料气中的CO能使合成氨催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是_______ 。
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如图所示:
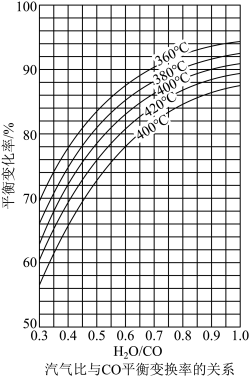
析图可知:
①相同温度时,CO平衡变换率与汽气比的关系是_______ 。
②汽气比相同时,CO平衡变换率与温度的关系是_______ 。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为Kp=_______ 。随温度的降低,该平衡常数_______ (填“增大”“减小”或“不变”)。
(4)Ⅱ.在熔融碳酸盐燃料电池中的应用以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如图:

①外电路电子流动方向:由_______ 流向_______ (填字母)。
②空气极发生反应的离子方程式是_______ 。
③以此燃料电池为电源电解精炼铜,当电路有0.6 mol e-转移,有_______ g 精铜析出。
(1)Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸气转化法制H2的主要转化反应如下:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)ΔH=+206.2kJ/mol
CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)ΔH=+165.0kJ/mol
上述反应所得原料气中的CO能使合成氨催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如图所示:

析图可知:
①相同温度时,CO平衡变换率与汽气比的关系是
②汽气比相同时,CO平衡变换率与温度的关系是
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为Kp=
(4)Ⅱ.在熔融碳酸盐燃料电池中的应用以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如图:

①外电路电子流动方向:由
②空气极发生反应的离子方程式是
③以此燃料电池为电源电解精炼铜,当电路有0.6 mol e-转移,有
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐2】分高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
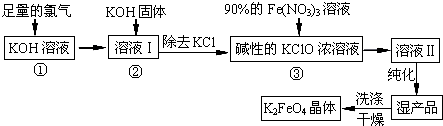
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式___________ ,该反应的氧化产物是___________ 。
(2)在溶液I中加入KOH固体的目的是___________ (填编号)
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为___________ 。
(4)如何判断K2FeO4晶体已经洗涤干净___________ 。
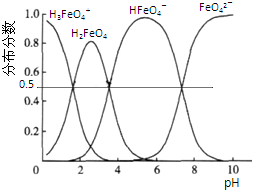
(5)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.其水溶液中FeO42-的存在形态如下图所示.下列说法正确的是___________ 。

(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式
(2)在溶液I中加入KOH固体的目的是
| A.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(4)如何判断K2FeO4晶体已经洗涤干净
(5)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.其水溶液中FeO42-的存在形态如下图所示.下列说法正确的是

| A.不论溶液酸碱性如何变化,铁元素都有4种存在形态 |
| B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先增大后减小 |
| C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O |
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐3】【加试题】甲醇水蒸气重整制氢(SRM)是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当 前研究主要集中在提高催化剂活性和降低尾气中CO含量,以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应I CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反应Ⅱ CH3OH(g) CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反应Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
请回答:
(1)反应Ⅱ能够自发进行的条件_______ (填 “低温”、“高温”或“任何温度”), ΔH1____ ΔH3(填 “>”、“<”或 “=” )。
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于_________ 。
(3)在常压、CaO催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得 CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示 CO2的选择性
① 下列说法不正确的是_____ 。
A.反应适宜温度为300℃
B.工业生产通 常在负压条件下进行甲醇水蒸气重整
C.已知 CaO催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃ 时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线_____ 。
(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是_________ 。
反应I CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1反应Ⅱ CH3OH(g)
 CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2反应Ⅲ.CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
| 125℃ | 225℃ | 325℃ | |
| K2 | 0.5535 | 185.8 | 9939.5 |
| K3 | 1577 | 137.5 | 28.14 |
请回答:
(1)反应Ⅱ能够自发进行的条件
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于
(3)在常压、CaO催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得 CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示 CO2的选择性
① 下列说法不正确的是
A.反应适宜温度为300℃
B.工业生产通 常在负压条件下进行甲醇水蒸气重整
C.已知 CaO催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃ 时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线
(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐1】I.乙酸、碳酸、次氯酸、亚磷酸(H3PO3)在生产、生活及医药方面有广泛用途。已知25℃时,部分物质的电离常数如表所示。
(1)根据表中数据,将pH=3的下列三种酸溶液分别稀释100倍,pH变化最小的是______ 。
a.CH3COOH b.H2CO3 c.HClO
(2)常温下相同浓度的下列溶液:①CH3COONH4②CH3COONa③CH3COOH,其中c(CH3COO-)由大到小的顺序是______ (填标号)。
(3)常温下,pH=10的CH3COONa溶液中,由水电离出来的c(OH-)=______ mol/L;请设计实验,比较常温下0.1mol/LCH3COONa溶液的水解程度和0.1mol/LCH3COOH溶液的电离程度大小:_____ (简述实验步骤和结论)。
Ⅱ.化学工业为疫情防控提供了强有力的物质支撑。许多含氯化合物既是重要化工原料,又是高效、广谱灭菌消毒剂。
(4)NaClO2是一种高效漂白剂。在NaClO2溶液中存在ClO2、HClO2、ClO 、Cl-等微粒。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-未画出)。
、Cl-等微粒。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-未画出)。
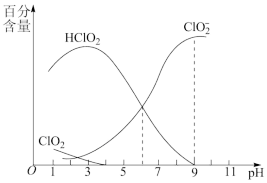
①25℃时,Ka(HClO2)=______ mol•L-1。
②25℃时,浓度均为0.1mol•L-1的HClO2溶液和NaClO2溶液等体积混合后,c(HClO2)______ c(ClO )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
(5)可利用如图装置测定气体ClO2的质量,过程如图:
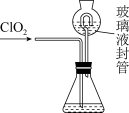
步骤1:在锥形瓶中加入足量KI(s),用100mL水溶解后,再加3mL稀硫酸;
步骤2:向玻璃液封管中加水;
步骤3:将生成的ClO2气体通入锥形瓶中被充分吸收(已知:ClO2+I-+H+→I2+Cl-+H2O,未配平);
步骤4:将玻璃液封管中的水封液全部倒入锥形瓶中,加入几滴淀粉溶液,用cmol•L-1Na2S2O3标准溶液滴定(I2+2S2O =2I-+S4O
=2I-+S4O ),消耗Na2S2O3溶液VmL。
),消耗Na2S2O3溶液VmL。
①滴定至终点的颜色变化是______ 。
②测得ClO2的质量m(ClO2)=______ (用含c,V的代数式表示)。
③下列操作将导致测定结果偏高的是______ (填标号)。
A.未将玻璃液封管中的水封液倒入锥形瓶中
B.滴定管未用标准液润洗
C.滴定前平视读数,滴定后俯视读数
D.滴定后,滴定管尖嘴处悬挂一滴液体
| 弱酸 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.8×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
a.CH3COOH b.H2CO3 c.HClO
(2)常温下相同浓度的下列溶液:①CH3COONH4②CH3COONa③CH3COOH,其中c(CH3COO-)由大到小的顺序是
(3)常温下,pH=10的CH3COONa溶液中,由水电离出来的c(OH-)=
Ⅱ.化学工业为疫情防控提供了强有力的物质支撑。许多含氯化合物既是重要化工原料,又是高效、广谱灭菌消毒剂。
(4)NaClO2是一种高效漂白剂。在NaClO2溶液中存在ClO2、HClO2、ClO
 、Cl-等微粒。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-未画出)。
、Cl-等微粒。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-未画出)。
①25℃时,Ka(HClO2)=
②25℃时,浓度均为0.1mol•L-1的HClO2溶液和NaClO2溶液等体积混合后,c(HClO2)
 )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。(5)可利用如图装置测定气体ClO2的质量,过程如图:

步骤1:在锥形瓶中加入足量KI(s),用100mL水溶解后,再加3mL稀硫酸;
步骤2:向玻璃液封管中加水;
步骤3:将生成的ClO2气体通入锥形瓶中被充分吸收(已知:ClO2+I-+H+→I2+Cl-+H2O,未配平);
步骤4:将玻璃液封管中的水封液全部倒入锥形瓶中,加入几滴淀粉溶液,用cmol•L-1Na2S2O3标准溶液滴定(I2+2S2O
 =2I-+S4O
=2I-+S4O ),消耗Na2S2O3溶液VmL。
),消耗Na2S2O3溶液VmL。①滴定至终点的颜色变化是
②测得ClO2的质量m(ClO2)=
③下列操作将导致测定结果偏高的是
A.未将玻璃液封管中的水封液倒入锥形瓶中
B.滴定管未用标准液润洗
C.滴定前平视读数,滴定后俯视读数
D.滴定后,滴定管尖嘴处悬挂一滴液体
您最近一年使用:0次
【推荐2】化合物X由四种元素组成,某实验小组按如下流程进行相关实验。
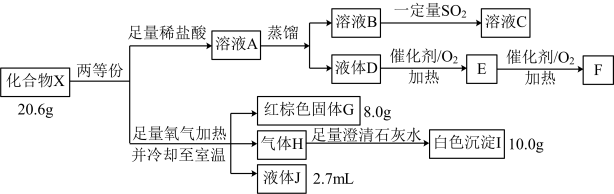
已知:J能使无水硫酸铜变蓝,上述物质中E和F能发生银镜反应。请回答:
(1)组成X的四种元素为_______ 。
(2)溶液A的溶质组成为_______ (用化学式表示)。
(3)写出 的化学方程式
的化学方程式_______ 。
(4)X可溶于HI溶液中,写出反应的离子方程式_______ 。
(5)设计实验,检验溶液C中可能的金属阳离子_______ 。

已知:J能使无水硫酸铜变蓝,上述物质中E和F能发生银镜反应。请回答:
(1)组成X的四种元素为
(2)溶液A的溶质组成为
(3)写出
 的化学方程式
的化学方程式(4)X可溶于HI溶液中,写出反应的离子方程式
(5)设计实验,检验溶液C中可能的金属阳离子
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐3】某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
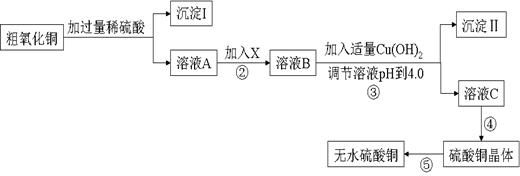
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
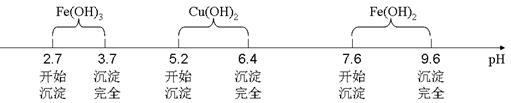
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是 (填序号)

① ② ③ ④ ⑤
(2)溶液A中所含溶质为 ;
(3)物质X应选用 (填序号),沉淀II的主要成分是
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为 。
(5)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度。过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL。
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.05000mol·L-1的Na2S2O3标准溶液滴定,前后共测定三组。达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
①CuSO4溶液与KI的反应的离子方程式为 。
②滴定中,试液Na2S2O3应放在 (填“酸式滴定管”或“碱式滴定管”),判断滴定终点的依据是 。
③溶液A中c(Cu2+)= mol·L-1

已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:

请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是 (填序号)

① ② ③ ④ ⑤
(2)溶液A中所含溶质为 ;
(3)物质X应选用 (填序号),沉淀II的主要成分是
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为 。
(5)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度。过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL。
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.05000mol·L-1的Na2S2O3标准溶液滴定,前后共测定三组。达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
②滴定中,试液Na2S2O3应放在 (填“酸式滴定管”或“碱式滴定管”),判断滴定终点的依据是 。
③溶液A中c(Cu2+)= mol·L-1
您最近一年使用:0次



