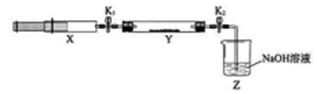
(1)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究:收集足量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
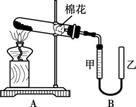
(2) 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示。
①读取装置B中收集到的气体体积时,需移动乙管与甲管中液面相齐,其目的是 。
②据报道高锰酸钾受热分解不产生MnO2,已知产气率= ×100%。若只发生KMnO4
×100%。若只发生KMnO4 KMnO2+O2↑,则产气率为 。
KMnO2+O2↑,则产气率为 。
③XRD谱显示还会分解产生K2MnO4和K2Mn4O8,写出分解产生这两种物质及氧气的化学方程式: 。

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ③_______________ | ④______________ |

(2) 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示。
①读取装置B中收集到的气体体积时,需移动乙管与甲管中液面相齐,其目的是 。
②据报道高锰酸钾受热分解不产生MnO2,已知产气率=
 ×100%。若只发生KMnO4
×100%。若只发生KMnO4 KMnO2+O2↑,则产气率为 。
KMnO2+O2↑,则产气率为 。③XRD谱显示还会分解产生K2MnO4和K2Mn4O8,写出分解产生这两种物质及氧气的化学方程式: 。
更新时间:2016-12-09 17:31:20
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】环己酮可作为涂料和油漆的溶剂。在实验室中以环己醇为原料制备环己酮的原理和装置如图所示(夹持及加热装置略)。

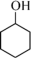

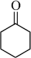 +H2O
+H2O
已知:环己醇、环己酮的部分物理性质如下表(括号中的沸点数据表示该有机物与水形成的具有固定组成的恒沸混合物的沸点)。
回答下列问题:
(1)仪器B的名称是_______ 。
(2)酸化 溶液时不能选用盐酸,原因是
溶液时不能选用盐酸,原因是_________ (用离子方程式表示)。
(3)该制备反应很剧烈,且放出大量的热。为控制反应体系温度在55~60 ℃范围内,可采取的措施一是加热方式选用______ ,二是在加入反应物时将______ (填化学式)缓慢滴加到其他试剂中。
(4)制备反应完成后,向混合物中加入适量水,蒸馏,收集95~100 ℃的馏分,得到主要含环己酮和水的混合物。采用先加入适量水然后蒸馏而非直接蒸馏,原因是___________ 。
(5)环己酮的提纯过程如下:
①在馏分中加NaCl固体至饱和,静置,分液,加NaCl的目的是_________ 。
②加入无水MgSO4块状固体,目的是________ 。
③________ (填操作名称)后进行蒸馏,收集150~156 ℃的馏分。
(6)数据处理。反应开始时加入8.4 mL(0.08 mol)环己醇和过量的酸化的 溶液。实验结束后收集到产品0.06 mol,则该合成反应的产率为
溶液。实验结束后收集到产品0.06 mol,则该合成反应的产率为________ 。



 +H2O
+H2O已知:环己醇、环己酮的部分物理性质如下表(括号中的沸点数据表示该有机物与水形成的具有固定组成的恒沸混合物的沸点)。
| 物质 | 沸点/(℃,1 atm) | 密度/(g·cm−3) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.96 | 能溶于水,易溶于常见有机溶剂 |
| 环己酮 | 155.6(95) | 0.94 | 微溶于水 |
(1)仪器B的名称是
(2)酸化
 溶液时不能选用盐酸,原因是
溶液时不能选用盐酸,原因是(3)该制备反应很剧烈,且放出大量的热。为控制反应体系温度在55~60 ℃范围内,可采取的措施一是加热方式选用
(4)制备反应完成后,向混合物中加入适量水,蒸馏,收集95~100 ℃的馏分,得到主要含环己酮和水的混合物。采用先加入适量水然后蒸馏而非直接蒸馏,原因是
(5)环己酮的提纯过程如下:
①在馏分中加NaCl固体至饱和,静置,分液,加NaCl的目的是
②加入无水MgSO4块状固体,目的是
③
(6)数据处理。反应开始时加入8.4 mL(0.08 mol)环己醇和过量的酸化的
 溶液。实验结束后收集到产品0.06 mol,则该合成反应的产率为
溶液。实验结束后收集到产品0.06 mol,则该合成反应的产率为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】石墨电极常用作惰性电极,但在电解过程中常伴有损耗(石墨的氧化和脱落)。
用如图所示装置分别电解下列溶液 (通过相同电量),记录阳极区的现象如下。
(通过相同电量),记录阳极区的现象如下。
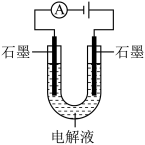
(1)甲中阳极产生气体的电极反应式是___________ 。
(2)甲所得阳极液中有 。某同学设计实验:向硫酸酸化的
。某同学设计实验:向硫酸酸化的 溶液中滴加几滴
溶液中滴加几滴 溶液,再滴入少量电解后的阳极液,溶液立即变红。该实验不能证明阳极液中含有
溶液,再滴入少量电解后的阳极液,溶液立即变红。该实验不能证明阳极液中含有 ,因为阳极液中还含有
,因为阳极液中还含有___________ (填物质)。
(3)探究乙所得阳极液的成分。
①证实该分散系是胶体:用激光笔照射阳极液,在与光束垂直的方向观察到___________ (填实验现象)。
②证实阳极液中含有 。
。
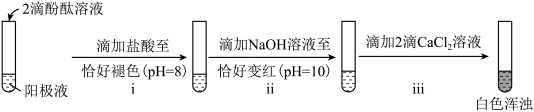
ⅰ和ⅱ的目的是排除 的干扰。ⅱ中反应的离子方程式是
的干扰。ⅱ中反应的离子方程式是___________ 。
(4)设计实验用化学方法证明,电解时甲和丙中阳极产生的气体不同:___________ 。
(5)仪器分析表明,析氧后的石墨电极表面与新打磨的石墨电极表面相比, 等含氧官能团的含量明显增加。
等含氧官能团的含量明显增加。
①结合石墨晶体结构分析,电解过程中石墨粉末脱落时破坏的作用力有___________ 。
②与甲对比,乙中脱落的石墨更易分散成胶体的原因是___________ 。
用如图所示装置分别电解下列溶液
 (通过相同电量),记录阳极区的现象如下。
(通过相同电量),记录阳极区的现象如下。| 编号 | 电解液 | 阳极区的现象 |
| 甲 |  | 有气体逸出,液体颜色不变,池底逐渐沉积黑色粉末 |
| 乙 |  | 有气体逸出,液体逐渐变为棕褐色 |
| 丙 |  | 有气体逸出,液体逐渐变为黄绿色,无黑色粉末 |

(1)甲中阳极产生气体的电极反应式是
(2)甲所得阳极液中有
 。某同学设计实验:向硫酸酸化的
。某同学设计实验:向硫酸酸化的 溶液中滴加几滴
溶液中滴加几滴 溶液,再滴入少量电解后的阳极液,溶液立即变红。该实验不能证明阳极液中含有
溶液,再滴入少量电解后的阳极液,溶液立即变红。该实验不能证明阳极液中含有 ,因为阳极液中还含有
,因为阳极液中还含有(3)探究乙所得阳极液的成分。
①证实该分散系是胶体:用激光笔照射阳极液,在与光束垂直的方向观察到
②证实阳极液中含有
 。
。
ⅰ和ⅱ的目的是排除
 的干扰。ⅱ中反应的离子方程式是
的干扰。ⅱ中反应的离子方程式是(4)设计实验用化学方法证明,电解时甲和丙中阳极产生的气体不同:
(5)仪器分析表明,析氧后的石墨电极表面与新打磨的石墨电极表面相比,
 等含氧官能团的含量明显增加。
等含氧官能团的含量明显增加。①结合石墨晶体结构分析,电解过程中石墨粉末脱落时破坏的作用力有
②与甲对比,乙中脱落的石墨更易分散成胶体的原因是
您最近半年使用:0次
【推荐3】某化学实验小组探究 与
与 溶液的反应。
溶液的反应。
实验一:用如图所示实验装置制备 ,并将足量
,并将足量 通入
通入 溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
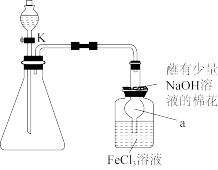
(1)制备 的化学反应方程式为
的化学反应方程式为_______ ;
(2)仪器a的名称为_______ ,按图示装好药品后,打开K之前的操作是_______ 。
(3)某同学取适量酸性 于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有Fe2+。此结论
于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有Fe2+。此结论_______ (填“正确”、“不正确”),理由是_______ 。
实验二:探究血红色溶液产生的原因
实验过程如下表:
(4)实验①中,Y是_______ (填化学式);实验②中现象是_______ ;实验③的结论是_______ 。
(5)为了进—步探究血红色物质产生主要原因,又进行了以下实验:
在0.5mL1mol/L的FeCl3溶液中,加入浓度相同的Na2SO3溶液V1mL,NaHSO3溶液V2mL并混合均匀,改变V1、V2的值并维持V1+V2=4.0进行多组实验,测得混合溶液的吸光度与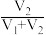 的关系如图所示。(已知吸光度越大,溶液颜色越深)。
的关系如图所示。(已知吸光度越大,溶液颜色越深)。
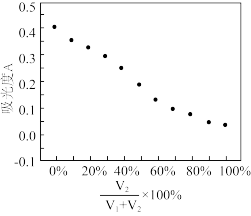
①维持V1+V2=4.0的目的是_______ 。
②该实验得出的结论是_______ 。
 与
与 溶液的反应。
溶液的反应。实验一:用如图所示实验装置制备
 ,并将足量
,并将足量 通入
通入 溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
(1)制备
 的化学反应方程式为
的化学反应方程式为(2)仪器a的名称为
(3)某同学取适量酸性
 于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有Fe2+。此结论
于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有Fe2+。此结论实验二:探究血红色溶液产生的原因
实验过程如下表:
| 实验序号 | 假设 | 实验内容 | 结论 |
| ① | 与溶液中c(H+)有关 | 取适量上述血红色溶液,滴入Y溶液,溶液又变为黄色 | 假设不成立 |
| ② | 与c(H2SO3)或c(SO2)有关 | 1溶液中,滴入1mol/LNaHSO3溶液,溶液呈血红色,再逐滴滴入HCl溶液,出现×××现象 | 假设不成立 |
| ③ | 与c( )或c( )或c( )有关 )有关 | 在FeCl3溶液中加入Na2SO3溶液,立即变为血红色。 |
(5)为了进—步探究血红色物质产生主要原因,又进行了以下实验:
在0.5mL1mol/L的FeCl3溶液中,加入浓度相同的Na2SO3溶液V1mL,NaHSO3溶液V2mL并混合均匀,改变V1、V2的值并维持V1+V2=4.0进行多组实验,测得混合溶液的吸光度与
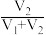 的关系如图所示。(已知吸光度越大,溶液颜色越深)。
的关系如图所示。(已知吸光度越大,溶液颜色越深)。
①维持V1+V2=4.0的目的是
②该实验得出的结论是
您最近半年使用:0次



