聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:

(1)验证固体W焙烧后产生的气体含有SO2的方法是____ 。
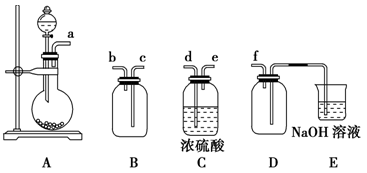
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,写出实验室制备SO2气体化学方程式:_____ 按气流方向连接各仪器接口,顺序为a→___ →___ →____ →____ →f。装置D的作用是_______ 。
(3)制备绿矾时,向溶液X中加入过量________ ,充分反应后,经_______ 操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH,下列记录结果正确的是:( )
a. 氯水的PH为2.3 b. 氢氧化钠溶液的PH为11.0
c. 硫酸铁溶液的PH为1 d. 硫酸氢钠溶液的PH为7

(1)验证固体W焙烧后产生的气体含有SO2的方法是

(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,写出实验室制备SO2气体化学方程式:
(3)制备绿矾时,向溶液X中加入过量
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH,下列记录结果正确的是:
a. 氯水的PH为2.3 b. 氢氧化钠溶液的PH为11.0
c. 硫酸铁溶液的PH为1 d. 硫酸氢钠溶液的PH为7
更新时间:2017-02-17 14:57:34
|
【知识点】 化学实验基础
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下。
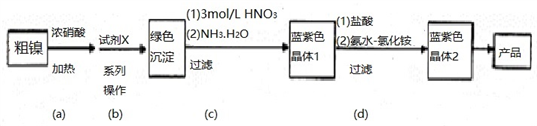
已知:①部分离子生成氢氧化物沉淀的pH如下表所示。
②Ni( OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
(1)步骤(a)中Ni和浓硝酸反应的化学方程式为__________________________________ 。
(2)步骤(b)首先加入试剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是____________________________________________ 。
②试剂X可以是___________________ (填标号)。
A. H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(3)NH3含量的测定
i.用电子天平称量mg产品于锥形瓶中,用25 mL水溶解后加入3.00 mL6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.5000 mol/L NaOH标准溶液V1mL;
ii.空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
①NH3的质量分数为___________________________ 。
②在上述方案的基础上,下列措施能进一步提高测定准确度的有___________ (填标号)。
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸
C.用酚酞替代甲基橙 D.进行平行试验
(4)为测定Cl的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25 mL水溶解,___________________________________ ,滴入2—3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2-3次。

已知:①部分离子生成氢氧化物沉淀的pH如下表所示。
②Ni( OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
| 离子 | Fe3+ | Cr3+ | Ni2+ |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
(2)步骤(b)首先加入试剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是
②试剂X可以是
A. H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(3)NH3含量的测定
i.用电子天平称量mg产品于锥形瓶中,用25 mL水溶解后加入3.00 mL6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.5000 mol/L NaOH标准溶液V1mL;
ii.空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
①NH3的质量分数为
②在上述方案的基础上,下列措施能进一步提高测定准确度的有
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸
C.用酚酞替代甲基橙 D.进行平行试验
(4)为测定Cl的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25 mL水溶解,
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
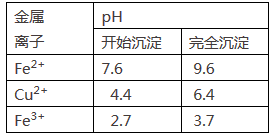
【推荐2】(1)刘安《淮南万毕术》中“曾青得铁则化为铜”是古代湿法炼铜的真实写照。除去CuSO4溶液中少量的Fe2+,可以按照下面的流程进行:
已知:Fe2+、Cu2+、Fe3+三种离子开始沉淀和完全沉淀时溶液pH值如下表:
①下列物质中适合作为试剂X的是____________
②加入的Y及调节的pH范围是_____________
(2)已知常温下,Ksp[Cu(OH)2]=2×10-20,通过上述流程得到的CuSO4溶液中,c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于_________ 。
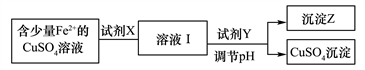
已知:Fe2+、Cu2+、Fe3+三种离子开始沉淀和完全沉淀时溶液pH值如下表:

①下列物质中适合作为试剂X的是
A.H2O2 B.KMnO4
C.HNO3 D.Cl2
②加入的Y及调节的pH范围是
A.Cu(OH)2 3.7~4.3 B.CuO 3.7~6.4
C.NaOH 3.7~4.2 D.NH3·H2O 3.7~4.0
(2)已知常温下,Ksp[Cu(OH)2]=2×10-20,通过上述流程得到的CuSO4溶液中,c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】亚硝酸钠(NaNO2)是一种常 见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并进行纯度测定(夹持装置及A中加热装置已略去)。

已知:①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4溶液氧化成NO , MnO
, MnO 被还原为Mn2+。
被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2; S2O 能把I2还原为I-。
能把I2还原为I-。
(1)装置A中盛装浓HNO3的仪器名称为_______ ,三领烧瓶中发生反应的化学方程式为_______ 。
(2)二氧化氮在装置B中与水反应转化为一氧化氮, 其中铜发生反应的离子方程式为_______ 。
(3)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是_______(填序号)。
(4)E装置的作用是_______ ,若撤去装置E中试管,则导管口可能看到的现象为_______ 。
(5)利用滴定的方法进行纯度测定。
可供选择的试剂有: A.稀硫酸 B.稀硝酸 C.c1mol·L-1KI溶液 D.淀粉溶液 E. c2mol·L -1Na2S2O3溶液 F. c3 mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,须选用的试剂是_______ (填序号),滴定终点的现象为_______ 。
②利用NaNO2的氧化性来测定其纯度,须选用的试剂有_______ (填序号)。

已知:①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4溶液氧化成NO
 , MnO
, MnO 被还原为Mn2+。
被还原为Mn2+。③在酸性条件下NaNO2能把I-氧化为I2; S2O
 能把I2还原为I-。
能把I2还原为I-。(1)装置A中盛装浓HNO3的仪器名称为
(2)二氧化氮在装置B中与水反应转化为一氧化氮, 其中铜发生反应的离子方程式为
(3)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是_______(填序号)。
| A.P2O5 | B.碱石灰 | C.无水CaCl2 | D.氧化钙 |
(5)利用滴定的方法进行纯度测定。
可供选择的试剂有: A.稀硫酸 B.稀硝酸 C.c1mol·L-1KI溶液 D.淀粉溶液 E. c2mol·L -1Na2S2O3溶液 F. c3 mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,须选用的试剂是
②利用NaNO2的氧化性来测定其纯度,须选用的试剂有
您最近半年使用:0次



