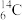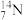(1)用下列各组物质序号填空:
①O2和O3 ; ②12C、13C、14C; ③C2H6和C5H12; ④C3H6和C5H10; ⑤14N、14C ⑥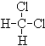 和
和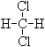 ;⑦CH3(CH2)3CH3和
;⑦CH3(CH2)3CH3和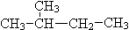
互为同位素的是_____ ;互为同素异形体的是_____ ;互为同系物的是_____ ;互为同分异构体的是_____ ;属于同一物质的是______ 。
(2)除去溴苯中的溴:试剂是:_____ ,反应的化学方程式为__________
(3)一定质量的乙醇在氧气不足时燃烧,得到CO、CO2和H2O质量共为27.6g,若H2O的质量为10.8g,则CO2的质量为______ g
(4)2gC2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,则C2H2燃烧热的热化学方程式:______ 。
①O2和O3 ; ②12C、13C、14C; ③C2H6和C5H12; ④C3H6和C5H10; ⑤14N、14C ⑥
 和
和 ;⑦CH3(CH2)3CH3和
;⑦CH3(CH2)3CH3和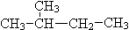
互为同位素的是
(2)除去溴苯中的溴:试剂是:
(3)一定质量的乙醇在氧气不足时燃烧,得到CO、CO2和H2O质量共为27.6g,若H2O的质量为10.8g,则CO2的质量为
(4)2gC2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,则C2H2燃烧热的热化学方程式:
更新时间:2017-07-04 17:37:16
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】依据叙述,写出下列反应的热化学方程式。
(1)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出450 kJ的热量。其热化学方程式为______________________ 。
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、395 kJ、940 kJ,则N2与H2反应生成NH3的热化学方程式为____________________________ 。
(3)钛(Ti)被称为继铁、铝之后的第三金属,已知由金红石(TiO2)制取单质Ti,涉及的步骤为:
已知:①C(s)+O2(g) CO2(g); ΔH=-395.5 kJ·mol-1
CO2(g); ΔH=-395.5 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g); ΔH=-560 kJ·mol-1
2CO2(g); ΔH=-560 kJ·mol-1
③TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
则TiO2(s)与Cl2(g)反应的热化学方程式为______________________________ 。
(1)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出450 kJ的热量。其热化学方程式为
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、395 kJ、940 kJ,则N2与H2反应生成NH3的热化学方程式为
(3)钛(Ti)被称为继铁、铝之后的第三金属,已知由金红石(TiO2)制取单质Ti,涉及的步骤为:

已知:①C(s)+O2(g)
 CO2(g); ΔH=-395.5 kJ·mol-1
CO2(g); ΔH=-395.5 kJ·mol-1②2CO(g)+O2(g)
 2CO2(g); ΔH=-560 kJ·mol-1
2CO2(g); ΔH=-560 kJ·mol-1③TiO2(s)+2Cl2(g)+2C(s)
 TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
TiCl4(s)+2CO(g)的ΔH=―80kJ/mol则TiO2(s)与Cl2(g)反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______ 。加入催化剂E1________ (填“增大”、“减小”或“不变”)。

(2)若已知下列数据:
试根据表中及图中数据计算N—H的键能:_______ kJ·mol−1。
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________ 。
(4)试比较下列两组ΔH的大小(填“>”、“<”或“=”)
①H2(g)+ O2(g)=H2O(g) ΔH1;H2(g)+
O2(g)=H2O(g) ΔH1;H2(g)+ O2(g)=H2O(l) ΔH2;则ΔH1
O2(g)=H2O(l) ΔH2;则ΔH1____ ΔH2。
②S(s)+O2(g)=SO2(g) ΔH3;Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) ΔH4;则ΔH3_____ ΔH4。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(2)若已知下列数据:
| 化学键 | H—H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=
(4)试比较下列两组ΔH的大小(填“>”、“<”或“=”)
①H2(g)+
 O2(g)=H2O(g) ΔH1;H2(g)+
O2(g)=H2O(g) ΔH1;H2(g)+ O2(g)=H2O(l) ΔH2;则ΔH1
O2(g)=H2O(l) ΔH2;则ΔH1②S(s)+O2(g)=SO2(g) ΔH3;Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) ΔH4;则ΔH3
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】CO2是一种廉价的碳资源,资源化利用CO2具有重要的工业与环境意义。
(1)下列物质理论上可以作为CO2捕获剂的是____ (填序号)。
A.NH4Cl溶液 B.(NH4)2CO3溶液 C.氨水 D.稀H2SO4
(2)以TiO2为催化剂的光热化学循环分解CO2反应为碳减排提供了一个新途径。该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。

该转化过程①中会____ 能量(填“吸收”或“释放”);CO2分解反应的热化学方程式为______ ,实现该反应的能量转化方式是________ 。
(3)O2辅助的Al-CO2电池能有效利用CO2,且电池反应产物Al2(C2O4)。是重要的化工原料,工作原理如图所示。若正极上CO2还原生成C2O ,则正极的反应式为
,则正极的反应式为___ ;电路中转移1 mol电子,需消耗CO2_____ L(标准状况)。

(1)下列物质理论上可以作为CO2捕获剂的是
A.NH4Cl溶液 B.(NH4)2CO3溶液 C.氨水 D.稀H2SO4
(2)以TiO2为催化剂的光热化学循环分解CO2反应为碳减排提供了一个新途径。该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。

该转化过程①中会
(3)O2辅助的Al-CO2电池能有效利用CO2,且电池反应产物Al2(C2O4)。是重要的化工原料,工作原理如图所示。若正极上CO2还原生成C2O
 ,则正极的反应式为
,则正极的反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】现有六种有机物,请回答下列问题:
A.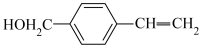 B.
B.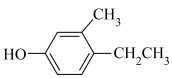 C.
C.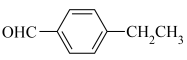 D.
D.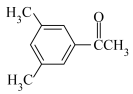 E.
E.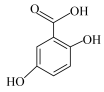 F.
F. G.
G. 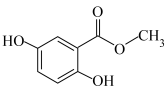
(1)A的分子式为_______ 。
(2)D的一氯代物最多有_______ 种。
(3)E中含有的官能团名称为_______ 。
(4)上述化合物中互为同分异构体的是_______ (填字母,下同);互为同系物的是_______ 。
A.
 B.
B. C.
C. D.
D. E.
E. F.
F. G.
G. 
(1)A的分子式为
(2)D的一氯代物最多有
(3)E中含有的官能团名称为
(4)上述化合物中互为同分异构体的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】现有下列几种有机物:
(1)属于芳香烃的是___________ (填序号,下同)。
(2)②中的官能团的名称为___________ , 杂化的碳原子数为
杂化的碳原子数为___________ 。
(3)互为同分异构体的是___________ 。
(4)互为同系物的是___________ 。
(5)用系统命名法给⑦命名,其名称为___________ 。
(6)2,3-二甲基-4-乙基己烷的结构简式___________ 。
①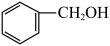 ②
②  ③
③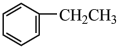 ⑥
⑥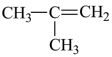 ⑤
⑤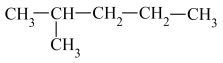
⑥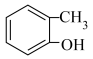 ⑦
⑦ ⑧
⑧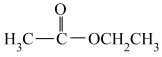
(1)属于芳香烃的是
(2)②中的官能团的名称为
 杂化的碳原子数为
杂化的碳原子数为(3)互为同分异构体的是
(4)互为同系物的是
(5)用系统命名法给⑦命名,其名称为
(6)2,3-二甲基-4-乙基己烷的结构简式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】如图是两种有机物分子的结构模型:
Ⅰ.下图是辛烷的一种结构 (只画出了碳骨架,没有画出氢原子),回答下列问题:
(只画出了碳骨架,没有画出氢原子),回答下列问题:

(1)用系统命名法命名图1中的物质:___________ 。
(2)M的一氯代物有___________ 种(不考虑立体异构)。
(3)支链有一个甲基和一个乙基的 的同分异构体有
的同分异构体有___________ 种。
Ⅱ.图2分子中含 、
、 、
、 三种元素,分子中共有12个原子,图中球与球之间的连线代表单键、双键等化学键。
三种元素,分子中共有12个原子,图中球与球之间的连线代表单键、双键等化学键。
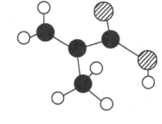
(4)该物质的结构简式为___________ 。
(5)该物质中所含官能团的名称为___________ 。
(6)下列物质中,与该物质互为同系物的是___________ (填序号,下同);互为同分异构体的是___________ 。
①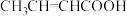 ②
②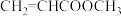 ③
③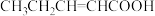 ④
④
Ⅰ.下图是辛烷的一种结构
 (只画出了碳骨架,没有画出氢原子),回答下列问题:
(只画出了碳骨架,没有画出氢原子),回答下列问题:
(1)用系统命名法命名图1中的物质:
(2)M的一氯代物有
(3)支链有一个甲基和一个乙基的
 的同分异构体有
的同分异构体有Ⅱ.图2分子中含
 、
、 、
、 三种元素,分子中共有12个原子,图中球与球之间的连线代表单键、双键等化学键。
三种元素,分子中共有12个原子,图中球与球之间的连线代表单键、双键等化学键。
(4)该物质的结构简式为
(5)该物质中所含官能团的名称为
(6)下列物质中,与该物质互为同系物的是
①
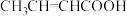 ②
②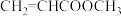 ③
③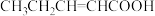 ④
④
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列问题
(1)下列是四种环状的烃类物质:
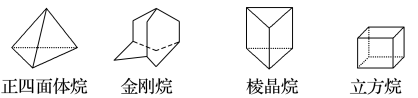
①金刚烷的一氯取代产物有_______ 种;
②正四面体烷的二氯取代产物有_______ 种;
③立方烷的二氯取代产物有_______ 种。
(2)写出苯与浓硝酸、浓硫酸共热时发生反应的化学方程式_______ 。
(3)某烃的结构式用键线式可表示为 ,若该烃与
,若该烃与 发生加成反应(反应物的物质的量之比为1∶1),则所得产物(不考虑顺反异构)有
发生加成反应(反应物的物质的量之比为1∶1),则所得产物(不考虑顺反异构)有_______ 种。
(1)下列是四种环状的烃类物质:

①金刚烷的一氯取代产物有
②正四面体烷的二氯取代产物有
③立方烷的二氯取代产物有
(2)写出苯与浓硝酸、浓硫酸共热时发生反应的化学方程式
(3)某烃的结构式用键线式可表示为
 ,若该烃与
,若该烃与 发生加成反应(反应物的物质的量之比为1∶1),则所得产物(不考虑顺反异构)有
发生加成反应(反应物的物质的量之比为1∶1),则所得产物(不考虑顺反异构)有
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】烃被看作有机物的母体,请完成下列与烃的知识相关的练习:
(1)1 mol链烃最多能和2 mol氯气发生加成反应,生成氯代烃。1 mol该氯代烃又能和6 mol氯气发生取代反应,生成只含碳元素和氯元素的氯代烃。该烃的分子式___________ ,其可能的结构简式有______ 种;
(2)A、B、C三种烯烃各7 g分别能与0.2 g H2完全加成,反应后得到相同产物D。产物D的结构简式为________________ ,任写A、B、C中一种的名称___________ ;
(3)人们对苯的认识有一个不断深化的过程。
①已知: 。1834年德国科学家米希尔里希,通过蒸馏苯甲酸(
。1834年德国科学家米希尔里希,通过蒸馏苯甲酸( )和石灰的混合物得的液体命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式
)和石灰的混合物得的液体命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式_____________________________________________ ;
②由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种含叁键且无支链链烃的结构简式____________________________ ;苯不能使溴水褪色,性质类似烷烃,任写一个苯发生取代反应的化学方程式____________________________ ;
③烷烃中脱水2 mol氢原子形成1 mol双键要吸热,但1,3—环己二烯( )脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯
)脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯________ (填“稳定”或“不稳定”);
④1866年凯库勒(下图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列_____________ 事实(填入编号)

a.苯不能使溴水褪色 b.苯能与H2发生加成反应
c.溴苯没有同分异构体 d.邻二溴苯只有一种
⑤现代化学认为苯分子碳碳之间的键是________________________________ 。
(1)1 mol链烃最多能和2 mol氯气发生加成反应,生成氯代烃。1 mol该氯代烃又能和6 mol氯气发生取代反应,生成只含碳元素和氯元素的氯代烃。该烃的分子式
(2)A、B、C三种烯烃各7 g分别能与0.2 g H2完全加成,反应后得到相同产物D。产物D的结构简式为
(3)人们对苯的认识有一个不断深化的过程。
①已知:
 。1834年德国科学家米希尔里希,通过蒸馏苯甲酸(
。1834年德国科学家米希尔里希,通过蒸馏苯甲酸( )和石灰的混合物得的液体命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式
)和石灰的混合物得的液体命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式②由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种含叁键且无支链链烃的结构简式
③烷烃中脱水2 mol氢原子形成1 mol双键要吸热,但1,3—环己二烯(
 )脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯
)脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯④1866年凯库勒(下图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列

a.苯不能使溴水褪色 b.苯能与H2发生加成反应
c.溴苯没有同分异构体 d.邻二溴苯只有一种
⑤现代化学认为苯分子碳碳之间的键是
您最近一年使用:0次
【推荐1】按要求回答下列问题
(1)12C和14C 互为________
(2)东汉末年狐刚子发明的制硫酸的方法如下:一炉中以炭烧石胆(CuSO4∙5H2O)使作烟,以物扇之,其精华尽入铜盘,炉中却火待冷,开取任用。其中“烟”溶于水即得硫酸,则“烟”是________
(3)粗盐中含有MgCl2 、Na2SO4、CaCl2等可溶性杂质,为制备精制食盐可选用①NaOH溶液②BaCl2溶液和③Na2CO3溶液来除杂,这三种试剂加入的顺序可以是( )
(4)下面是一些我们熟悉的物质:①O2 ②HCl ③H2SO4 ④NH4Cl ⑤NaHSO4 ⑥Ar ⑦Na2O2 ⑧NaOH
a.上述物质中,既含有非极性键又含有离子键的是________ ;属于共价化合物的是________ (以上均填序号)。
b.将NaHSO4溶于水,破坏了NaHSO4中的________ ,写出其电离方程式_________ 。
(1)12C和14C 互为
(2)东汉末年狐刚子发明的制硫酸的方法如下:一炉中以炭烧石胆(CuSO4∙5H2O)使作烟,以物扇之,其精华尽入铜盘,炉中却火待冷,开取任用。其中“烟”溶于水即得硫酸,则“烟”是
(3)粗盐中含有MgCl2 、Na2SO4、CaCl2等可溶性杂质,为制备精制食盐可选用①NaOH溶液②BaCl2溶液和③Na2CO3溶液来除杂,这三种试剂加入的顺序可以是( )
| A.①②③ | B.③①② | C.①③② | D.②③① |
a.上述物质中,既含有非极性键又含有离子键的是
b.将NaHSO4溶于水,破坏了NaHSO4中的
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】完成下列问题
(1)有下列微粒或物质:①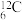 、
、 、
、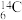 ②石墨、金刚石 ③
②石墨、金刚石 ③ 、
、 、
、 ④H、D、T ⑤
④H、D、T ⑤ 、
、 ⑥
⑥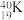 、
、 、
、 ,回答下列问题:
,回答下列问题:
互为同素异形体的是___________ ;上述微粒中出现的核素符号有___________ 种
(2)下列变化:
① 溶于水;②酒精溶于水;③KOH溶于水;④
溶于水;②酒精溶于水;③KOH溶于水;④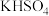 溶于水;⑤
溶于水;⑤ 溶于水;⑥碘升华;⑦
溶于水;⑥碘升华;⑦ 溶于水;③冰融化;⑨
溶于水;③冰融化;⑨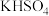 熔化;⑩
熔化;⑩ 熔化(填序号)。
熔化(填序号)。
没有化学键被破坏的是:___________ ;只有离子键被破坏的是:___________
(3)2023年是门捷列夫发现元素周期律154周年,如图为元素周期表的一部分。其中①的简单氢化物能与其最高价氧化物的水化物反应生成一种离子化合物。回答下列问题:

ⅰ)元素In在元素周期表中的位置为___________
ⅱ)Sb的最高价氧化物为___________ (填化学式)。
ⅲ)根据元素周期律推断:
a.阴影部分元素形成的简单气态氢化物中,热稳定性最强的物质与③的最高价氧化物反应的化学方程式___________ ;
b.酸性:
___________ 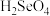 (填“>”“<”或“=”);
(填“>”“<”或“=”);
c.②④元素的氢化物的还原性更强的是:___________ (填化学式)。
iiii)写出元素①形成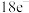 分子的电子式:
分子的电子式:___________ 。
(1)有下列微粒或物质:①
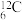 、
、 、
、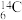 ②石墨、金刚石 ③
②石墨、金刚石 ③ 、
、 、
、 ④H、D、T ⑤
④H、D、T ⑤ 、
、 ⑥
⑥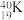 、
、 、
、 ,回答下列问题:
,回答下列问题:互为同素异形体的是
(2)下列变化:
①
 溶于水;②酒精溶于水;③KOH溶于水;④
溶于水;②酒精溶于水;③KOH溶于水;④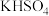 溶于水;⑤
溶于水;⑤ 溶于水;⑥碘升华;⑦
溶于水;⑥碘升华;⑦ 溶于水;③冰融化;⑨
溶于水;③冰融化;⑨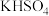 熔化;⑩
熔化;⑩ 熔化(填序号)。
熔化(填序号)。没有化学键被破坏的是:
(3)2023年是门捷列夫发现元素周期律154周年,如图为元素周期表的一部分。其中①的简单氢化物能与其最高价氧化物的水化物反应生成一种离子化合物。回答下列问题:

ⅰ)元素In在元素周期表中的位置为
ⅱ)Sb的最高价氧化物为
ⅲ)根据元素周期律推断:
a.阴影部分元素形成的简单气态氢化物中,热稳定性最强的物质与③的最高价氧化物反应的化学方程式
b.酸性:

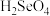 (填“>”“<”或“=”);
(填“>”“<”或“=”);c.②④元素的氢化物的还原性更强的是:
iiii)写出元素①形成
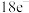 分子的电子式:
分子的电子式:
您最近一年使用:0次

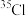 ②金刚石 ③CO
②金刚石 ③CO