硝酸跟金属反应时,随着硝酸浓度的下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH4NO3中的一种或几种。现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):
请回答下列问题:
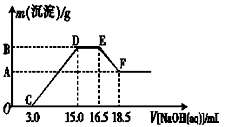
(1)由图可知,往反应后的澄清溶液中加入NaOH溶液没有立即出现沉淀,其原因是______________________________ 。
(2)混合物跟稀硝酸充分反应后的产物中铁元素的化合价是___ 。
(3)写出图中D―→E阶段所发生的反应的离子方程式:____________________ 。
(4)纵坐标中A点的数值是_________ ,原硝酸的浓度是_____________ 。
请回答下列问题:

(1)由图可知,往反应后的澄清溶液中加入NaOH溶液没有立即出现沉淀,其原因是
(2)混合物跟稀硝酸充分反应后的产物中铁元素的化合价是
(3)写出图中D―→E阶段所发生的反应的离子方程式:
(4)纵坐标中A点的数值是
更新时间:2017-08-03 10:41:09
|
相似题推荐
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)32g铜投入一定浓度的硝酸溶液中,铜完全溶解,共收集到NO和NO2的混合气体8.96 L气体(标准状况)。
①计算产生NO的体积(标准状况)___________ L;
②将盛有此混合气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积为___________ L。
(2)向100 mL 0.8 mol·L-1硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出标准状况下的气体224 mL,且测得溶液中铁只以Fe2+形式存在,为使Fe2+完全沉淀,可向反应后的溶液中加入0.1 mol·L-1的NaOH溶液___________ mL。
①计算产生NO的体积(标准状况)
②将盛有此混合气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积为
(2)向100 mL 0.8 mol·L-1硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出标准状况下的气体224 mL,且测得溶液中铁只以Fe2+形式存在,为使Fe2+完全沉淀,可向反应后的溶液中加入0.1 mol·L-1的NaOH溶液
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】将20.0 g铜镁合金完全溶解于140 mL某浓度的硝酸中,得到NO2和NO的混合气体8.96 L(标准状况),当向反应后的溶液中加入320 mL 4.0 mol/L NaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为37 g。通过计算回答下列问题:
(1)该合金中铜与镁的物质的量之比是_______ 。
(2)该硝酸中HNO3的物质的量浓度是_______ mol/L。
(3)NO2和NO的混合气体中,NO2的体积分数是_______ 。
(4)若将混合气体与水混合完全转化为硝酸,则需要通入的氧气(标准状况)的体积为_______ L。
(1)该合金中铜与镁的物质的量之比是
(2)该硝酸中HNO3的物质的量浓度是
(3)NO2和NO的混合气体中,NO2的体积分数是
(4)若将混合气体与水混合完全转化为硝酸,则需要通入的氧气(标准状况)的体积为
您最近一年使用:0次

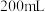
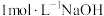 溶液,恰好使溶液中
溶液,恰好使溶液中 全部转化为沉淀。假设溶液体积不变,请计算:
全部转化为沉淀。假设溶液体积不变,请计算: 。
。


