钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:
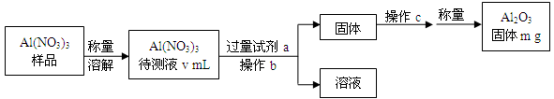
①加入试剂a后发生反应的离子方程式为_________ 。
②操作b为_________ ,操作c为_________ 。
③Al(NO3)3待测液中,c (Al3+) =__________ mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
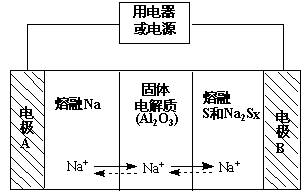
①根据下表数据,请你判断该电池工作的适宜温度应控制在_________ 范围内(填字母序号)。
a.100℃以下 b.100℃~300℃ c. 300℃~350℃ d. 350℃~2050℃
②放电时,电极A为_________ 极。
③放电时,内电路中Na+的移动方向为_________ (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx =" 2Na" + xS(3<x<5),则阳极的电极反应式为_________ 。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:

①加入试剂a后发生反应的离子方程式为
②操作b为
③Al(NO3)3待测液中,c (Al3+) =
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:

①根据下表数据,请你判断该电池工作的适宜温度应控制在
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
a.100℃以下 b.100℃~300℃ c. 300℃~350℃ d. 350℃~2050℃
②放电时,电极A为
③放电时,内电路中Na+的移动方向为
④充电时,总反应为Na2Sx =" 2Na" + xS(3<x<5),则阳极的电极反应式为
更新时间:2017-11-04 21:45:13
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)高铁电池作为新型可充电电池,具有放电曲线平坦,高能高容量,原料丰富,绿色无污染等优点。图1为简易的高铁电池的工作装置。已知:放电后,两极都产生红褐色悬浮物。
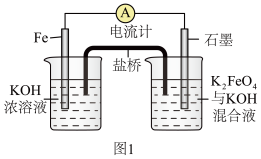
请回答下列问题:
①该电池放电时的总反应的离子方程式为_______ 。
②放电时,若盐桥中为KCl,则右池中K+浓度_______ 。(填“变大”“变小”或“不变”)
(2)现用蓄电池 为电源,制取少量高铁酸钾。反应装置如图2所示:
为电源,制取少量高铁酸钾。反应装置如图2所示:
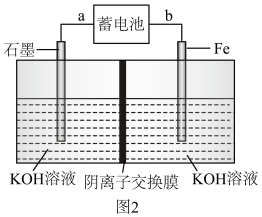
①工作时,蓄电池的负极为_______ 。(填“Fe”或“ NiO2 ”)
②写出电解池中铁电极发生的电极反应式_______ 。
③当消耗掉0.1mol NiO2时,理论上生成高铁酸钾_______ g。
(1)高铁电池作为新型可充电电池,具有放电曲线平坦,高能高容量,原料丰富,绿色无污染等优点。图1为简易的高铁电池的工作装置。已知:放电后,两极都产生红褐色悬浮物。

请回答下列问题:
①该电池放电时的总反应的离子方程式为
②放电时,若盐桥中为KCl,则右池中K+浓度
(2)现用蓄电池
 为电源,制取少量高铁酸钾。反应装置如图2所示:
为电源,制取少量高铁酸钾。反应装置如图2所示:
①工作时,蓄电池的负极为
②写出电解池中铁电极发生的电极反应式
③当消耗掉0.1mol NiO2时,理论上生成高铁酸钾
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。
(1)在空气酸度不大的环境中,其正极反应式为___________________
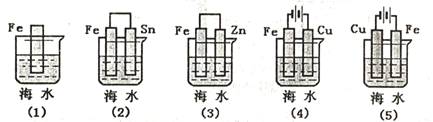
(2)下列各情况,在其中Fe片腐蚀由快到慢的顺序是___________ (用序号表示)。
(3)下图装置的盐桥中盛有饱和NH4NO3琼脂溶液,能够连接两份电解质溶液,形成闭合回路:
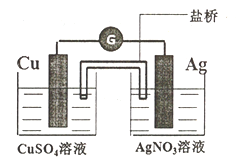
①该装置的能量转化形式为:_________ ,装置工作时,盐桥中的NH4+移向___________ 。(“CuSO4溶液”或“AgNO3溶液”)
②若将盐桥换成铜丝,电路中也有电流通过,则铜丝左端为_________ 极,该极反应式为:___________ 。
(4)运用原电池原理,设计实验验证Cu2+、Fe3+氧化性的强弱,在下图方框内画出实验装置图_____________ (要求:设计一个带盐桥的原电池,标出电极名称及电解质溶液)。该原电池正极反应式__________________ 。
(1)在空气酸度不大的环境中,其正极反应式为
(2)下列各情况,在其中Fe片腐蚀由快到慢的顺序是

(3)下图装置的盐桥中盛有饱和NH4NO3琼脂溶液,能够连接两份电解质溶液,形成闭合回路:

①该装置的能量转化形式为:
②若将盐桥换成铜丝,电路中也有电流通过,则铜丝左端为
(4)运用原电池原理,设计实验验证Cu2+、Fe3+氧化性的强弱,在下图方框内画出实验装置图
您最近一年使用:0次
【推荐1】(1)已知拆开1molH-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mol NH3时反应放出___________ kJ 的热量。
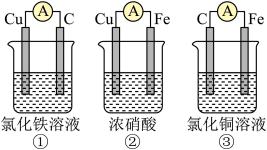
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________ (填序号)。
(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
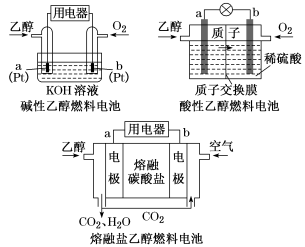
①三种乙醇燃料电池中正极反应物均为______________________ ;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________ ;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为______________________________ 。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是

(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为
②碱性乙醇燃料电池中,电极a上发生的电极反应式为
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)锂锰电池的体积小,性能优良,是常用的一次电池。该电池的反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移进入MnO2晶格中,生成LiMnO2。回答下列问题:
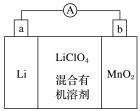
①外电路的电流方向是由________ (填“a”或“b”,下同)极流向________ 极。
②电池的正极反应式为__________ 。
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:

①该电池中外电路电子的流动方向为____________ (填“从A到B”或“从B到A”)。
②工作结束后,B电极室溶液的pH与工作前相比将________ (填“增大”“减小”或“不变”,溶液体积变化忽略不计)。
③A电极附近甲醇发生的电极反应为______________ 。

①外电路的电流方向是由
②电池的正极反应式为
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:

①该电池中外电路电子的流动方向为
②工作结束后,B电极室溶液的pH与工作前相比将
③A电极附近甲醇发生的电极反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示:
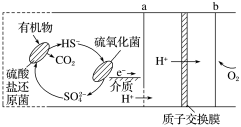
①HS-在硫氧化菌作用下转化为 的反应式是
的反应式是________ 。
②若维持该微生物电池中两种细菌的存在,则电池可以持续供电,原因是________ 。
(2)PbSO4热激活电池可用作火箭、导弹的工作电源,基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______ (填“负极”或“正极”)移动。
②负极反应为___________ 。
(3)氨氧燃料电池具有很大的发展空间。氨氧燃料电池的工作原理如图所示。
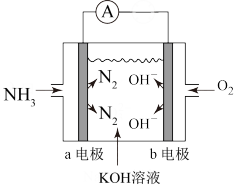
①a电极的电极反应式是_______ 。
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因:_________ 。

①HS-在硫氧化菌作用下转化为
 的反应式是
的反应式是②若维持该微生物电池中两种细菌的存在,则电池可以持续供电,原因是
(2)PbSO4热激活电池可用作火箭、导弹的工作电源,基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向
②负极反应为
(3)氨氧燃料电池具有很大的发展空间。氨氧燃料电池的工作原理如图所示。

①a电极的电极反应式是
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因:
您最近一年使用:0次



