测血钙的含量时,进行如下实验:
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4 mol./L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式___________ 。
(2)判断滴定终点的方法是____________ 。
(3)③步骤中取酸性KMnO4溶液溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的血钙质量分数_______ (填“偏大”、“偏小”或“无影响”)。
(4)计算:血液中含钙离子的浓度为_____ mol/L。
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4 mol./L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式
(2)判断滴定终点的方法是
(3)③步骤中取酸性KMnO4溶液溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的血钙质量分数
(4)计算:血液中含钙离子的浓度为
更新时间:2017-12-07 19:26:03
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】I、二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl更好。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是_______ 。
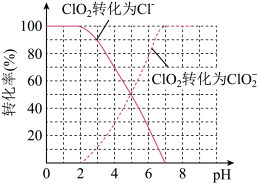
(2)用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO )。饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I-还原为ClO
)。饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I-还原为ClO 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2 。0时,ClO
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2 。0时,ClO 也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
①请写出pH≤2 。0时ClO 与I-反应的离子方程式
与I-反应的离子方程式_______ 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:_______ 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为_______ mol·L-1(用含字母的代数式表示)。
II.铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
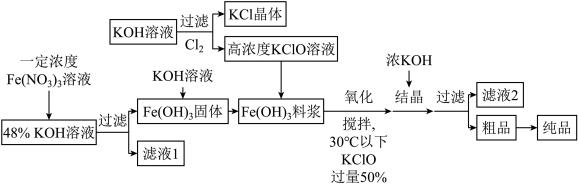
(1)在农业生产中,滤液1可用作_______ 。
(2)流程中生成高铁酸钾的离子方程式是:_______ ,控制此反应温度30℃以下的原因是:_______ 。
(3)结晶过程中加入浓KOH溶液的作用是:_______ 。
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO 离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为_______ 。
(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在_______ 附近、反应时间应控制在_______ 。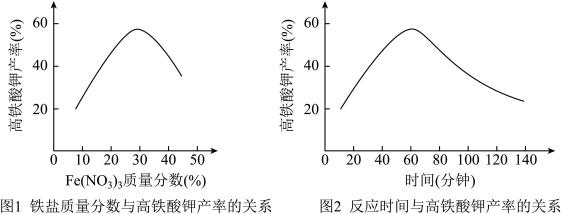
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是
(2)用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO
 )。饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I-还原为ClO
)。饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I-还原为ClO 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2 。0时,ClO
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2 。0时,ClO 也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI①请写出pH≤2 。0时ClO
 与I-反应的离子方程式
与I-反应的离子方程式
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为
II.铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

(1)在农业生产中,滤液1可用作
(2)流程中生成高铁酸钾的离子方程式是:
(3)结晶过程中加入浓KOH溶液的作用是:
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO
 离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】高纯超细氧化铝是一种新型无机功能材料,以硫酸铵和硫酸铝为原料制备复盐硫酸铝铵[NH4Al(SO4)2·12H2O],经硫酸铝铵热分解可制得高纯超细氧化铝,其流程如图:
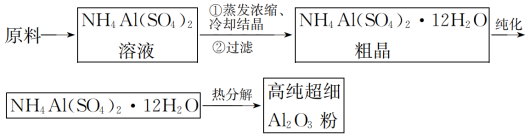
回答下列问题:
(1)“纯化”的方法为_______ 。
(2)实验室用如图装置利用热分解法制备高纯超细氧化铝粉并对其分解气成分进行探究:
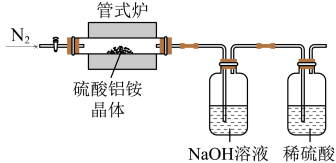
反应一段时间后,取三份NaOH吸收液于三支试管中分别进行如下实验,填写表格:
写出硫酸铝铵晶体高温分解的化学方程式_______ 。
(3)为了测定高纯超细氧化铝粉中Al2O3的质量分数,可用EDTA(简写为H4Y)标准溶液滴定。取m g氧化铝粉溶于盐酸,加入过量的V1 mL cl mol·L-1 EDTA标准溶液,充分反应后,再用c2 mol·L-1的Zn2+标准溶液滴定过量的EDTA至终点,消耗Zn2+标准溶液体积为V2 mL。反应的离子方程式:Al3++Y4- =AlY-、Zn2++Y4- =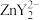 。Al2O3的质量分数为
。Al2O3的质量分数为_______ 。

回答下列问题:
(1)“纯化”的方法为
(2)实验室用如图装置利用热分解法制备高纯超细氧化铝粉并对其分解气成分进行探究:

反应一段时间后,取三份NaOH吸收液于三支试管中分别进行如下实验,填写表格:
| 实验步骤 | 实验现象 | 实验结论 |
| ①加热,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 分解气中含有 |
| ②加入盐酸酸化,再滴加氯化钡溶液 | 产生白色沉淀 | 分解气中含有 |
| ③ | 分解气中不含有SO2 |
(3)为了测定高纯超细氧化铝粉中Al2O3的质量分数,可用EDTA(简写为H4Y)标准溶液滴定。取m g氧化铝粉溶于盐酸,加入过量的V1 mL cl mol·L-1 EDTA标准溶液,充分反应后,再用c2 mol·L-1的Zn2+标准溶液滴定过量的EDTA至终点,消耗Zn2+标准溶液体积为V2 mL。反应的离子方程式:Al3++Y4- =AlY-、Zn2++Y4- =
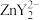 。Al2O3的质量分数为
。Al2O3的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】亚氯酸钠(NaClO2)是一种高效漂白剂,主要用于棉纺、亚麻、纸浆的漂白及杀菌灭藻、鱼药制造。某科研小组欲制备少量亚氯酸钠并利用“间接碘量法”测定其纯度。
(一)亚氯酸钠的制备
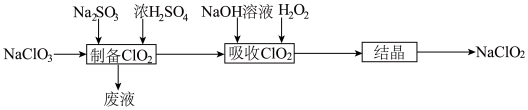
查阅资料:①NaClO2饱和溶液在温度低于38°C时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
② +4I-+4H+=2H2O+2I2+Cl- I2+2
+4I-+4H+=2H2O+2I2+Cl- I2+2 =
= +2I-
+2I-
(1)科研小组利用上述流程制备亚氯酸钠,“制备ClO2”时发生反应的化学方程式为_______ 。
(2)“结晶”需要控制的温度范围是___________ 。
(二)亚氯酸钠纯度的测定
I.取制备的亚氯酸钠固体3.75g配制成100mL溶液;
II.取上述溶液25.00mL于锥形瓶中,加入足量KI溶液和稀H2SO4,再滴加几滴试剂X;
III.用1.50mol∙L-1Na2S2O3标准溶液滴定至终点,记录消耗的Na2S2O3标准溶液的体积;
IV.重复II、III操作3次。
(3)试剂X应选择___________ (填名称),滴定终点的现象为___________ 。
(4)三次滴定数据记录如下:
亚氯酸钠的纯度(质量百分含量)为___________ 。
(5)若滴定前滴定管内无气泡,滴定后尖嘴部分出现气泡,会导致测定结果___________ (填“偏低”“偏高”或“无影响”,下同),若滴定终点时仰视读数会导致测定结果___________ 。
(一)亚氯酸钠的制备

查阅资料:①NaClO2饱和溶液在温度低于38°C时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
②
 +4I-+4H+=2H2O+2I2+Cl- I2+2
+4I-+4H+=2H2O+2I2+Cl- I2+2 =
= +2I-
+2I-(1)科研小组利用上述流程制备亚氯酸钠,“制备ClO2”时发生反应的化学方程式为
(2)“结晶”需要控制的温度范围是
(二)亚氯酸钠纯度的测定
I.取制备的亚氯酸钠固体3.75g配制成100mL溶液;
II.取上述溶液25.00mL于锥形瓶中,加入足量KI溶液和稀H2SO4,再滴加几滴试剂X;
III.用1.50mol∙L-1Na2S2O3标准溶液滴定至终点,记录消耗的Na2S2O3标准溶液的体积;
IV.重复II、III操作3次。
(3)试剂X应选择
(4)三次滴定数据记录如下:
| 滴定次序 | 1 | 2 | 3 |
| V(Na2S2O3溶液)/mL | 20.03 | 20.01 | 19.96 |
(5)若滴定前滴定管内无气泡,滴定后尖嘴部分出现气泡,会导致测定结果
您最近一年使用:0次
【推荐1】某淡黄色固体A(仅含三种元素,式量小于160)可用于制药,为探究其组成和性质,设计并完成如下实验:
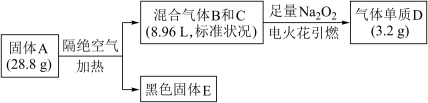
已知:①上述流程中所涉及的反应都充分进行。
②B、C、D均为常见气体。相同情况下气体B的密度大气体C。
③黑色固体 溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。
溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。
请问答:
(1)写出气体B的电子式__ ,固体A的化学式是__ 。
(2)黑色固体E与足量浓硝酸反应的离子反应方程式是__ 。

已知:①上述流程中所涉及的反应都充分进行。
②B、C、D均为常见气体。相同情况下气体B的密度大气体C。
③黑色固体
 溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。
溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。请问答:
(1)写出气体B的电子式
(2)黑色固体E与足量浓硝酸反应的离子反应方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)如何检验绿矾晶体中Fe2+是否被氧化?_______________________________
(2)已知本实验所用绿矾晶体没有被氧化。为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2) (设为装置A) 称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
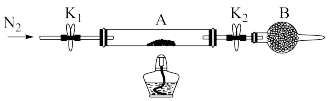
①将下列实验操作步骤正确排序__________ (填标号);重复上述操作步骤,直至装置A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量装置A的质量 f.冷却到室温
②根据实验记录,计算绿矾化学式中结晶水数目x=_____________ (列式表示) 。若实验时按a、d次序操作,则使x_____________ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2) 中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为__________ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为_____________ 。
A.品红 B.NaOH C.BaCl2 D.Ba(NO3)2 E.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_______________ 。
(4)绿矾溶液在空气中久置出现红褐色沉淀,写出相关的离子方程式____________________ 。
(1)如何检验绿矾晶体中Fe2+是否被氧化?
(2)已知本实验所用绿矾晶体没有被氧化。为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2) (设为装置A) 称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
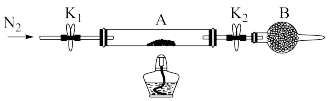
①将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量装置A的质量 f.冷却到室温
②根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2) 中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
A.品红 B.NaOH C.BaCl2 D.Ba(NO3)2 E.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
(4)绿矾溶液在空气中久置出现红褐色沉淀,写出相关的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】天然石灰石是重要的工业原料,主要成分为CaC03以及少量的Fe203、A1203等杂质。用高锰酸钾法测定石灰石中钙离子含量,方法如下:
【高锰酸钾溶液的标定】
准确称取0.2010g草酸钠(Na2C204)于烧杯中,加入蒸馏水溶解,并加稀硫酸酸化。立即用待标定的KMn04溶液滴定,消耗KMn04溶液20.00mL。
【草酸钙的制取】
准确称取2.000g样品溶于稀盐酸,充分反应后,先加入足量柠檬酸铵溶液,再加入足量草酸铵溶液,调节溶液的pH。待钙离子充分转化为沉淀后,过滤洗涤得草酸钙。
【钙离子的测定】
将所得草酸钙溶于稀硫酸,将所得溶液用水稀释200mL,取出20mL,用标定过的高锰酸钾溶液滴定,消耗高锰酸钾溶液25.00mL
(1)草酸钙制取时,加入柠檬酸铵与控制溶液pH的主要目的是______________________ 。
(2)已知25℃时,草酸钙的Ksp=4.0×l0-8。要使溶液中的Ca2+沉淀完全(当溶液中某离子浓度小于l×l0-5mol·L-1时,可视作沉淀完全),C2O42-的物质的量浓度至少达到___________ mol·L-1。
(3)实验中,如果制取的草酸钙未洗涤干净,则所测得钙离子的含量___________ 。(“偏大”或“偏小”或“不变”)
(4)请根据题中数据计算样品中钙元素的质量分数(写出计算过程)。_______________________________________________ 。
【高锰酸钾溶液的标定】
准确称取0.2010g草酸钠(Na2C204)于烧杯中,加入蒸馏水溶解,并加稀硫酸酸化。立即用待标定的KMn04溶液滴定,消耗KMn04溶液20.00mL。
【草酸钙的制取】
准确称取2.000g样品溶于稀盐酸,充分反应后,先加入足量柠檬酸铵溶液,再加入足量草酸铵溶液,调节溶液的pH。待钙离子充分转化为沉淀后,过滤洗涤得草酸钙。
【钙离子的测定】
将所得草酸钙溶于稀硫酸,将所得溶液用水稀释200mL,取出20mL,用标定过的高锰酸钾溶液滴定,消耗高锰酸钾溶液25.00mL
(1)草酸钙制取时,加入柠檬酸铵与控制溶液pH的主要目的是
(2)已知25℃时,草酸钙的Ksp=4.0×l0-8。要使溶液中的Ca2+沉淀完全(当溶液中某离子浓度小于l×l0-5mol·L-1时,可视作沉淀完全),C2O42-的物质的量浓度至少达到
(3)实验中,如果制取的草酸钙未洗涤干净,则所测得钙离子的含量
(4)请根据题中数据计算样品中钙元素的质量分数(写出计算过程)。
您最近一年使用:0次



