3.84g Fe和Fe2O3的混合物溶于100mL某浓度的盐酸中,恰好使混合物溶解,生成0.03mol H2,向反应后的溶液中加入KSCN检验,溶液无明显现象,设HCl无挥发,反应后溶液的体积不变.(已知:氧化性Fe3+>H+,还原性Fe>Cl﹣)
(1)求原混合物中Fe和Fe2O3的物质的量分别为多少?
(2)求反应后Cl﹣的物质的量浓度?
(1)求原混合物中Fe和Fe2O3的物质的量分别为多少?
(2)求反应后Cl﹣的物质的量浓度?
更新时间:2018-01-17 13:17:10
|
【知识点】 探究物质组成或测量物质的含量解读
相似题推荐
计算题
|
较难
(0.4)
解题方法
【推荐1】实验室制备光敏材料KaFeb(C2O4)c·xH2O的工艺流程如下:

回答下列问题:
(1)“溶解”时,为使所用的水中不含O2,采用的操作方法是_________________ 。
(2)用H2C2O4(弱酸)“沉铁”时,反应的离子方程式为______________ 。
(3)FeC2O4·2H2O热分解与气氛及温度有关,在N2气氛中热分解时,固体的残留率(固体样品的剩余质量/固体样品的起始质量×100%)与温度的关系如图所示,则B→C的变化中,发生反应的化学方程式为___________________ 。

(4)“氧化”时,温度不宜超过40℃,其原因是_______ 。
(5)为测定产品KaFeb(C2O4)c·xH2O(铁元素为+3价)的组成,称取产品0.2455g用硫酸溶解后,用0.02000 mol·L-1的KMnO4标准溶液滴定至终点,消耗标准溶液30.00 mL。在上述滴定过C2O42-的保留液中加入足量锌粉,加热至黄色消失,过滤洗涤,滤液及洗涤液再用0.02000 mol·L-1的KMnO4标准溶液滴定至终点,消耗标准溶液5.00 mL。则该产品的化学式为____________ 。

回答下列问题:
(1)“溶解”时,为使所用的水中不含O2,采用的操作方法是
(2)用H2C2O4(弱酸)“沉铁”时,反应的离子方程式为
(3)FeC2O4·2H2O热分解与气氛及温度有关,在N2气氛中热分解时,固体的残留率(固体样品的剩余质量/固体样品的起始质量×100%)与温度的关系如图所示,则B→C的变化中,发生反应的化学方程式为

(4)“氧化”时,温度不宜超过40℃,其原因是
(5)为测定产品KaFeb(C2O4)c·xH2O(铁元素为+3价)的组成,称取产品0.2455g用硫酸溶解后,用0.02000 mol·L-1的KMnO4标准溶液滴定至终点,消耗标准溶液30.00 mL。在上述滴定过C2O42-的保留液中加入足量锌粉,加热至黄色消失,过滤洗涤,滤液及洗涤液再用0.02000 mol·L-1的KMnO4标准溶液滴定至终点,消耗标准溶液5.00 mL。则该产品的化学式为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐2】为探究不含结晶水的白色正盐X(仅含三种元素)的组成和性质,设计并完成如下实验:
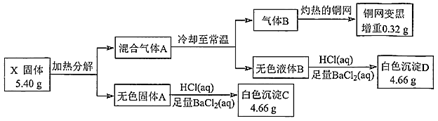
已知:M(X)=270g·mol-1,灼烧X并透过蓝色钴玻璃片可看到紫色火焰。请回答:
(1)无色液体B的化学式是____ 。
(2)固体X加热分解的化学方程式是____ 。
(3)将X加入MnSO4溶液中,溶液变成紫红色,该反应的离子方程式为____ 。

已知:M(X)=270g·mol-1,灼烧X并透过蓝色钴玻璃片可看到紫色火焰。请回答:
(1)无色液体B的化学式是
(2)固体X加热分解的化学方程式是
(3)将X加入MnSO4溶液中,溶液变成紫红色,该反应的离子方程式为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐3】将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
①取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
②另取50.0mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
③再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,得到一种无色气体,其体积换算成标准状况时为0.448 L ;
请根据以上实验中得到的数据分析计算:
(1)原FeCl3溶液物质的量浓度_________ (反应过程中过程中溶液体积的变化忽略不计);
(2)所得混合溶液中c(Cu2+)的取值范围_________ ;
(3)若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?______ 、__________
①取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
②另取50.0mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
③再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,得到一种无色气体,其体积换算成标准状况时为0.448 L ;
请根据以上实验中得到的数据分析计算:
(1)原FeCl3溶液物质的量浓度
(2)所得混合溶液中c(Cu2+)的取值范围
(3)若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
您最近一年使用:0次



