某班同学用如下实验探究Fe2+、Fe3+的性质。
回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是____________________________________________________ 。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________________________________ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________________________ 。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,证明生成Fe2+
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验①和③说明:在I-过量的情况下,溶液中仍含有________ (填离子符号),由此可以证明该氧化还原反应为________ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,写出反应的离子方程式_________________________ ,一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__________________________ ;
回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,证明生成Fe2+
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验①和③说明:在I-过量的情况下,溶液中仍含有
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,写出反应的离子方程式
19-20高三上·山东淄博·开学考试 查看更多[2]
更新时间:2018-09-09 21:46:28
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线。_______ ;得到滤渣1的主要成分为_______ 。
(2)步骤①中能否用稀盐酸代替稀硫酸?_______ (填“能”或“否”)。
(3)步骤②加入H2O2的作用是_______ 。
(4)从滤液2获得硫酸铜晶体的方法是蒸发浓缩、_______ 。该过程可能会用到以下实验仪器中的:_______ 。(写名称)_______ 方案不可行,原因是_______ 。
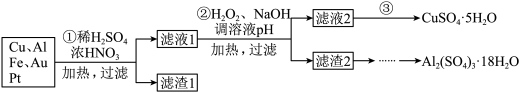
(2)步骤①中能否用稀盐酸代替稀硫酸?
(3)步骤②加入H2O2的作用是
(4)从滤液2获得硫酸铜晶体的方法是蒸发浓缩、

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】铁是人体必需的微量元素之一,医学上常用FeSO4糖衣片给贫血病人补铁。某兴趣小组欲用酸性KMnO4液来测定某补铁剂中FeSO4的含量(设该药品中的其它成分不与硫酸、KMnO4反应)。
实验步骤:
步骤一:精确配制0.2000mol/L的KMnO4溶液;
步骤二:取10片除去糖衣的药片,研碎,加适量稀硫酸使其完全溶解;
步骤三:用所配KMnO4溶液测量步骤二溶液中FeSO4的含量,记录消耗KMnO4溶液的体积。
请回答:
(1)步骤一中用KMnO4固体配制250mL0.2000mol/L的KMnO4溶液。
①所需玻璃仪器除了胶头滴管、玻璃棒外还必须用到___ ;
②下列说法正确的是___ 。

A.用洁净未干燥的容量瓶配制溶液会导致所配溶液浓度偏低
B.洗涤液都注入容量瓶后,使溶液混合均匀的操作如图
C.定容时仰视刻度线会导致所配溶液浓度偏低
D.定容摇匀后发现液面低于容量瓶刻度线,不做任何处理
(2)测定过程中发生反应的离子方程式为(已知MnO 被还原为Mn2+):
被还原为Mn2+):___ 。
(3)某同学三次实验消耗的KMnO4溶液体积数据如下:
根据该同学的实验数据,计算每片补铁剂中含FeSO4的质量为___ g。
(4)该同学发现测定结果明显低于理论值,可能原因是___ 。
实验步骤:
步骤一:精确配制0.2000mol/L的KMnO4溶液;
步骤二:取10片除去糖衣的药片,研碎,加适量稀硫酸使其完全溶解;
步骤三:用所配KMnO4溶液测量步骤二溶液中FeSO4的含量,记录消耗KMnO4溶液的体积。
请回答:
(1)步骤一中用KMnO4固体配制250mL0.2000mol/L的KMnO4溶液。
①所需玻璃仪器除了胶头滴管、玻璃棒外还必须用到
②下列说法正确的是

A.用洁净未干燥的容量瓶配制溶液会导致所配溶液浓度偏低
B.洗涤液都注入容量瓶后,使溶液混合均匀的操作如图
C.定容时仰视刻度线会导致所配溶液浓度偏低
D.定容摇匀后发现液面低于容量瓶刻度线,不做任何处理
(2)测定过程中发生反应的离子方程式为(已知MnO
 被还原为Mn2+):
被还原为Mn2+):(3)某同学三次实验消耗的KMnO4溶液体积数据如下:
| 测定次数 | 第1次 | 第2次 | 第3次 |
| V(KMnO4溶液)/mL | 19.98 | 20.02 | 20.00 |
(4)该同学发现测定结果明显低于理论值,可能原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】为探究铁及其化合物的性质,某班几个兴趣小组做了以下实验。
(1)甲组同学利用下列试剂:铜粉、0.1mol/LFeCl3溶液、0.1mol/LFeCl2溶液、KSCN溶液、新制氯水等,探究Fe2+、Fe3+的性质,设计实验方案进行实验,完成下列表格。
上述反应①可用于刻蚀印刷电路板,若将反应设计为原电池(如图),可加快刻蚀的速率,请在图中补充相关信息。___________

(2)乙组同学为了制备Fe(OH)2沉淀且保持一段时间不变色,尝试用如图所示的装置进行实验。
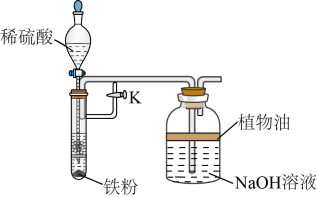
①Fe(OH)2暴露在空气中的颜色变化为___________ ,原因是___________ (用化学方程式表示)。
②实验时,先___________ (填“打开”或“关闭”)止水夹K,然后打开分液漏斗的活塞,一段时间后,___________ (填“打开”或“关闭”)K。
(3)向300mL0.2mol/L的FeSO4溶液中加入足量的NaOH溶液,沉淀经过滤、加热灼烧至质量不再变化后,得到的固体质量为___________ g。
(1)甲组同学利用下列试剂:铜粉、0.1mol/LFeCl3溶液、0.1mol/LFeCl2溶液、KSCN溶液、新制氯水等,探究Fe2+、Fe3+的性质,设计实验方案进行实验,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 | 写出离子方程式 |
| 探究Fe2+具有还原性 | 取少量FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量 | 溶液先不变红,后变为血红色。 | Fe2+发生的反应: |
| 探究Fe3+具有氧化性 | ①取少量FeCl3溶液,加入足量 | 溶液不变为血红色。 | Fe3+发生的反应: |
| ②取少量FeCl3溶液,通入足量SO2,振荡、静置后滴入BaCl2溶液 | 溶液逐渐由黄色变为浅绿色,滴入BaCl2溶液,有白色沉淀生成 | Fe3+与SO2发生的反应: |

(2)乙组同学为了制备Fe(OH)2沉淀且保持一段时间不变色,尝试用如图所示的装置进行实验。

①Fe(OH)2暴露在空气中的颜色变化为
②实验时,先
(3)向300mL0.2mol/L的FeSO4溶液中加入足量的NaOH溶液,沉淀经过滤、加热灼烧至质量不再变化后,得到的固体质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验室配制氯化亚铁溶液时是把氯化亚铁溶解于煮沸过的蒸馏水中,并加入___________ ,向氯化亚铁溶液中加入氢氧化钠溶液时能观察到的现象是_________________ ,反应的化学方程式是___________________ 、________________________ 。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.lmol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________ 。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________ 。
(4)丙组同学取5mL0.1mol·L-1KI溶液,加入3mL0.1mol·L-1FeCl3溶液混合,分别取2mL此混合溶液于2支试管中进行如下实验:
①第一支试管中加入1 mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴KSCN溶液,溶液变红。
实验②说明:在 过量的情况下,溶液中仍含有
过量的情况下,溶液中仍含有________ (填离子符号)。
(5)丁组同学向盛有少量H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_____________ 。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.lmol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取5mL0.1mol·L-1KI溶液,加入3mL0.1mol·L-1FeCl3溶液混合,分别取2mL此混合溶液于2支试管中进行如下实验:
①第一支试管中加入1 mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴KSCN溶液,溶液变红。
实验②说明:在
 过量的情况下,溶液中仍含有
过量的情况下,溶液中仍含有(5)丁组同学向盛有少量H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】已知硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某化学兴趣小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如图。

图中步骤④的一系列操作为:过滤、洗涤、干燥、加热。
请回答下列问题:
(1)实验室保存FeSO4溶液的方法是向盛有FeSO4溶液的试剂瓶中加入_________ ,目的是__________ 。
(2)证明补血剂已变质的方法是:取适量①中的过滤液,向滤液中加入几滴__________ 溶液,若溶液变__________ ,说明补血剂已变质,该反应的离子方程式为__________ 。
(3)步骤②加入过量H2O2的目的是__________ 。
(4)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为_________ g(用含有a的代数式表示)。

图中步骤④的一系列操作为:过滤、洗涤、干燥、加热。
请回答下列问题:
(1)实验室保存FeSO4溶液的方法是向盛有FeSO4溶液的试剂瓶中加入
(2)证明补血剂已变质的方法是:取适量①中的过滤液,向滤液中加入几滴
(3)步骤②加入过量H2O2的目的是
(4)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片
请帮助他们完成以下实验报告:
填空:
(1)①_____________ ③____________ ⑤____________ ⑧____________
(2)亚铁盐溶液易被氧化,短时间保存亚铁盐溶液时为防止亚铁盐被氧化可在溶液中加入少量______________ (填试剂名称)。
(3)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可):________ 。
(4)某同学向FeCl2溶液中加入Na2O2,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是___ 。
试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片
请帮助他们完成以下实验报告:
| 序号 | 实验 目的 | 实验内容 | 实验现象 | 实验结论 | 离子方程式 |
| 实验1 | ① | 在FeCl2溶液中滴入适量 氯水 | 溶液由浅绿色 变为黄色 | ② | ③ |
| 实验2 | ④ | 在FeCl2溶液中加入锌片 |  | ⑤ | Zn +Fe2+= Zn2++Fe |
| 实验3 | ⑥ | 在FeCl3溶液中加入足量 铁粉 | ⑦ | FeCl3(Fe3+)具有氧化性 | ⑧ |
填空:
(1)①
综合以上实验,你能得到的结论是:Fe3+有氧化性;
(2)亚铁盐溶液易被氧化,短时间保存亚铁盐溶液时为防止亚铁盐被氧化可在溶液中加入少量
(3)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可):
(4)某同学向FeCl2溶液中加入Na2O2,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】FeSO4·7H2O晶体在空气中易被氧化,为检验其是否已被氧化,可取少量样品溶于适量水后加入________ (填化学式)溶液检验;如已氧化,可向其中加入过量________ 以除去其中的Fe3+ 。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。得到的废液中含有Fe2+、Cu2+ 、Fe3+和Cl-。为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
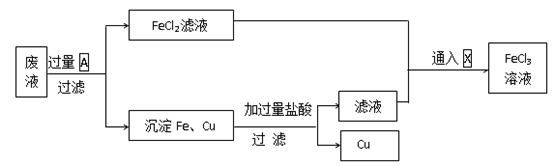
(1)FeCl3溶液和铜反应的离子方程式为________________________________________ 。
(2)上述方框内物质A和X的化学式 :A______________ ,X______________ 。上述流程中有关Fe2+和Fe3+相互转化的离子方程式是______________ 、________________ 。

(1)FeCl3溶液和铜反应的离子方程式为
(2)上述方框内物质A和X的
您最近一年使用:0次



