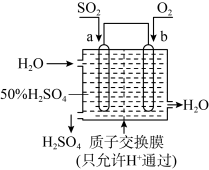
(1)科研人员设想用如图所示装置生产硫酸。_____ ,b是_____ 极(填“正”或“负”),a电极反应式为_______ ,生产过程中H+向_____ (填a或b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____ (填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
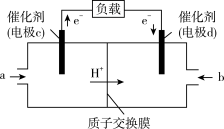
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成原电池装置,则负极材料为_____ ,电解质溶液为_____ 。_____ 极(填“正”或“负”),c电极反应方程式为_________ 。
②该小组同学反思原电池的原理,其中观点正确的是
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成原电池装置,则负极材料为
更新时间:2019/05/28 16:53:39
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题
(1)把一小块镁、铝合金放入 的
的 溶液中,可以形成微型原电池,则该原电池负极发生的电极反应式为
溶液中,可以形成微型原电池,则该原电池负极发生的电极反应式为___________ 。
(2)如图1所示,装置I为肼(N2H4)-空气燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜,其中肼转化为空气中的一种成分。___________ ,b电极上发生的电极反应式是___________ 。
②在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置I中理论上消耗肼的质量为___________ 。
(3)用惰性电极电解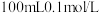 的硫酸铜溶液,通电一段时间后,阳极产生
的硫酸铜溶液,通电一段时间后,阳极产生 (标况)气体,电解结束后,若只加一种物质恰好恢复到电解前的浓度和酸碱性,该物质化学式是
(标况)气体,电解结束后,若只加一种物质恰好恢复到电解前的浓度和酸碱性,该物质化学式是___________ ,加入的质量为___________ 。
(1)把一小块镁、铝合金放入
 的
的 溶液中,可以形成微型原电池,则该原电池负极发生的电极反应式为
溶液中,可以形成微型原电池,则该原电池负极发生的电极反应式为(2)如图1所示,装置I为肼(N2H4)-空气燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜,其中肼转化为空气中的一种成分。
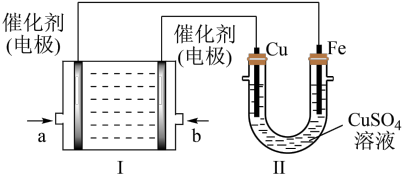
②在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置I中理论上消耗肼的质量为
(3)用惰性电极电解
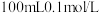 的硫酸铜溶液,通电一段时间后,阳极产生
的硫酸铜溶液,通电一段时间后,阳极产生 (标况)气体,电解结束后,若只加一种物质恰好恢复到电解前的浓度和酸碱性,该物质化学式是
(标况)气体,电解结束后,若只加一种物质恰好恢复到电解前的浓度和酸碱性,该物质化学式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】I.如图为原电池装置示意图。

(1)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为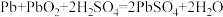 ,写出B电极反应式:
,写出B电极反应式:_______ 。该电池在工作时,A电极的质量将_______ (填“增加”“减小”或“不变”),若该电池反应消耗了0.1molH2SO4,则转移电子的数目为_______ 。
(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_______ 。该电池在工作一段时间后,溶液的碱性将_______ (填“增强”“减弱”或“不变”)。
Ⅱ.现用下图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片。

(3)b电极材料为纯铜片,其电极反应式为_______ 。
(4)当量筒中收集到672mL(标准状况下)气体时,通过导线的电子的物质的量为_______ mol,此时a电极质量减少_______ g。
(5)如果将a、b两电极的电极材料对调,U形管中将出现的现象是_______ 。

(1)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为
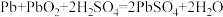 ,写出B电极反应式:
,写出B电极反应式:(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:
Ⅱ.现用下图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片。

(3)b电极材料为纯铜片,其电极反应式为
(4)当量筒中收集到672mL(标准状况下)气体时,通过导线的电子的物质的量为
(5)如果将a、b两电极的电极材料对调,U形管中将出现的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:
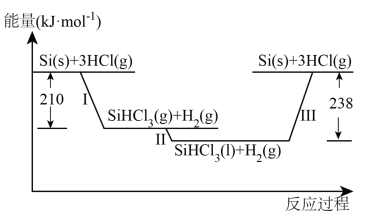
(1)工业上用 ,为原料制备粗硅。反应的化学方程式为
,为原料制备粗硅。反应的化学方程式为_______ 。
(2)反应Ⅲ生成2mol Si(s)时,_______ (填“吸收”或“放出”)_______ 热量。
(3)在2L密闭容器中投入过量Si(s)和3mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 。
。
①反应开始到t min,用HCl浓度变化表示的平均反应速率为_______  。
。
②下列叙述不能说明反应Ⅰ一定达到平衡状态的是_______ (填标号)。
A.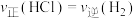 B.硅的质量保持不变
B.硅的质量保持不变
C.HCl的质量分数保持不变 D.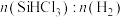 保持不变
保持不变
Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。
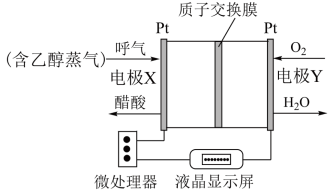
(4)电极X为_______ (填“正极”、“负极”)。
(5)电池工作时,质子通过交换膜_______ (填“从左到右”“从右到左”)迁移。
(6)正极的电极反应式为_______ 。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:

(1)工业上用
 ,为原料制备粗硅。反应的化学方程式为
,为原料制备粗硅。反应的化学方程式为(2)反应Ⅲ生成2mol Si(s)时,
(3)在2L密闭容器中投入过量Si(s)和3mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6
 。
。①反应开始到t min,用HCl浓度变化表示的平均反应速率为
 。
。②下列叙述不能说明反应Ⅰ一定达到平衡状态的是
A.
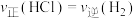 B.硅的质量保持不变
B.硅的质量保持不变C.HCl的质量分数保持不变 D.
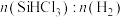 保持不变
保持不变Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(4)电极X为
(5)电池工作时,质子通过交换膜
(6)正极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】铅蓄电池(原电池)工作时,总反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,由此可以判断:
(1)铅蓄电池的电极材料:正极为___________ ,负极为___________ 。
(2)两极的电极反应式:正极为___________ ,负极为___________ 。
(3)工作一段时间后,铅蓄电池电解质溶液的pH___________ (填“变大”、“变小”或“不变”)。
(1)铅蓄电池的电极材料:正极为
(2)两极的电极反应式:正极为
(3)工作一段时间后,铅蓄电池电解质溶液的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)如图装置中属于原电池的是____ (填序号)。
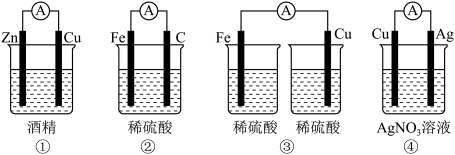
(2)依据氧化还原反应Fe+2Ag+=Fe2++2Ag设计的原电池如图1所示。
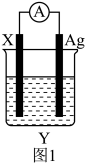
①电极X的材料是____ 。
②X电极的电极反应式为____ ;Ag电极上发生的是___ (填“氧化”或“还原”)反应。
③当有2.8 g铁溶解时,Ag电极增重____ g。
(3)以甲烷为燃料的新型电池得到广泛的研究,如图2是目前研究较多的一类燃料电池的工作原理示意图。
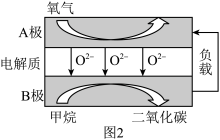
①A极为电池极____ (填“正”或“负”)。
②B极的电极反应式为____ ;若消耗标准状况下的CH411.2 L,则电路中转移____ mol电子。
(1)如图装置中属于原电池的是

(2)依据氧化还原反应Fe+2Ag+=Fe2++2Ag设计的原电池如图1所示。

①电极X的材料是
②X电极的电极反应式为
③当有2.8 g铁溶解时,Ag电极增重
(3)以甲烷为燃料的新型电池得到广泛的研究,如图2是目前研究较多的一类燃料电池的工作原理示意图。

①A极为电池极
②B极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.完成下列空白处
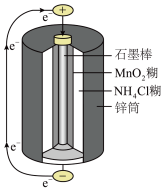
(1)锌锰干电池是最早使用的化学电池,其基本构造如图所示:电路中每通过0.4 mol ,负极质量减少
,负极质量减少___________ g;
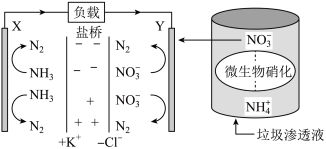
(2)一种利用垃圾渗透液实现发电装置示意图如下,当该装置工作时,Y极发生的电极反应式为:___________ 。
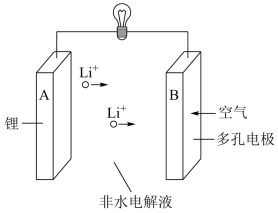
Ⅱ.“锂—空气”电池的理论能量密度高,是未来提高电动汽车续航里程的关键。
(3)“锂—空气”电池的反应原理可表示为: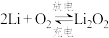 ,其放电时的工作原理如图所示:电池工作时,发生氧化反应的是
,其放电时的工作原理如图所示:电池工作时,发生氧化反应的是___________ 极(填“A”或“B”)。
(4)空气中的 、
、 影响电池放电。探究
影响电池放电。探究 对放电的影响:向非水电解液中加入少量水,放电后检测A、B电极上的固体物质:A极:LiOH;B极:
对放电的影响:向非水电解液中加入少量水,放电后检测A、B电极上的固体物质:A极:LiOH;B极: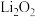 、LiOH
、LiOH
①B电极产生LiOH的化学方程式是___________ 。
② 降低“锂—空气”电池放电、充电循环性能。
降低“锂—空气”电池放电、充电循环性能。
(5)探究 对放电的影响:使电池在三种不同气体(物质的量相等)中放电,测量外电路转移的电子与消耗
对放电的影响:使电池在三种不同气体(物质的量相等)中放电,测量外电路转移的电子与消耗 的比值
的比值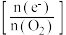 。
。
①放电时,实验ⅰ中B极的电极反应式为___________ 。
②下列分析正确的是___________ 。
a.放电时,ⅰ、ⅲ中通过外电路的电子数相等
b.ⅲ中B极所发生的电极反应的产物主要为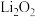
c.ⅲ中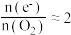 ,说明
,说明 末与
末与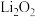 反应
反应
(1)锌锰干电池是最早使用的化学电池,其基本构造如图所示:电路中每通过0.4 mol
 ,负极质量减少
,负极质量减少
(2)一种利用垃圾渗透液实现发电装置示意图如下,当该装置工作时,Y极发生的电极反应式为:

Ⅱ.“锂—空气”电池的理论能量密度高,是未来提高电动汽车续航里程的关键。
(3)“锂—空气”电池的反应原理可表示为:
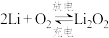 ,其放电时的工作原理如图所示:电池工作时,发生氧化反应的是
,其放电时的工作原理如图所示:电池工作时,发生氧化反应的是
(4)空气中的
 、
、 影响电池放电。探究
影响电池放电。探究 对放电的影响:向非水电解液中加入少量水,放电后检测A、B电极上的固体物质:A极:LiOH;B极:
对放电的影响:向非水电解液中加入少量水,放电后检测A、B电极上的固体物质:A极:LiOH;B极: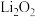 、LiOH
、LiOH①B电极产生LiOH的化学方程式是
②
 降低“锂—空气”电池放电、充电循环性能。
降低“锂—空气”电池放电、充电循环性能。(5)探究
 对放电的影响:使电池在三种不同气体(物质的量相等)中放电,测量外电路转移的电子与消耗
对放电的影响:使电池在三种不同气体(物质的量相等)中放电,测量外电路转移的电子与消耗 的比值
的比值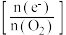 。
。| 实验 | ⅰ | ⅱ | ⅲ |
| 气体 |  |  | 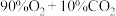 |
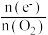 | 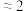 | 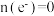 | 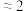 |
②下列分析正确的是
a.放电时,ⅰ、ⅲ中通过外电路的电子数相等
b.ⅲ中B极所发生的电极反应的产物主要为
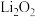
c.ⅲ中
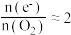 ,说明
,说明 末与
末与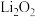 反应
反应
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】1836年丹尼尔发明了世界上第一个实用电池,下图是实验室模拟原电池原理组装的丹尼尔电池,盐桥中装有饱和 溶液的琼胶,回答下列问题。
溶液的琼胶,回答下列问题。

(1)上图装置中能量的转化形式为___________ 能转化为___________ 能;
(2)在该原电池中,____ 是负极材料(填“锌片”或“铜片”),铜片一极发生___________ 反应(填“氧化”或“还原”);
(3)当该原电池开始工作时,盐桥中的 的移动方向是
的移动方向是____ (请在下列选项中选择) A. 流向硫酸锌溶液 B. 流向硫酸铜溶液
(4)该原电池的正极电极反应式为___________ ;当电路中转移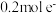 时,锌片溶解的质量为
时,锌片溶解的质量为___________  。
。
(5)图中甲池的总反应式为N2H4+O2=N2+2H2O。

①甲池中负极上发生的是___________ (填“氧化反应”或“还原反应”),乙池中SO 向
向___________ 移动(填“左”或“右”)。
②乙池中电解反应的离子方程为___________ 。
③要使乙池恢复到电解前的状态,应向溶液中加入___________ (填化学式)。
 溶液的琼胶,回答下列问题。
溶液的琼胶,回答下列问题。
(1)上图装置中能量的转化形式为
(2)在该原电池中,
(3)当该原电池开始工作时,盐桥中的
 的移动方向是
的移动方向是(4)该原电池的正极电极反应式为
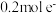 时,锌片溶解的质量为
时,锌片溶解的质量为 。
。(5)图中甲池的总反应式为N2H4+O2=N2+2H2O。

①甲池中负极上发生的是
 向
向②乙池中电解反应的离子方程为
③要使乙池恢复到电解前的状态,应向溶液中加入
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】如下图设计的串联电池装置,R为变阻器,以调节电路电流。
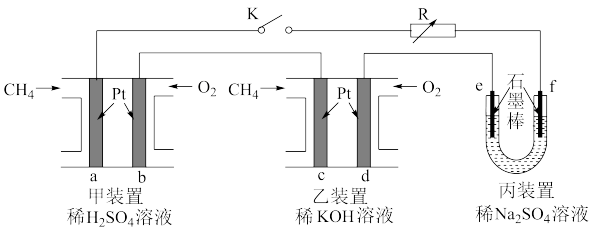
(1)写出b、c电极的电极反应式:b______________ ,c_______________ ;
(2)写出f电极的电极反应式____________________ ,向此电极区域滴入酚酞的现象为:_____________ ;该电极区域水的电离平衡被____________ (填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH__________ (填“变大”、“变小”或“不变”),原因是______________ 。
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入______ g H2O就可以将析出的沉淀溶解并恢复到原有浓度。

(1)写出b、c电极的电极反应式:b
(2)写出f电极的电极反应式
(3)闭合K一段时间后,丙装置的电解质溶液pH
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】在铜锌原电池中(如下图),
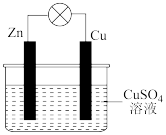
以硫酸铜为电解质溶液,锌为________ 极,电极上发生的是________ (填“氧化”或“还原”)反应,电极反应式为_______________________________ 。锌片上观察到的现象为_______ ;
铜为________ 极,电极上发生的是________ (填“氧化”或“还原”)反应,电极反应式是____ ;
铜片上观察到的现象是_______________ ,原电池总反应的离子方程式为_______ 。

以硫酸铜为电解质溶液,锌为
铜为
铜片上观察到的现象是
您最近一年使用:0次



