将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。 已知:
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1=_____________ 。
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1=
11-12高二上·福建泉州·期中 查看更多[3]
(已下线)2011-2012学年福建省南安一中高二上学期期中考试化学试卷(已下线)2011-2012学年福建省南安一中高二上学期期中考试化学(理)试卷(已下线)1.1.3 能源的充分利用(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)
更新时间:2011-12-08 18:20:29
|
相似题推荐
计算题
|
容易
(0.94)
名校
【推荐1】研究化学反应中的能量变化有利于更好的开发和使用化学能源。
(1)金属镁[Mg(s)]分别与卤素单质[F2(g)、Cl2(g)、Br2(l)、I2(s)]反应的能量变化如图所示。
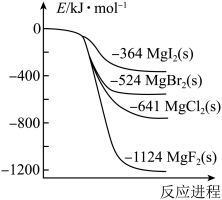
①写出Mg(s)和I2(s)反应的热化学方程式:_______ 。
②反应:MgCl2(s)+F2 (g)=MgF2(s)+Cl2 (g)的ΔH=___________ 。
(2)CH4用NiO作载氧体的化学链燃烧示意图如图所示。
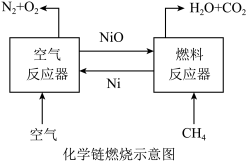
主要热化学反应如下:2Ni(s)+O2(g)=2NiO(s) ΔH=-479.8 kJ·mol-1;CH4(g)+4NiO(s)=CO2(g)+2H2O(l)+4Ni(s) ΔH=+68.9 kJ·mol-1
①CH4的燃烧热是_______ 。
②CH4的“化学链燃烧”有利于二氧化碳的分离与回收,所放出的热量在相同条件下与CH4的直接燃烧相比_________ (填“前者大”、“后者大”、或“相同”)。
(3)已知H2、CO的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1,25℃时,4 g H2和28 g CO的混合气体充分燃烧,恢复至原温,能放出的热量为_______ kJ。
(1)金属镁[Mg(s)]分别与卤素单质[F2(g)、Cl2(g)、Br2(l)、I2(s)]反应的能量变化如图所示。

①写出Mg(s)和I2(s)反应的热化学方程式:
②反应:MgCl2(s)+F2 (g)=MgF2(s)+Cl2 (g)的ΔH=
(2)CH4用NiO作载氧体的化学链燃烧示意图如图所示。

主要热化学反应如下:2Ni(s)+O2(g)=2NiO(s) ΔH=-479.8 kJ·mol-1;CH4(g)+4NiO(s)=CO2(g)+2H2O(l)+4Ni(s) ΔH=+68.9 kJ·mol-1
①CH4的燃烧热是
②CH4的“化学链燃烧”有利于二氧化碳的分离与回收,所放出的热量在相同条件下与CH4的直接燃烧相比
(3)已知H2、CO的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1,25℃时,4 g H2和28 g CO的混合气体充分燃烧,恢复至原温,能放出的热量为
您最近一年使用:0次
计算题
|
容易
(0.94)
解题方法
【推荐2】1g葡萄糖(C6H12O6)完全氧化放出16.7kJ的热量,则1mol葡萄糖完全氧化能放出_________ 的热量。
您最近一年使用:0次
计算题
|
容易
(0.94)
【推荐1】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)把煤作为燃料可通过下列两种途径:

途径Ⅰ:C(s)+O2(g)=CO2(g)ΔH1<0①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g)ΔH2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g)ΔH3<0③
2H2(g)+O2(g)=2H2O(g)ΔH4<0④
则途径Ⅰ放出的热量___ (填“大于”“等于”或“小于”)途径Ⅱ放出的热量;ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是___ 。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一CO(g)+2H2(g)⇌CH3OH(g)
方法二CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
在25℃、101kPa下,1克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式:___ 。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2 TiCl4+2CO
TiCl4+2CO
已知:
C(s)+O2(g)=CO2(g)ΔH=-393.5kJ•mol-1
2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g)ΔH=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=___ 。
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ•mol-1
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ•mol-1则O3转化为O2的热化学方程式为___ 。
(1)把煤作为燃料可通过下列两种途径:

途径Ⅰ:C(s)+O2(g)=CO2(g)ΔH1<0①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g)ΔH2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g)ΔH3<0③
2H2(g)+O2(g)=2H2O(g)ΔH4<0④
则途径Ⅰ放出的热量
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一CO(g)+2H2(g)⇌CH3OH(g)
方法二CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
在25℃、101kPa下,1克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式:
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2
 TiCl4+2CO
TiCl4+2CO已知:
C(s)+O2(g)=CO2(g)ΔH=-393.5kJ•mol-1
2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g)ΔH=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ•mol-1
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ•mol-1则O3转化为O2的热化学方程式为
您最近一年使用:0次
计算题
|
容易
(0.94)
【推荐2】TiO2 TiCl4
TiCl4 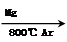 Ti
Ti
已知:①C(s)+O2(g)===CO2(g);ΔH=-393.5kJ·mol-1
②2CO(g)+O2(g)===2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g);ΔH=+141kJ·mol-1,则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=__________。反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由_______________________________________________________________________________________。
 TiCl4
TiCl4 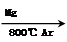 Ti
Ti已知:①C(s)+O2(g)===CO2(g);ΔH=-393.5kJ·mol-1
②2CO(g)+O2(g)===2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g);ΔH=+141kJ·mol-1,则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=__________。反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由_______________________________________________________________________________________。
您最近一年使用:0次
计算题
|
容易
(0.94)
名校
【推荐3】常温常压下,断裂1 mol(理想)气体分子化学键所吸收的能量或形成1 mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ·mol-1)。下表是一些键能数据(kJ·mol-1):
请完成下列问题。
(1)由表中数据规律预测C-Br键的键能范围:___ < C-Br键能 <_______ 。
(2)热化学方程式2H2(g)+S2(g)=2H2S(g) ΔH= Q kJ∙mol-1,则Q=___ 。
(3)已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7 kJ∙mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ∙mol-1。试计算1 mol肼和二氧化氮完全反应生成氮气和水蒸气时放出的热量为____ kJ,写出肼与二氧化氮反应的热化学方程式:___________ 。
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
请完成下列问题。
(1)由表中数据规律预测C-Br键的键能范围:
(2)热化学方程式2H2(g)+S2(g)=2H2S(g) ΔH= Q kJ∙mol-1,则Q=
(3)已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7 kJ∙mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ∙mol-1。试计算1 mol肼和二氧化氮完全反应生成氮气和水蒸气时放出的热量为
您最近一年使用:0次



