下列说法正确的是
| A.H2O分子之间的作用力大于H2S,故前者比后者稳定 |
| B.NaHSO4属于含有共价键的离子化合物,加热融化时破坏了该物质中的离子键和共价键 |
| C.某晶体固态不导电,熔化时能导电,该晶体一定是离子晶体 |
| D.CO2、N2都是所有原子最外层都满足8电子结构的共价化合物 |
更新时间:2019-10-12 16:10:49
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】下列事实能用键能的大小来解释的是
| A.N2的化学性质稳定 | B.惰性气体一般难发生反应 |
| C.常温常压下氯气呈气态而溴单质呈液态 | D.碘易升华 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法不正确 的是
| A.NaCl晶体属于离子晶体,熔化时离子键被削弱 |
| B.CO2晶体属于分子晶体,汽化时需克服分子间作用力 |
| C.SiO2晶体属于共价晶体,熔化时需破坏共价键 |
| D.C60晶体与金刚石均属于原子晶体,其晶体熔点高、硬度大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下表是A、B、C、D、E、F六种短周期元素的部分化合价、电负性和原子半径数据。下列说法正确的是( )
| A | B | C | D | E | F | |
| 化合价 | +1 | ﹣2 | ﹣1 | ﹣2 | ﹣1 | +1 |
| 电负性 | 2.1 | 2.5 | 3.0 | 3.5 | 4.0 | 0.9 |
| 原子半径/nm | 0.037 | 0.102 | 0.099 | 0.073 | 0.071 | 0.154 |
| A.F的单质、FA晶体中均含有金属阳离子,都属于离子晶体 |
| B.A2D2、F2D2都是含有非极性键的离子化合物 |
| C.氧化物对应水化物的酸性:B<C<E |
| D.简单阴离子的还原性:E-< C- <B2- |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
| A.液溴和己烷分别受热变为气体 |
| B.干冰和氯化铵分别受热变为气体 |
| C.硅和铁分别受热熔化 |
| D.氯化氢和蔗糖分别溶解于水 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列变化需克服相同类型作用力的是( )
| A.碘和干冰的升华 |
| B.Na2O2和C60的熔化 |
| C.氯化氢和氯化钾的溶解 |
| D.溴的汽化和NH4Cl加热分解 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式如图所示,以下关于维生素B1的说法正确的是
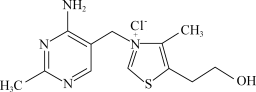

| A.只含σ键和π键 |
| B.既有共价键又有离子键 |
| C.该物质的熔点可能高于CsCl |
| D.维生素B1晶体溶于水的过程中克服的微粒间作用力只有离子键 |
您最近一年使用:0次



