(Ⅰ)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl﹣、SO42﹣、CO32﹣离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有___ ;肯定不存在的离子有___ 。
②写出C中发生反应的离子方程式____ 。
(Ⅱ)按要求写出下列物质间反应的离子反应方程式:
(1)硫酸氢钠与碳酸氢钠溶液混和_____ ;
(2)氢氧化镁固体溶于足量盐酸溶液:_____ 。
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有
②写出C中发生反应的离子方程式
(Ⅱ)按要求写出下列物质间反应的离子反应方程式:
(1)硫酸氢钠与碳酸氢钠溶液混和
(2)氢氧化镁固体溶于足量盐酸溶液:
更新时间:2019-11-24 16:27:07
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
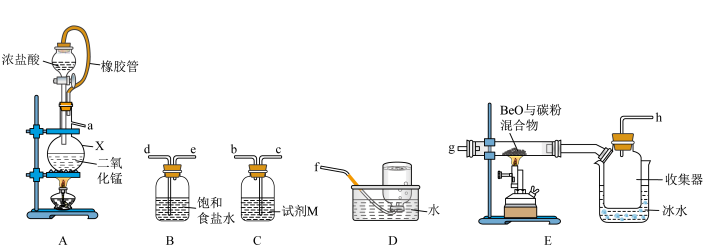
【推荐1】氯化铍(BeCl2)是一种无色针状或板状晶体,易潮解,易升华。已知氯气、碳和氧化铍高温条件下反应生成氯化铍和一氧化碳,某实验小组利用下图所示装置制备 。请回答下列问题:
。请回答下列问题:
已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
② 熔融可离子化。
熔融可离子化。
(1)装置A中仪器X的名称是___________ ,装置C中的试剂M为___________ (填名称)。
(2)按气流从左到右的方向,上述装置的合理连接顺序为___________ (填仪器接口的小写字母,装置可重复使用),装置A中反应的离子方程式为___________ 。
(3)装置E中反应的化学方程式为___________ ,两仪器连接处使用粗导气管,而不用细导气管的原因是___________ 。
(4)装置B的作用是___________ 。
(5)工业上电解 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为
熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为___________ ;电解时需加入氯化钠的作用是___________ 。
 。请回答下列问题:
。请回答下列问题:
已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
②
 熔融可离子化。
熔融可离子化。(1)装置A中仪器X的名称是
(2)按气流从左到右的方向,上述装置的合理连接顺序为
(3)装置E中反应的化学方程式为
(4)装置B的作用是
(5)工业上电解
 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为
熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学兴趣小组为了探究 的相关性质,设计了如图一的一系列实验。
的相关性质,设计了如图一的一系列实验。

查阅资料:① 与
与 不反应;
不反应;
②氯元素形成物质的二维价类图如下所示:
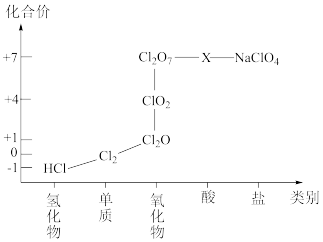
(1)根据二维图中信息,写出氯的最高价含氧酸的化学式_______ 。
(2)将 通入水中,其离子方程式为
通入水中,其离子方程式为_______ 。
(3)实验室可用该反应 制备
制备 ,该反应中盐酸体现
,该反应中盐酸体现_______ (填字母),其中氧化剂与还原剂的微粒个数之比为_______ 。
A.酸性 B.氧化性 C.还原性 D.挥发性
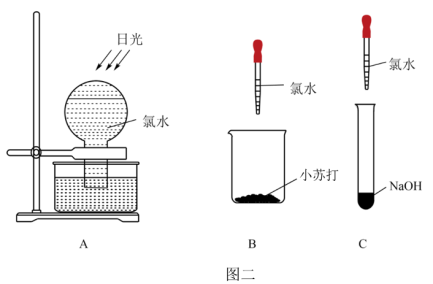
(4)图一中,通入_______ 后,从集气瓶A、B的现象可得出的结论是_______ 。
(5)图二中三组实验,不会产生气体的是_______ ﹔请用一个离子方程式表示图二B装置中发生的反应_______ 。
 的相关性质,设计了如图一的一系列实验。
的相关性质,设计了如图一的一系列实验。
查阅资料:①
 与
与 不反应;
不反应;②氯元素形成物质的二维价类图如下所示:

(1)根据二维图中信息,写出氯的最高价含氧酸的化学式
(2)将
 通入水中,其离子方程式为
通入水中,其离子方程式为(3)实验室可用该反应
 制备
制备 ,该反应中盐酸体现
,该反应中盐酸体现A.酸性 B.氧化性 C.还原性 D.挥发性
(4)图一中,通入
(5)图二中三组实验,不会产生气体的是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组在做铜与浓硫酸(装置如下图)的反应实验时,发现有如下的反应现象:
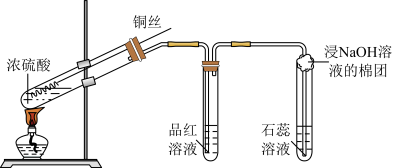
【查阅资料】聚氯乙烯受热分解产生氯化氢,[CuCl4]2-产呈黄色,[Cu(H2O)4]2+呈蓝色,两者混合则成绿色,铜的化合物中CuO、CuS、Cu2S都为黑色,其中CuO溶于盐酸;CuS、Cu2S不溶于稀盐酸,但溶于浓盐酸。
(1)铜丝与浓硫酸反应的化学方程式为___________ 。
(2)试管中品红溶液褪色体现SO2的___________ 性,浸NaOH溶液的棉团作用是___________ 。
(3)甲组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
请解释形成墨绿色的原因:___________ 。
(4)乙组同学对白雾的成分经检验为H2SO4,设计实验证明该白雾为硫酸的实验操作如下:将白雾通入水中,取其部分,加入紫色石蕊试液变红;然后___________ ,则说明白雾为硫酸。
(5)丙组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有___________ 。滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,生成呈略黄色的[CuC1n]2-n(n=1~4),写出CuS与浓盐酸反应的离子方程式:___________ 。
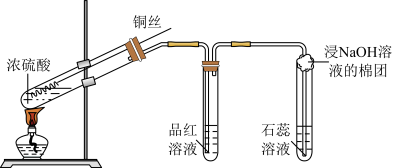
| 序号 | 操作 | 现象 |
| ① | 加热 | 铜丝表面变黑 |
| ② | 继续加热 | 有大量气泡产生,溶液变为墨绿色浊液,试管底部开始有灰白色沉淀生成。品红溶液褪色。 |
| ③ | 再加热 | 试管中出现“白雾”,浊液逐渐变为澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多 |
| ④ | 冷却,将灰白色固体倒入水中 | 形成蓝色溶液 |
(1)铜丝与浓硫酸反应的化学方程式为
(2)试管中品红溶液褪色体现SO2的
(3)甲组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
| 操作 | 现象 | |
| I组 | 直接取其铜丝(表面有聚氯乙烯薄膜)做实验 | 溶液变成墨绿色 |
| Ⅱ组 | 实验前,先将铜丝进行灼烧处理 | 溶液变蓝 |
(4)乙组同学对白雾的成分经检验为H2SO4,设计实验证明该白雾为硫酸的实验操作如下:将白雾通入水中,取其部分,加入紫色石蕊试液变红;然后
(5)丙组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):
A B
B C
C
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________ (填元素符号)
(2)若D是金属,C溶液在储存时应加入少量金属D,其理由是(用必要的文字和离子方程式表示)______
(3)若A、B、C为含同一种金属元素的无机化合物,且三种物质中有一种是白色不溶物。在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式_________ 、_________
(4)某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+。
①写出该氧化还原反应的离子方程式_______
②溶液随着酸性的增强氧化性不断增强,应选择_________ (选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
③如反应转移了0.6mol电子,则产生的气体在标准状况下体积为__________
(5)一份溶液中可能含有K+、Al3+、Mg2+、Fe2+、 H+、NH4+、Cl-、HCO3-、ClO-、AlO2-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
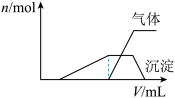
往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;则该溶液中一定存在的离子是_______ ,一定不存在的离子是________ 。
A
 B
B C
C试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为
(2)若D是金属,C溶液在储存时应加入少量金属D,其理由是(用必要的文字和离子方程式表示)
(3)若A、B、C为含同一种金属元素的无机化合物,且三种物质中有一种是白色不溶物。在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式
(4)某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+。
①写出该氧化还原反应的离子方程式
②溶液随着酸性的增强氧化性不断增强,应选择
③如反应转移了0.6mol电子,则产生的气体在标准状况下体积为
(5)一份溶液中可能含有K+、Al3+、Mg2+、Fe2+、 H+、NH4+、Cl-、HCO3-、ClO-、AlO2-等离子中的若干种。为了确定溶液的组成,进行了如下操作:

往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;则该溶液中一定存在的离子是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】某澄清透明溶液中可能含 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的一种或几种(不考虑离子水解),现进行如下实验:
中的一种或几种(不考虑离子水解),现进行如下实验:
①用玻璃棒蘸取少量溶液滴在红色石蕊试纸上,试纸变蓝;
②取少量原溶液于试管中,逐滴滴加盐酸至过量,有气体放出;
③再向②所得溶液中加入 溶液,没有沉淀生成;
溶液,没有沉淀生成;
④再向③所得溶液中滴加足量硝酸酸化后,加入 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
回答下列问题:
(1)根据步骤①可以推断溶液中一定含有___________ ,一定不含有___________ 。
(2)步骤②发生反应的离子方程式为___________ 。
(3)根据步骤②、③可以推断出溶液中一定含有___________ ,一定不含有___________ 。
(4)步骤④中产生的白色沉淀为___________ (填化学式)。
(5)通过步骤④不能确定溶液中含有 ,其原因是
,其原因是___________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的一种或几种(不考虑离子水解),现进行如下实验:
中的一种或几种(不考虑离子水解),现进行如下实验:①用玻璃棒蘸取少量溶液滴在红色石蕊试纸上,试纸变蓝;
②取少量原溶液于试管中,逐滴滴加盐酸至过量,有气体放出;
③再向②所得溶液中加入
 溶液,没有沉淀生成;
溶液,没有沉淀生成;④再向③所得溶液中滴加足量硝酸酸化后,加入
 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。回答下列问题:
(1)根据步骤①可以推断溶液中一定含有
(2)步骤②发生反应的离子方程式为
(3)根据步骤②、③可以推断出溶液中一定含有
(4)步骤④中产生的白色沉淀为
(5)通过步骤④不能确定溶液中含有
 ,其原因是
,其原因是
您最近一年使用:0次
【推荐3】为了将混有硫酸钠、碳酸氢铵的氯化钠提纯,并制得纯净的氯化钠溶液,某学生设计如下实验方案:

(1)加热除去物质的化学式为________ ,操作②___________ (填“能”或“不能”)用硝酸钡溶液,理由是___________ 。
(2)进行操作②后,取少许上层清液滴加___________ 溶液若无沉淀则 已除尽。
已除尽。
(3)操作③的目的是除去___________ 。
(4)操作⑤的目的是除去___________ 。
(5)加热煮沸的目的是除去___________ 。

(1)加热除去物质的化学式为
(2)进行操作②后,取少许上层清液滴加
 已除尽。
已除尽。(3)操作③的目的是除去
(4)操作⑤的目的是除去
(5)加热煮沸的目的是除去
您最近一年使用:0次



