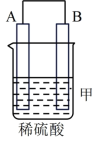
I.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
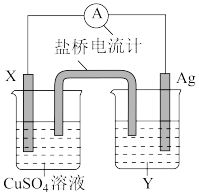
(1)电极 X 的材料是__________ 填化学式);电解质溶液 Y 是______ 填化学式)。
(2)银电极发生______ 填“氧化”或“还原”)反应,其电极反应式为_________ ;X 电极反应式为_____ 。
II. 高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放 电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
请回答下列问题:
(1)已知放电时负极反应为 Zn-2e-+2OH- ===Zn(OH)2,则正极反应 为_____________ 。
(2)放电时,_____ (填“正”或“负”)极附近溶液的 pH 升高。
(3)高铁电池充电时,电池的负极与电源的_____ (填“正极”或“负极”),充 电时与电池负极相连的电极反应为__________ 。
III.近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和 水分子通过。其工作原理的示意图如下:

请回答下列问题: (1)该燃料电池的总反应为_________ 。
(2)Pt(a)电极是电池的_____ (填“正”或“负”)极,电极反应式为:__________ ; Pt(b)电极反应式为___________ 。

请回答下列问题:
(1)电极 X 的材料是
(2)银电极发生
II. 高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放 电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
(1)已知放电时负极反应为 Zn-2e-+2OH- ===Zn(OH)2,则正极反应 为
(2)放电时,
(3)高铁电池充电时,电池的负极与电源的
III.近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和 水分子通过。其工作原理的示意图如下:

请回答下列问题: (1)该燃料电池的总反应为
(2)Pt(a)电极是电池的
更新时间:2019-12-16 20:19:50
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=Zn(OH)2+2Ag,其中一个电极反应为:Ag2O+H2O+2e-=2Ag+2OH-。
(1)判断正负极的材料:负极材料___ ,正极材料__ 。
(2)判断电池工作时,电子的流动方向和电解质溶液中离子的流动方向。电子由___ 到__ ,溶液中的阳离子流向电池的___ ,阴离子流向___ 。
(3)甲醇(CH3OH)燃料电池为绿色化学电源,在碱性NaOH溶液为电解质溶液时的负极电极反应式为___ 。正极反应式:___ 。该电池工作时,外电路每流过1×103mole-,消耗标况下氧气___ m3。
(1)判断正负极的材料:负极材料
(2)判断电池工作时,电子的流动方向和电解质溶液中离子的流动方向。电子由
(3)甲醇(CH3OH)燃料电池为绿色化学电源,在碱性NaOH溶液为电解质溶液时的负极电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,回答下列问题。
(1)铅蓄电池在放电时发生的总反应为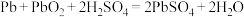 ,负极电极反应式为
,负极电极反应式为_______ 。工作后,铅蓄电池里电解质溶液的pH_______ (填“变大”“变小”或“不变”)。
(2)FeCl3溶液常用于腐蚀印刷电路板,发生反应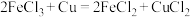 ,若将此反应设计成原电池,则负极所用电极材料为
,若将此反应设计成原电池,则负极所用电极材料为_______ 。当转移0.2mol电子时,被腐蚀的铜的质量为_______ g。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_______ 。
A铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)燃料电池是一种高效、环境友好的供电装置。
①如图是电解质溶液为稀硫酸的氢氧燃料电池原理示意图:_______ 。
②将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入甲烷气体的一极是原电池的_______ 极,该极的电极反应式是_______ 。
(1)铅蓄电池在放电时发生的总反应为
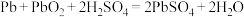 ,负极电极反应式为
,负极电极反应式为(2)FeCl3溶液常用于腐蚀印刷电路板,发生反应
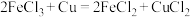 ,若将此反应设计成原电池,则负极所用电极材料为
,若将此反应设计成原电池,则负极所用电极材料为(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)燃料电池是一种高效、环境友好的供电装置。
①如图是电解质溶液为稀硫酸的氢氧燃料电池原理示意图:
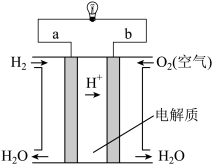
②将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入甲烷气体的一极是原电池的
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

①反应开始到平衡,用Z表示的反应速率为_____________ mol·L-1·s-1。
②Y的转化率为_________________ 。
③该反应的化学方程式为_____________________________________________ 。
(2)利用铜棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当铜棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。请回答下列问题:
①该原电池的正极反应式为:_________________________________ 。
②计算原稀硫酸的物质的量浓度为___________________ 。
③若将铜棒换成铁片,仍按题给方式组合起来,能否组成原电池呢?_______ (填“能”或“不能”) 若能组成原电池,此原电池的负极反应式是______________ 。

①反应开始到平衡,用Z表示的反应速率为
②Y的转化率为
③该反应的化学方程式为
(2)利用铜棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当铜棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。请回答下列问题:
①该原电池的正极反应式为:
②计算原稀硫酸的物质的量浓度为
③若将铜棒换成铁片,仍按题给方式组合起来,能否组成原电池呢?
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】高铁电池是一种新型可充电电池该电池能较长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
(1)高铁电池的负极材料是___ 。
(2)放电时,正极发生__ (填“氧化”或“还原”)反应;负极的电极反应式为__ 。
(3)放电时,__ (填“正”或“负”)极附近溶液的碱性增强。
 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。(1)高铁电池的负极材料是
(2)放电时,正极发生
(3)放电时,
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】随着国家大力发展清洁能源产业的要求,新能源产业规模迅速壮大。试完成下列问题。
(1)现在电瓶车所用电池一般为铅酸蓄电池,如图所示:

这是一种典型的可充电电池,电池总反应式为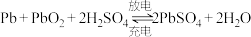 。则电池放电时,B电极的质量将
。则电池放电时,B电极的质量将___________ (填“增加”“减小”或“不变”),溶液的pH会___________ (填“增大”或“减小”),写出正极反应式:___________ 。
(2)中国科学院应用化学研究所在甲醇( 是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如图所示。
是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如图所示。

①该电池工作时,甲醇燃料应从___________ 口通入;
②该电池负极的电极反应式___________ ;
③工作一段时间后,当6.4g甲醇完全反应生成 时,有
时,有___________ mol电子转移。
(3)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质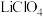 ,溶于混合有机溶剂中,
,溶于混合有机溶剂中, 通过电解质迁移入
通过电解质迁移入 晶格中,生成
晶格中,生成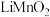 。
。

①电池的负极电极反应式为___________ ;
②组装该电池必须在无水、无氧条件下进行,其原因是___________ 。
(1)现在电瓶车所用电池一般为铅酸蓄电池,如图所示:

这是一种典型的可充电电池,电池总反应式为
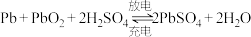 。则电池放电时,B电极的质量将
。则电池放电时,B电极的质量将(2)中国科学院应用化学研究所在甲醇(
 是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如图所示。
是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如图所示。
①该电池工作时,甲醇燃料应从
②该电池负极的电极反应式
③工作一段时间后,当6.4g甲醇完全反应生成
 时,有
时,有(3)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质
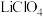 ,溶于混合有机溶剂中,
,溶于混合有机溶剂中, 通过电解质迁移入
通过电解质迁移入 晶格中,生成
晶格中,生成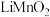 。
。
①电池的负极电极反应式为
②组装该电池必须在无水、无氧条件下进行,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】化学能和电能的相互转化是能量转换的重要形式,请按要求完成下列电化学相关问题。
(1)把A、B、C、D四种金属按表中装置进行实验。
根据表中信息判断四种金属活动性由大到小的顺序是___________ ;(用ABCD表示)
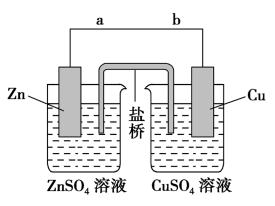
(2)盐桥式原电池的装置图如下___________ (填“正”或“负”)极。
②若装置中铜电极的质量增加3.2g,则导线中转移电子的数目为_________
③该装置的盐桥中除添加琼脂外,还要添加 饱和溶液,电池工作时,盐桥的作用是
饱和溶液,电池工作时,盐桥的作用是___________ 。
(3) 还原
还原 电化学法制备甲醇(
电化学法制备甲醇(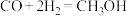 )的工作原理如图所示:
)的工作原理如图所示: 通过质子膜向
通过质子膜向___________ (填“左”或者“右”)移动,通 的一端发生的电极反应式为
的一端发生的电极反应式为___________ 。
(4)锂钊氧化物电池放电时的总反应: ,则其正极充电时的电极反应式为:
,则其正极充电时的电极反应式为:___________ 。
(5)以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成四甲基氢氧化铵[(CH3)4NOH],其工作原理如图所示(a、b为石墨,c、d、e为离子交换膜),当制备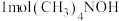 时,a、b两个极共产生
时,a、b两个极共产生___________  气体。
气体。
(1)把A、B、C、D四种金属按表中装置进行实验。
| 装置 |
|
|
|
| 电子从A到B | C电极的质量增加 | 金属D不断溶解 |
(2)盐桥式原电池的装置图如下
②若装置中铜电极的质量增加3.2g,则导线中转移电子的数目为
③该装置的盐桥中除添加琼脂外,还要添加
 饱和溶液,电池工作时,盐桥的作用是
饱和溶液,电池工作时,盐桥的作用是(3)
 还原
还原 电化学法制备甲醇(
电化学法制备甲醇(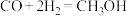 )的工作原理如图所示:
)的工作原理如图所示:
 通过质子膜向
通过质子膜向 的一端发生的电极反应式为
的一端发生的电极反应式为(4)锂钊氧化物电池放电时的总反应:
 ,则其正极充电时的电极反应式为:
,则其正极充电时的电极反应式为:(5)以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成四甲基氢氧化铵[(CH3)4NOH],其工作原理如图所示(a、b为石墨,c、d、e为离子交换膜),当制备
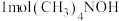 时,a、b两个极共产生
时,a、b两个极共产生 气体。
气体。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则可观察到在X极附近观察到的现象是__________ 电极反应式是________________ 检验Y电极反应产物的方法是____________________ 电解一段时间之后溶液的PH将会________ (升高、降低或不变),总方程式为_________________________ 。
(2)若X、Y都是铜电极,a是稀CuSO4溶液,开始实验,X极的电极反应式是__________________________ 。电解前后CuSO4溶液的浓度___________________ (变大、变小或不变)若X电极质量增重64克,则在电路中有_________________ mol的电子发生转移。
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则①X电极的材料是_____ ,电极反应式是_____________ 。②Y电极的材料是______ ,电极反应式是____________________ 。(说明:杂质发生的电极反应不必写出)

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则可观察到在X极附近观察到的现象是
(2)若X、Y都是铜电极,a是稀CuSO4溶液,开始实验,X极的电极反应式是
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则①X电极的材料是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题:
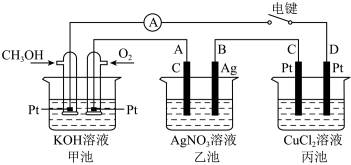
(1)甲池为______ (填“原电池”“电解池”或“电镀池”),通入 电极的电极反应式为
电极的电极反应式为______ ;
(2)乙池中A(石墨)电极的名称为______ (填“正极”“负极”“阴极”或“阳极”);
(3)当乙池中B极质量增加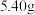 时,甲池中理论上消耗
时,甲池中理论上消耗 的体积为
的体积为______  (标准状况下),丙池中D极析出
(标准状况下),丙池中D极析出______ g铜;
(4)若丙池中电极不变,将其溶液换成 溶液,电键闭合一段时间后,甲中溶液的
溶液,电键闭合一段时间后,甲中溶液的 将
将______ (填“增大”“减小”或“不变”下同);丙中溶液的 将
将______ 。

(1)甲池为
 电极的电极反应式为
电极的电极反应式为(2)乙池中A(石墨)电极的名称为
(3)当乙池中B极质量增加
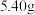 时,甲池中理论上消耗
时,甲池中理论上消耗 的体积为
的体积为 (标准状况下),丙池中D极析出
(标准状况下),丙池中D极析出(4)若丙池中电极不变,将其溶液换成
 溶液,电键闭合一段时间后,甲中溶液的
溶液,电键闭合一段时间后,甲中溶液的 将
将 将
将
您最近一年使用:0次
【推荐3】电化学原理在工农业生产中有重要应用。已知N2H4是一种重要的清洁高能燃料,根据如图所示装置完成(1)-(4)小题。(C1~C6均为石墨电极,假设各装置在工作过程中溶液体积不变):

(1)甲装置C2电极为______ 极(填“正”“负”“阳”或“阴”),C1电极上的电极反应式为______ 。
(2)若乙装置中溶液体积为400mL,开始时溶液pH为6,当电极上通过0.04mol电子时,溶液pH约为______ 。
(3)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气,膜X为______ 交换膜(填“正离子”“负离子”或“质子”),当电极上通过0.04mol电子时,中间硫酸钠废水的质量改变______ g(假定水分子不能通过膜X和膜Y)。
(4)电解一段时间后,丁装置的电解质溶液中能观察到的现象是______ ,丁装置中电解反应的总化学方程式为______ 。

(1)甲装置C2电极为
(2)若乙装置中溶液体积为400mL,开始时溶液pH为6,当电极上通过0.04mol电子时,溶液pH约为
(3)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气,膜X为
(4)电解一段时间后,丁装置的电解质溶液中能观察到的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】海洋深处有丰富的软锰矿,以此为主要原料生产MnSO4的工业流程如下:
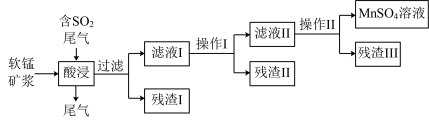
已知:①软锰矿的主要成分是MnO2,此外还含有Fe2O3、Al2O3、CuO、NiO、SiO2等少量杂质。
②几种离子沉淀时数据信息如下:
(1)酸浸过程中通入SO2的主要目的是_____ 。
(2)为了探究MnO2与SO2反应情况,某研究小组将含有SO2尾气和一定比例的空气通入MnO2悬浊液中,保持温度不变的情况下,测得溶液中c(Mn2+)和c( )随反应时间的变化如图所示。导致溶液中c(Mn2+)和c(
)随反应时间的变化如图所示。导致溶液中c(Mn2+)和c( )的变化产生明显差异的原因是
)的变化产生明显差异的原因是___ 。

(3)操作I是“除铁铝”,其主要步骤为向滤液I中加入软锰矿,调节p=5.2~6.0左右,使其Fe3+、Al3+沉淀完全,再加入活性炭搅拌、抽滤。 写出向滤液I中加入软锰矿除Fe2+的离子方程式___
(4)操作Ⅱ是“除铜镍”,其主要步骤为:向滤液Ⅱ中加入MnS(难溶物),充分搅拌,过滤。写出加入MnS除去滤液Ⅱ中Cu2+的离子方程式__ 。
(5)以MnSO4溶液为原料可通过电解法制备超级电容器材料MnO2,其装置如图所示:
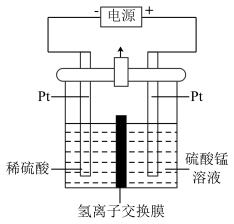
则电解过程中阳极电极反应式为__ ,电解一段时间后,阴极溶液中H+的物质的量__ (填“变大”、“减小”或“不变”)。实际生产过程中___ (填“能”或“不能”)用MnCl2溶液代替MnSO4溶液。

已知:①软锰矿的主要成分是MnO2,此外还含有Fe2O3、Al2O3、CuO、NiO、SiO2等少量杂质。
②几种离子沉淀时数据信息如下:
| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 |
| 完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 |
(2)为了探究MnO2与SO2反应情况,某研究小组将含有SO2尾气和一定比例的空气通入MnO2悬浊液中,保持温度不变的情况下,测得溶液中c(Mn2+)和c(
 )随反应时间的变化如图所示。导致溶液中c(Mn2+)和c(
)随反应时间的变化如图所示。导致溶液中c(Mn2+)和c( )的变化产生明显差异的原因是
)的变化产生明显差异的原因是
(3)操作I是“除铁铝”,其主要步骤为向滤液I中加入软锰矿,调节p=5.2~6.0左右,使其Fe3+、Al3+沉淀完全,再加入活性炭搅拌、抽滤。 写出向滤液I中加入软锰矿除Fe2+的离子方程式
(4)操作Ⅱ是“除铜镍”,其主要步骤为:向滤液Ⅱ中加入MnS(难溶物),充分搅拌,过滤。写出加入MnS除去滤液Ⅱ中Cu2+的离子方程式
(5)以MnSO4溶液为原料可通过电解法制备超级电容器材料MnO2,其装置如图所示:

则电解过程中阳极电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为_______ 。
(2)在电解槽中,发生电解反应的离子方程式为_______ 。
(3)煅烧窑中,生成LiMn2O4反应的化学方程式是_______ 。
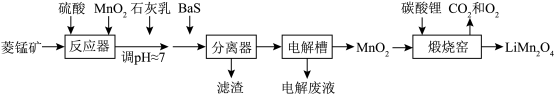
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为
(2)在电解槽中,发生电解反应的离子方程式为
(3)煅烧窑中,生成LiMn2O4反应的化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】电解装置如图所示:
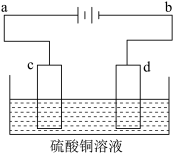
(1)当用惰性电极电解时,c为____________ 极,电极反应________ d为____________ 极,电极反应______________ ,电解总反应的化学方程____________________
(2)①若用此装置进行铁上镀铜则c为__________ (填铁或铜)d为___________ (填铁或铜)电解液浓度_____________ (增大,减小或不变)
②电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子___________ mol.
(3)若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极________ (填图中的字母);若粗铜中还含有Au、Ag、Fe,则Fe以_______ (填离子符号)形式进入溶液,c电极发生的反应______________ ,________________ 。

(1)当用惰性电极电解时,c为
(2)①若用此装置进行铁上镀铜则c为
②电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子
(3)若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极
您最近一年使用:0次