为确认 、
、 、
、 的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:
的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:________ 。
(2)装置B所盛的试剂是_____________ ,其作用是__________________ 。
(3)装置C所盛试剂是________________ ,C中反应的离子方程式是____________ 。
(4)由此得到的结论是酸性:________ >________ >________ 。
 、
、 、
、 的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:
的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答: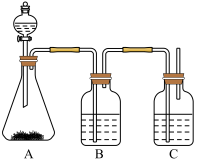
(2)装置B所盛的试剂是
(3)装置C所盛试剂是
(4)由此得到的结论是酸性:
11-12高一·全国·课后作业 查看更多[21]
(已下线)2012年人教版高中化学必修一4.1 无机非金属材料的主角-硅练习卷(已下线)4.1.1 二氧化硅和硅酸高中化学人教版 必修1 第四章 非金属及其化合物 1.无机非金属材料的主角——硅 二氧化硅和硅酸2018年高一化学(人教版)必修1综合题型练习卷:非金属及其化合物2019届高三化学一轮复习针对训练:碳、硅及其化合物【市级联考】吉林省公主岭市2018-2019学年高一上学期期末考试化学试题湖北省仙桃市汉江中学2017-2018学年高一上学期期末考试化学试题【全国百强校】河北省武邑中学2018-2019学年高一下学期开学考试化学试题(已下线)2019年11月15日 《每日一题》化学人教版(必修1)——硅酸及硅酸盐的性质步步为赢 高一化学寒假作业:作业十二 无机非金属材料的主角——硅2020年春季人教版高中化学必修1第四章《非金属及其化合物》测试卷(已下线)【南昌新东方】2019 南昌十中 高一下 第一次月考(已下线)4.1.1 二氧化硅和硅酸(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第三节 无机非金属材料青海省西宁市普通高中五校2020-2021学年高三上学期期末联考化学试题青海西宁市田家寨中学2020-2021学年高一下学期第一次月考化学试题广东省佛山市萌茵实验学校2020-2021学年高一下学期第一次月考化学试题(已下线)第09讲 硅的化合物 新型无机非金属材料(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)(已下线)【期中复习】必刷题-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)安徽省合肥市第一中学2022-2023学年高一下学期第一次月考化学试题广东省湛江市某校2023-2024学年高一上学期第三次月考化学试题
更新时间:2019/12/20 15:49:04
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】(1)根据二氧化硅的性质,写出下列反应或原因相应的化学方程式:
①二氧化硅与氧化钙反应______ 。
②实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因是______ 。
③实验室中不能用玻璃瓶盛放氢氟酸的原因是______ 。
(2)为确认HCl、 、
、 的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
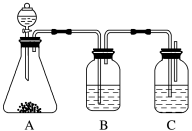
①锥形瓶中装某可溶性正盐固体,分液漏斗所盛试剂应为______ 。
②装置B所盛的试剂是______ ,其作用是______ 。
③装置C中反应的离子方程式是______ 。
④由此得到的结论是酸性:______ >______ >______ 。
①二氧化硅与氧化钙反应
②实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因是
③实验室中不能用玻璃瓶盛放氢氟酸的原因是
(2)为确认HCl、
 、
、 的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
①锥形瓶中装某可溶性正盐固体,分液漏斗所盛试剂应为
②装置B所盛的试剂是
③装置C中反应的离子方程式是
④由此得到的结论是酸性:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】由两种元素组成的化合物A,按如下流程进行实验。气体B能使湿润的红色石蕊试纸变蓝;固体E可做耐高温材料。
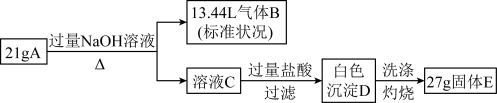
请回答:
(1)组成A的两种元素是_______ (用元素符号表示);
(2)写出A与NaOH溶液反应的化学方程式_______ ;
(3)溶液C与过量盐酸反应的离子方程式是_______ ;
(4)气体B与氧化铁在高温下反应,生成黑色粉末(纯净物),黑色粉末成分可能是_______ ,请给出检验黑色粉末的实验方案_______ 。

请回答:
(1)组成A的两种元素是
(2)写出A与NaOH溶液反应的化学方程式
(3)溶液C与过量盐酸反应的离子方程式是
(4)气体B与氧化铁在高温下反应,生成黑色粉末(纯净物),黑色粉末成分可能是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】利用如图所示实验装置可完成中学化学中的一些实验。请回答下列问题:

(1)仪器A的名称为___ 。
(2)若要证明非金属性:Cl>S,则可在A中加浓盐酸,B中加KMnO4(已知:KMnO4与浓盐酸常温下反应可生成氯气),C中加入Na2S溶液,观察到C中产生淡黄色浑浊的现象,即可证明,C中发生反应的离子方程式为___ ,若从环境保护的角度考虑,此装置还缺少尾气处理装置,可用___ 溶液吸收尾气。
(3)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4>H2CO3>H2SiO3,回答下列问题:
①A中试剂为___ ,B中试剂为___ 。
②要得出酸性H2SO4>H2CO3>H2SiO3的结论,则C中应观察到的现象为___ 。
(4)利用如图装置证明SO2气体具有漂白性。已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。在装置A中加入70%的硫酸溶液,B中加入Na2SO3粉末,C中加入品红溶液。打开分液漏斗活塞,一段时间后C中观察到的现象是___ ,待反应完全后,将试管C加热一段时间发生的现象是___ ,即可证明SO2气体具有漂白性。

(1)仪器A的名称为
(2)若要证明非金属性:Cl>S,则可在A中加浓盐酸,B中加KMnO4(已知:KMnO4与浓盐酸常温下反应可生成氯气),C中加入Na2S溶液,观察到C中产生淡黄色浑浊的现象,即可证明,C中发生反应的离子方程式为
(3)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4>H2CO3>H2SiO3,回答下列问题:
①A中试剂为
②要得出酸性H2SO4>H2CO3>H2SiO3的结论,则C中应观察到的现象为
(4)利用如图装置证明SO2气体具有漂白性。已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。在装置A中加入70%的硫酸溶液,B中加入Na2SO3粉末,C中加入品红溶液。打开分液漏斗活塞,一段时间后C中观察到的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】如图为铜丝与浓硫酸反应并验证其产物性质的实验装置。
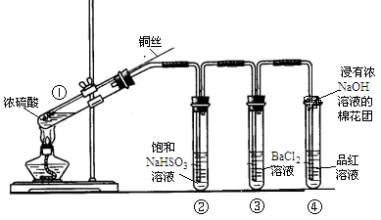
(1)①中反应的化学方程式是___ 。
(2)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。若要立即终止铜与硫酸的反应,恰当的方法是___ 。
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
(4)④中棉花团的作用是___ (用离子方程式表示)。
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是___ 。

(1)①中反应的化学方程式是
(2)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。若要立即终止铜与硫酸的反应,恰当的方法是
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
| 加入试剂 | 现象 | 分析与解释 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | 沉淀为 |
| 第二份 | 加入氯水 | 有白色沉淀生成 | 沉淀为 |
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
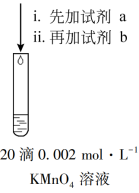
【推荐2】实验小组探究溶液酸碱性对锰化合物和 氧化还原反应的影响。
氧化还原反应的影响。
资料:ⅰ. 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。
ⅱ. 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。
ⅲ. 为微溶物
为微溶物
(1)用离子方程式解释实验Ⅰ中出现乳白色浑浊的原因_____ 。
(2)已知,实验Ⅰ、Ⅱ、Ⅲ中 均被氧化为
均被氧化为 。针对实验Ⅰ、Ⅱ、Ⅲ进行分析:
。针对实验Ⅰ、Ⅱ、Ⅲ进行分析:
①对于 氧化性的认识是
氧化性的认识是_____ 。
②实验Ⅱ所得溶液中 的检验方法为
的检验方法为_____ 。
(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为_____ 。
②实验Ⅳ中“静置 ,有棕黑色沉淀生成”的可能原因:
,有棕黑色沉淀生成”的可能原因:_____ (写出2点)。
(4)针对实验Ⅲ、Ⅵ继续探究:
①实验Ⅴ:向实验Ⅲ的试管中继续滴加足量 ,振荡,溶液立即变为紫红色。产生棕黑色沉淀。
,振荡,溶液立即变为紫红色。产生棕黑色沉淀。
②实验Ⅵ:向实验Ⅵ的试管中继续滴加足量 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失。静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失。静置一段时间后,出现乳白色浑浊。
对比实验Ⅴ、Ⅵ,结合方程式分析实验Ⅵ滴加 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因_____ 。
(5)综合上述实验,在下图中用连线的方式补充完善实验Ⅰ~Ⅵ已证实 的锰化合物转化关系_____ 。
 氧化还原反应的影响。
氧化还原反应的影响。资料:ⅰ.
 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。ⅱ.
 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。ⅲ.
 为微溶物
为微溶物| 实验 | 序号 | 试剂 | 现象 |
| Ⅰ |  :10滴 :10滴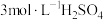 溶液 溶液 :20滴 :20滴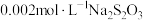 溶液 溶液 | 溶液紫色变浅至接近无色,静置一段时间后出现乳白色浑浊。 |
| Ⅱ |  :10滴蒸馏水 :10滴蒸馏水 :20滴 :20滴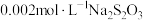 溶液 溶液 | 紫色溶液逐渐褪色,产生棕黑色沉淀。 | |
| Ⅲ |  :10滴 :10滴 溶液 溶液 :2滴 :2滴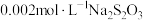 溶液和18滴蒸馏水 溶液和18滴蒸馏水 | 溶液变为绿色,无沉淀生成;静置 ,未见明显变化。 ,未见明显变化。 | |
| Ⅳ |  :10滴 :10滴 溶液 溶液 :20滴 :20滴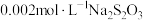 溶液 溶液 | 溶液变为绿色,无沉淀生成;静置 ,绿色变浅,有棕黑色沉淀生成。 ,绿色变浅,有棕黑色沉淀生成。 |
(1)用离子方程式解释实验Ⅰ中出现乳白色浑浊的原因
(2)已知,实验Ⅰ、Ⅱ、Ⅲ中
 均被氧化为
均被氧化为 。针对实验Ⅰ、Ⅱ、Ⅲ进行分析:
。针对实验Ⅰ、Ⅱ、Ⅲ进行分析:①对于
 氧化性的认识是
氧化性的认识是②实验Ⅱ所得溶液中
 的检验方法为
的检验方法为(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为
②实验Ⅳ中“静置
 ,有棕黑色沉淀生成”的可能原因:
,有棕黑色沉淀生成”的可能原因:(4)针对实验Ⅲ、Ⅵ继续探究:
①实验Ⅴ:向实验Ⅲ的试管中继续滴加足量
 ,振荡,溶液立即变为紫红色。产生棕黑色沉淀。
,振荡,溶液立即变为紫红色。产生棕黑色沉淀。②实验Ⅵ:向实验Ⅵ的试管中继续滴加足量
 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失。静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失。静置一段时间后,出现乳白色浑浊。对比实验Ⅴ、Ⅵ,结合方程式分析实验Ⅵ滴加
 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因(5)综合上述实验,在下图中用连线的方式补充完善实验Ⅰ~Ⅵ
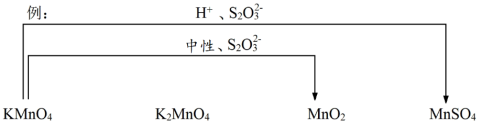
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】实验表明,当乙醛加入溴水中,溴水会褪色。针对此现象,某化学兴趣小组同学依据乙醛结构进行探究。
[实验假设]
(1)假设I:醛基含有不饱和键,可与Br2发生___________ (填反应类型)反应。
假设II:乙醛具有α-H,可与溴水发生取代反应。无论乙醛发生几元取代反应,乙醛与溴水发生一元取代反应的方程式:___________ 。
假设III:乙醛具有较强的还原性,可被溴水氧化,反应的化学方程式为___________ 。
[实验过程]
针对以上假设,该小组同学设计了两组方案。
方案I:通过对比反应现象判断反应类型。
(2)由试管2中的实验现象可得出结论:假设___________ 不成立。
方案II:通过测定反应后混合液的pH判断反应类型。
注:苯酚和乙酸的电离及温度变化对混合液pH的影响可忽略不计。
(3)写出苯酚与溴水反应的化学方程式:___________ 。若试管4中反应后混合液的pH=1.85,则假设___________ 成立。若试管4中反应后混合液的pH<1.85则假设___________ 成立。
[实验假设]
(1)假设I:醛基含有不饱和键,可与Br2发生
假设II:乙醛具有α-H,可与溴水发生取代反应。无论乙醛发生几元取代反应,乙醛与溴水发生一元取代反应的方程式:
假设III:乙醛具有较强的还原性,可被溴水氧化,反应的化学方程式为
[实验过程]
针对以上假设,该小组同学设计了两组方案。
方案I:通过对比反应现象判断反应类型。
| 序号 | 操作 | 现象 |
| 试管1 | 1 mL溴水+1 mL乙醛,充分振荡后静置 | 褪色 |
| 试管2 | 1 mL溴的CCl4溶液+1 mL乙醛,充分振荡后静置 | 不褪色 |
方案II:通过测定反应后混合液的pH判断反应类型。
| 序号 | 操作 | pH |
| 试管3 | 加入20 mL溴水,再加入10 mL苯酚溶液,待完全反应后(苯酚过量),测定混合液pH | 1.85 |
| 试管4 | 加入20 mL相同浓度的溴水,再加入10 mL 20%的乙醛溶液(乙醛过量),3 min后完全褪色,测定混合液pH | ? |
(3)写出苯酚与溴水反应的化学方程式:
您最近一年使用:0次