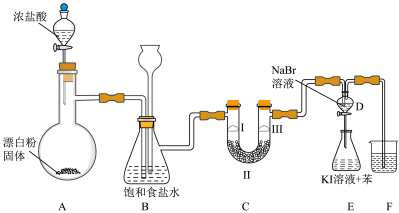
如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略) __________________________________ ;装置A部分用来装漂白粉的仪器名称是____________ 。
(2)装置B中饱和食盐水的作用是___________________________ ,同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞。请写出C中发生堵塞时B中的现象_________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是___________ (填字母编号).
(4)设计装置D、E的目的验证氧化性强弱顺序:Cl2 >Br2 >I2。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_____________________ ,该现象______ (填“能”或“不能”)说明溴单质的氧化性强于碘,原因是________________ 。
(5)装置F的作用是___________ ,其烧杯中的溶液不能 选用下列中的____________ (填字母编号)。
a.饱和NaOH溶液 b.饱和NaCl 溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)装置F的作用是
a.饱和NaOH溶液 b.饱和NaCl 溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.
更新时间:2020-01-07 10:46:31
|
【知识点】 化学实验探究
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:______ 。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______ 。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______ 。
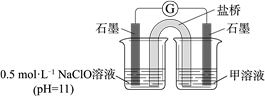
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是______ ,实验现象是______ 。
(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是______ 。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是______ 。欲证明实验Ⅱ所得溶液中存在IO3−,改进的实验方案是______ 。
③ 实验Ⅱ中反应的离子方程式是______ 。
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ |  | ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ |  | ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是

(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是
③ 实验Ⅱ中反应的离子方程式是
您最近一年使用:0次
【推荐2】过硫酸钠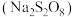 常用作漂白剂、氧化剂等。某研究小组利用如图装置制备
常用作漂白剂、氧化剂等。某研究小组利用如图装置制备 并探究其性质
并探究其性质 加热及夹持仪器略去
加热及夹持仪器略去 。
。
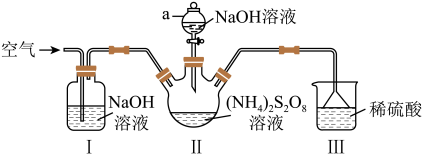
已知: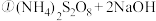
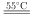
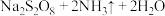
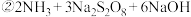
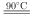
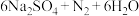
⑴仪器a的名称是______ 。装置Ⅰ中NaOH溶液的作用是______ 。
⑵装置Ⅱ发生反应的同时,需要持续通入空气的目的是______ 。
⑶装置Ⅲ的作用是______ 。
⑷ 溶液与铜反应只生成两种盐,且反应先慢后快。
溶液与铜反应只生成两种盐,且反应先慢后快。
①该反应的化学方程式为______ 。
②某同学推测反应先慢后快的原因可能是生成的 对反应起催化作用。设计实验方案验证该推测是否正确
对反应起催化作用。设计实验方案验证该推测是否正确______ 。(供选试剂:Cu、 溶液、
溶液、 溶液、
溶液、 溶液、蒸馏水)
溶液、蒸馏水)
⑸测定产品纯度:称取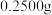 样品,用蒸馏水溶解,加入过量KI,充分反应后,再滴加几滴指示剂,用
样品,用蒸馏水溶解,加入过量KI,充分反应后,再滴加几滴指示剂,用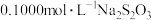 标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为
标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为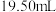 。(已知:
。(已知: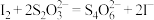 )
)
①选用的指示剂是______ ;达到滴定终点的现象是______ 。
②样品的纯度为______ %。
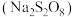 常用作漂白剂、氧化剂等。某研究小组利用如图装置制备
常用作漂白剂、氧化剂等。某研究小组利用如图装置制备 并探究其性质
并探究其性质 加热及夹持仪器略去
加热及夹持仪器略去 。
。
已知:
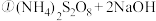
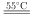
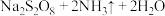
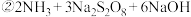
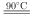
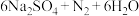
⑴仪器a的名称是
⑵装置Ⅱ发生反应的同时,需要持续通入空气的目的是
⑶装置Ⅲ的作用是
⑷
 溶液与铜反应只生成两种盐,且反应先慢后快。
溶液与铜反应只生成两种盐,且反应先慢后快。①该反应的化学方程式为
②某同学推测反应先慢后快的原因可能是生成的
 对反应起催化作用。设计实验方案验证该推测是否正确
对反应起催化作用。设计实验方案验证该推测是否正确 溶液、
溶液、 溶液、
溶液、 溶液、蒸馏水)
溶液、蒸馏水) ⑸测定产品纯度:称取
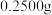 样品,用蒸馏水溶解,加入过量KI,充分反应后,再滴加几滴指示剂,用
样品,用蒸馏水溶解,加入过量KI,充分反应后,再滴加几滴指示剂,用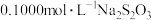 标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为
标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为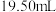 。(已知:
。(已知: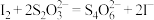 )
)①选用的指示剂是
②样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】为了减少“84”消毒液对物品的腐蚀,天津一中高三师生给教室消毒使用的是二氧化氯泡腾片。二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体 ,其熔点为 -59℃,沸点为11.0℃,易溶于水。是目前国际上公认的新—代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面有广泛应用的高效安全消毒剂。与(Cl2)相比(ClO2)不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
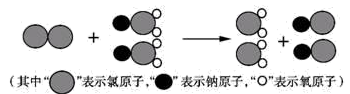
该反应的化学方程式为____________ 。
Ⅰ.ClO2是—种优良的消毒剂 ,浓度过高时易发生分解,为了运输和贮存便利常将其制成NaClO2固体 ,模拟工业上用过氧化氢法制备NaClO2固体的实验装置如图所示:
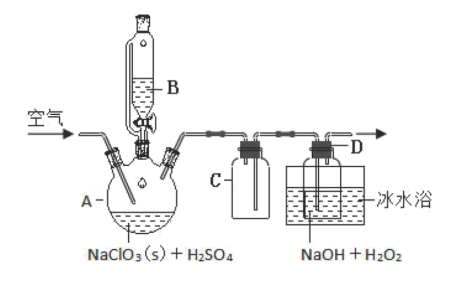
已知:H2O2沸点 150℃;A中的化学方程式:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(2)NaClO3放入仪器 A中,仪器B中的药品是________ (写化学式)。
(3)如果仪器B 改成分液漏斗,实验过程中可能会出现的实验现象_______ 。
(4)向 A 装詈中通入空气,其作用是赶出ClO2然后通过C 再到 D 中反应。通空气不能过快的,空气流速过快时ClO2不能被充分吸收;通空气也不能过慢,其原因是_________ 。
(5)冰水浴冷却的目的是_____ 。
a.降低NaClO2的溶解度 b.减少H2O2的分解
c.使ClO2变为液态 d. 加快反应速率
Ⅱ.“稳定性二氧化氯溶液”是淡黄色透明液体,广泛应用于食品卫生等领域的杀菌消毒。ClO2稳定性较差,“稳定性二氧化氯溶液”是以碳酸钠为稳定剂,有效成分为NaClO2。
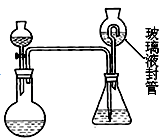
某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题:
(6)为证实“稳定性二氧化氯溶液”中含有钠离子,方法是:______ 。
(7)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取 mg(2g 左右)试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液 ;②在锥形瓶中加入4g 碘化钾,用 100 mL水溶解后 ,再加 3 mL 硫酸溶液 ;③ 在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmo l/L硫代硫酸钠标准溶液滴定至蓝色消失 (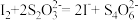 ), 共用去VmL 硫代硫酸钠溶液。
), 共用去VmL 硫代硫酸钠溶液。
①NaClO2与盐酸反应生成ClO2(还原产物为Cl-)该反应的化学方程式为:_______ ;
②ClO2通入锥形瓶与酸性碘化钾溶液反应,二氧化氯被还原为氯离子,该反应的离子方程式为:_______ 。
③“稳定性二氧化氯溶液”中,ClO2的质量分数为_____ (用m、c、V表示)。

(1)我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:

该反应的化学方程式为
Ⅰ.ClO2是—种优良的消毒剂 ,浓度过高时易发生分解,为了运输和贮存便利常将其制成NaClO2固体 ,模拟工业上用过氧化氢法制备NaClO2固体的实验装置如图所示:

已知:H2O2沸点 150℃;A中的化学方程式:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(2)NaClO3放入仪器 A中,仪器B中的药品是
(3)如果仪器B 改成分液漏斗,实验过程中可能会出现的实验现象
(4)向 A 装詈中通入空气,其作用是赶出ClO2然后通过C 再到 D 中反应。通空气不能过快的,空气流速过快时ClO2不能被充分吸收;通空气也不能过慢,其原因是
(5)冰水浴冷却的目的是
a.降低NaClO2的溶解度 b.减少H2O2的分解
c.使ClO2变为液态 d. 加快反应速率
Ⅱ.“稳定性二氧化氯溶液”是淡黄色透明液体,广泛应用于食品卫生等领域的杀菌消毒。ClO2稳定性较差,“稳定性二氧化氯溶液”是以碳酸钠为稳定剂,有效成分为NaClO2。

某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题:
(6)为证实“稳定性二氧化氯溶液”中含有钠离子,方法是:
(7)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取 mg(2g 左右)试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液 ;②在锥形瓶中加入4g 碘化钾,用 100 mL水溶解后 ,再加 3 mL 硫酸溶液 ;③ 在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmo l/L硫代硫酸钠标准溶液滴定至蓝色消失 (
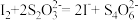 ), 共用去VmL 硫代硫酸钠溶液。
), 共用去VmL 硫代硫酸钠溶液。①NaClO2与盐酸反应生成ClO2(还原产物为Cl-)该反应的化学方程式为:
②ClO2通入锥形瓶与酸性碘化钾溶液反应,二氧化氯被还原为氯离子,该反应的离子方程式为:
③“稳定性二氧化氯溶液”中,ClO2的质量分数为
您最近一年使用:0次



