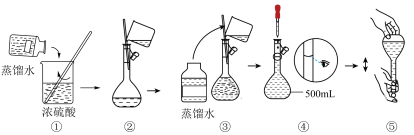
实验室用18.4mol•L-1的浓硫酸来配制480mL0.2mol•L-1的稀硫酸。可供选用的仪器有:①胶头滴管②烧瓶③烧杯④药匙⑤量筒⑥托盘天平⑦玻璃棒
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有___ (选填序号),还缺少的仪器有(写仪器名称)___ 。
(2)需要用量筒量取上述浓硫酸的体积为___ mL,量取浓硫酸时应选用___ (选填 ①10mL②50mL③100mL)规格的量筒。
(3)实验中两次用到玻璃棒,其作用分别是:___ 、___ 。
(4)下列对容量瓶及其使用方法的描述中正确的是___ 。
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有___ (填序号)
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,仰视刻度线
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有
(2)需要用量筒量取上述浓硫酸的体积为
(3)实验中两次用到玻璃棒,其作用分别是:
(4)下列对容量瓶及其使用方法的描述中正确的是
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,仰视刻度线
更新时间:2020-01-07 16:42:38
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某“84”消毒液部分标签如图所示,回答下列问题:
(1)某实验需用480mL0.2mol·L-1NaClO的消毒液,现用NaClO固体配制。
a.需要用托盘天平称量NaClO的固体质量为________ g;
b.配制时,一般可分为以下几个步骤:
①称量,②计算,③溶解,④摇匀,⑤移液,⑥洗涤,⑦定容,⑧冷却
正确的操作顺序为:________ (填序号)。
(2)在配制过程中,除需要托盘天平、烧杯、玻璃棒外还必需的仪器有_________________ 。
(3)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①容量瓶用蒸馏水洗净后,没烘干就直接使用:____________ 。
②溶解后未经冷却就移液:____________ 。
③移液时,有少量液体溅出:____________ 。
④定容时,俯视刻度线:____________ 。
| 净含量:500mL密度:1.19g·cm-3 主要成分:25%NaClO(NaClO的摩尔质量74.5g·mol-1) 注意事项:密封保存 |
a.需要用托盘天平称量NaClO的固体质量为
b.配制时,一般可分为以下几个步骤:
①称量,②计算,③溶解,④摇匀,⑤移液,⑥洗涤,⑦定容,⑧冷却
正确的操作顺序为:
(2)在配制过程中,除需要托盘天平、烧杯、玻璃棒外还必需的仪器有
(3)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①容量瓶用蒸馏水洗净后,没烘干就直接使用:
②溶解后未经冷却就移液:
③移液时,有少量液体溅出:
④定容时,俯视刻度线:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】硫酸亚铁铵[化学为Fe(NH4)a(SO4)b·6H2O]俗称摩尔盐,相对分子质量为392,易溶于水,不溶于乙醇。现通过下列流程制取并进行纯度测定:

(1)硫酸亚铁铵的化学式中从化合价角度考虑,a、b之间的等量关系式是___________ 。“酸溶”中,铁与稀硫酸反应的离子方程式是___________ 。
(2)使用无水乙醇洗涤硫酸亚铁铵晶体,目的是___________ (至少写出两点)。
(3)为测定得到的硫酸亚铁铵的纯度,进行下列操作:
步骤一:取适量KMnO4固体,配成250mL0.100mol·L-1溶液。
步骤二:取4.000g硫酸亚铁铵样品配成溶液。向其中滴入0.100mol·L-1KMnO4溶液至反应完全。
步骤三:重复3次实验,平均消耗KMnO4溶液20.00mL。
已知:①MnO +5Fe2++8H+=Mn2++5Fe3++4H2O;
+5Fe2++8H+=Mn2++5Fe3++4H2O;
②纯度= ×100%
×100%
①配制该KMnO4溶液所需固体的质量是___________ (保留四位有效数字)。
②定容时俯视,配制所得到的KMnO4溶液浓度将___________ (填“偏大”、“偏小”或“无影响”)。
③通过计算求出该硫酸亚铁铵产品的纯度(写出计算的过程)。___________

(1)硫酸亚铁铵的化学式中从化合价角度考虑,a、b之间的等量关系式是
(2)使用无水乙醇洗涤硫酸亚铁铵晶体,目的是
(3)为测定得到的硫酸亚铁铵的纯度,进行下列操作:
步骤一:取适量KMnO4固体,配成250mL0.100mol·L-1溶液。
步骤二:取4.000g硫酸亚铁铵样品配成溶液。向其中滴入0.100mol·L-1KMnO4溶液至反应完全。
步骤三:重复3次实验,平均消耗KMnO4溶液20.00mL。
已知:①MnO
 +5Fe2++8H+=Mn2++5Fe3++4H2O;
+5Fe2++8H+=Mn2++5Fe3++4H2O;②纯度=
 ×100%
×100%①配制该KMnO4溶液所需固体的质量是
②定容时俯视,配制所得到的KMnO4溶液浓度将
③通过计算求出该硫酸亚铁铵产品的纯度(写出计算的过程)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】“84 消毒液”能有效杀灭甲型 H1N1 病毒,某同学购买了一瓶“威露士”牌“84 消毒液”,该消毒液通常稀释 100 倍(体积比)使用。查阅相关资料和消毒液包装说明得到 如下信息:
① ②NaClO = Na++ClO-
②NaClO = Na++ClO-
(1)该“84 消毒液”的物质的量浓度约为_____ (保留 1 位小数)。
(2)某同学取 100mL 该“84 消毒液”,按要求稀释后用于消毒,稀释后的溶液中c(Na+)=_____ mol·L−1。
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 480mL 含 NaClO 质量分数为25%的消毒液。下列说法不正确的是____________ (填字母)。
A.如下图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.将称量好的 NaClO 固体在烧杯中溶解后应立即转入容量瓶
C.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量 NaClO 固体的质量为 149.0g

(4)该同学对容量瓶及其使用方法的认识中正确的是_____ (填字母)。
A.容量瓶上标有容积、温度和浓度 B.使用前要检查容量瓶是否漏液 C.容量瓶用蒸馏水洗净后,须烘干后再使用 D.配制溶液过程中,容量瓶内液体只需要一次摇匀过程
(5)一瓶上述“威露士”牌“84 消毒液”能吸收空气中_____ L 的 CO2(标准状况)而变质。(已 知:CO2+NaClO+H2O=NaHCO3+HClO)
(6)“84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 18.4 mol·L-1 的浓 硫酸配制 500 mL2.3 mol•L﹣1的稀硫酸用于增强“84 消毒液”的消毒能力,需取用浓硫酸的体 积为______________ mL。
(7)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_____ (填代号)。
①用量筒量取 98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的 H2SO4溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
(8)现有密度为 d g/mL 浓度为 18 mol/L 的浓硫酸溶液 100 g ,需要加入一定量的水将其 稀释为浓度是 9 mol/L,则加入水的体积是_____ (填字母)
A.大于 100 mL B.小于 l00 mL C.等于 100 mL
①
 ②NaClO = Na++ClO-
②NaClO = Na++ClO-(1)该“84 消毒液”的物质的量浓度约为
(2)某同学取 100mL 该“84 消毒液”,按要求稀释后用于消毒,稀释后的溶液中c(Na+)=
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 480mL 含 NaClO 质量分数为25%的消毒液。下列说法不正确的是
A.如下图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.将称量好的 NaClO 固体在烧杯中溶解后应立即转入容量瓶
C.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量 NaClO 固体的质量为 149.0g

(4)该同学对容量瓶及其使用方法的认识中正确的是
A.容量瓶上标有容积、温度和浓度 B.使用前要检查容量瓶是否漏液 C.容量瓶用蒸馏水洗净后,须烘干后再使用 D.配制溶液过程中,容量瓶内液体只需要一次摇匀过程
(5)一瓶上述“威露士”牌“84 消毒液”能吸收空气中
(6)“84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 18.4 mol·L-1 的浓 硫酸配制 500 mL2.3 mol•L﹣1的稀硫酸用于增强“84 消毒液”的消毒能力,需取用浓硫酸的体 积为
(7)在配制过程中,下列操作中能使所配溶液的浓度偏高的有
①用量筒量取 98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的 H2SO4溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
(8)现有密度为 d g/mL 浓度为 18 mol/L 的浓硫酸溶液 100 g ,需要加入一定量的水将其 稀释为浓度是 9 mol/L,则加入水的体积是
A.大于 100 mL B.小于 l00 mL C.等于 100 mL
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室用NaOH固体配制250 mL1.25 mol/L的NaOH溶液,请回答下列问题:
(1)配制时必须的玻璃仪器有:烧杯、玻璃棒、胶头滴管、_______ 。
(2)用托盘天平称取_______ g固体NaOH。
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_______ ;
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水(约30 mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)下列配制的溶液浓度偏低的是_______ ;
A.向容量瓶中转移溶液时(实验步骤C)不慎有液滴洒在容量瓶外面
B.加蒸馏水时不慎超过了刻度线
C.定容时俯视刻度线
D.配制前,容量瓶中有少量蒸馏水
(5)某同学改用固体Na2CO3配制Na2CO3溶液的过程如图所示,其错误操作序号 是_______ 。

(6)如果固体Na2CO3中混有少量杂质Na2SO4,可按规定程序检测出来。请写出所加的试剂和顺序_______ 。
(1)配制时必须的玻璃仪器有:烧杯、玻璃棒、胶头滴管、
(2)用托盘天平称取
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水(约30 mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)下列配制的溶液浓度偏低的是
A.向容量瓶中转移溶液时(实验步骤C)不慎有液滴洒在容量瓶外面
B.加蒸馏水时不慎超过了刻度线
C.定容时俯视刻度线
D.配制前,容量瓶中有少量蒸馏水
(5)某同学改用固体Na2CO3配制Na2CO3溶液的过程如图所示,其错误

(6)如果固体Na2CO3中混有少量杂质Na2SO4,可按规定程序检测出来。请写出所加的试剂和顺序
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】“84消毒液”能有效杀灭甲型H1N1等病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:4mol/LNaClO溶液,稀释100倍(体积比)后使用。
(1)该“84消毒液”置于空气中生效原理的离子方程式为______
(2)某同学取该稀释后的“84消毒液”用于消毒,稀释后的溶液中c(Na+)=___________ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL4mol/L的NaClO溶液。下列说法正确的是___________ (填字母)。

A.如图所示的仪器中,有三种是不需要的
B.容量瓶用蒸馏水洗净后,不需要烘干,可直接用于溶液配制
C.需要称量NaClO固体的质量为142.8g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.8g·cm-3)的浓硫酸配制100mL物质的量浓度为0.9mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需要用量筒量取___________ mL上述浓硫酸进行配制。
②为配制上述稀硫酸,除了量筒、烧杯、玻璃棒外,还缺少的玻璃仪器是___________ 、___________ 。
③在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是___________ (填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.往容量瓶转移时,有少量液体溅出
e.未洗涤稀释浓硫酸的烧杯
“84消毒液”:4mol/LNaClO溶液,稀释100倍(体积比)后使用。
(1)该“84消毒液”置于空气中生效原理的离子方程式为
(2)某同学取该稀释后的“84消毒液”用于消毒,稀释后的溶液中c(Na+)=
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL4mol/L的NaClO溶液。下列说法正确的是

A.如图所示的仪器中,有三种是不需要的
B.容量瓶用蒸馏水洗净后,不需要烘干,可直接用于溶液配制
C.需要称量NaClO固体的质量为142.8g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.8g·cm-3)的浓硫酸配制100mL物质的量浓度为0.9mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需要用量筒量取
②为配制上述稀硫酸,除了量筒、烧杯、玻璃棒外,还缺少的玻璃仪器是
③在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.往容量瓶转移时,有少量液体溅出
e.未洗涤稀释浓硫酸的烧杯
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】实验室需要配制 的硫酸溶液500mL。请回答下列问题:
的硫酸溶液500mL。请回答下列问题:
(1)根据计算得,需量取质量分数为98%、密度为 的浓硫酸的体积为
的浓硫酸的体积为_______ mL(保留三位有效数字)。
(2)在如图所示仪器中,配制上述溶液肯定不需要的有_______ (填序号)。

(3)实验操作步骤包括
A.把溶液小心地转移至容量瓶中。
B.量取所需浓硫酸,沿杯壁倒入盛有适量水的烧杯中,同时用玻璃棒搅拌并冷却至室温。
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为_______ (填序号)。
(4)下列情况中,会使所配溶液浓度偏高的是_______ (填序号)。
A.量取浓硫酸时,某同学仰视液面读数
B.没有进行上述的操作步骤D
C.定容加蒸馏水时,不慎超过了刻度线
D.容量瓶使用前内壁沾有水珠
E.用少量蒸馏水洗涤量取浓硫酸后的量筒,并将洗涤液注入烧杯
 的硫酸溶液500mL。请回答下列问题:
的硫酸溶液500mL。请回答下列问题:(1)根据计算得,需量取质量分数为98%、密度为
 的浓硫酸的体积为
的浓硫酸的体积为(2)在如图所示仪器中,配制上述溶液肯定不需要的有

(3)实验操作步骤包括
A.把溶液小心地转移至容量瓶中。
B.量取所需浓硫酸,沿杯壁倒入盛有适量水的烧杯中,同时用玻璃棒搅拌并冷却至室温。
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为
(4)下列情况中,会使所配溶液浓度偏高的是
A.量取浓硫酸时,某同学仰视液面读数
B.没有进行上述的操作步骤D
C.定容加蒸馏水时,不慎超过了刻度线
D.容量瓶使用前内壁沾有水珠
E.用少量蒸馏水洗涤量取浓硫酸后的量筒,并将洗涤液注入烧杯
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】下图是硫酸试剂瓶标签上的内容:

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL 4.6mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__________ (填仪器名称);需要量取98%浓硫酸____________ mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是( ) 。
A. e→a→f→d→c→f→g→b B. e→a→d→f→c→f→g→b
C. e→a→f→d→c→f→b→g D. e→a→d→f→c→f→b→g
(3)下列为配制过程中部分操作的示意图,其中有错误的是____ (填序号);
(4)在配制4.6mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏高的是___ ;
A.未经冷却趁热将溶液注入容量瓶中 B.容量瓶洗涤后,未干燥处理
C.定容时仰视观察液面 D.未洗涤烧杯和玻璃棒
(5)为中和100mL 2.3 mol·L-1KOH溶液后显中性,需要加入________ mL 4.6mol·L-1稀硫酸。

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL 4.6mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是
A. e→a→f→d→c→f→g→b B. e→a→d→f→c→f→g→b
C. e→a→f→d→c→f→b→g D. e→a→d→f→c→f→b→g
(3)下列为配制过程中部分操作的示意图,其中有错误的是
(4)在配制4.6mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏高的是
A.未经冷却趁热将溶液注入容量瓶中 B.容量瓶洗涤后,未干燥处理
C.定容时仰视观察液面 D.未洗涤烧杯和玻璃棒
(5)为中和100mL 2.3 mol·L-1KOH溶液后显中性,需要加入
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】Ⅰ.实验是化学研究的一种重要手段,现有下图所示A~G七种仪器,请根据要求填空。

(1)写出仪器名称:E_____________ ,F_____________ 。
(2)下列实验操作中用到仪器D的是_________ (选填下列选项的编号字母 )。
A.分离水和CCl4的混合物 B.分离水和酒精的混合物 C.分离水和泥砂的混合物
Ⅱ.某课外兴趣小组需要200 mL1 mol/L的Na2CO3溶液,请回答下列问题:
(1)配制溶液所需仪器及药品:
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只能用一次)______________ 。
A.将已冷却的溶液沿玻璃棒注入容量瓶中
B.用托盘天平准确称量所需Na2CO3的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C.用适量水洗涤烧杯2~3次,洗涤液均注入容量瓶中,振荡
D.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E.将容量瓶盖紧,振荡,摇匀
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响 (填“偏高”、“偏低”或“无影响”)?
没有进行C操作________ ;配制溶液时,容量瓶未干燥_________ ;定容时俯视刻度线_________ 。

(1)写出仪器名称:E
(2)下列实验操作中用到仪器D的是
A.分离水和CCl4的混合物 B.分离水和酒精的混合物 C.分离水和泥砂的混合物
Ⅱ.某课外兴趣小组需要200 mL1 mol/L的Na2CO3溶液,请回答下列问题:
(1)配制溶液所需仪器及药品:
| 应称取Na2CO3的质量 | 应选用容量瓶的规格 | 除容量瓶外还需要的其它玻璃仪器是上图中的 |
A.将已冷却的溶液沿玻璃棒注入容量瓶中
B.用托盘天平准确称量所需Na2CO3的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C.用适量水洗涤烧杯2~3次,洗涤液均注入容量瓶中,振荡
D.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E.将容量瓶盖紧,振荡,摇匀
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响 (填“偏高”、“偏低”或“无影响”)?
没有进行C操作
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】现需配制0.1mol·L-1NaOH溶液480mL,根据此,回答下列问题:
(1)配制氢氧化钠溶液需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、和___________________________________________ 。
(2)实验时需要托盘天平称量氢氧化钠____________ g;
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)__________ 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液冷却室温后,沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)配制0.1 mol· L-1NaOH溶液的实验中,如果出现以下操作,会导致配制溶液的浓度偏大的有___________ (填写字母)。
A.称量时用了生锈的砝码
B.未洗涤溶解NaOH的烧杯
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.容量瓶未干燥即用来配制溶液
E.定容时仰视刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(1)配制氢氧化钠溶液需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、和
(2)实验时需要托盘天平称量氢氧化钠
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液冷却室温后,沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)配制0.1 mol· L-1NaOH溶液的实验中,如果出现以下操作,会导致配制溶液的浓度偏大的有
A.称量时用了生锈的砝码
B.未洗涤溶解NaOH的烧杯
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.容量瓶未干燥即用来配制溶液
E.定容时仰视刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
您最近一年使用:0次



