溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr的实验步骤如下:
步骤1.在如图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。

步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤。
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去其中水中的______________ (写化学式)。
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为_______________ ;
②控制反应在60℃进行,实验中可采取的措施是_____________ ;
③说明反应已完成的现象是__________________ 。
(3)步骤2过滤需要避光的原因是_______________ 。

(4)步骤3中洗涤剂需“溶有SO2”的原因是_____________________ 最后溶剂改用乙醚的目的是________________________________ 。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。请补充实验步骤【须用到 SO2(贮存在钢瓶中)、20%NaOH溶液、乙醇】
①_______________________________________________ 。
②__________________________________________________ 。
③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶。
④__________________________________________________ 。
⑤放真空干燥箱中干燥。
步骤1.在如图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。

步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤。
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去其中水中的
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为
②控制反应在60℃进行,实验中可采取的措施是
③说明反应已完成的现象是
(3)步骤2过滤需要避光的原因是

(4)步骤3中洗涤剂需“溶有SO2”的原因是
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。请补充实验步骤【
①
②
③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶。
④
⑤放真空干燥箱中干燥。
更新时间:2020-03-21 12:53:21
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
(1)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,甲同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :
①实验结论是_______ 。
②实验Ⅲ的目的是_______ 。
(2)为分析不同微粒对H2O2分解的催化作用,乙同学向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:
结合实验(1)的Ⅲ,实验(2)可得出的结论是_______ 。
(3)丙同学对实验中Fe3+催化H2O2分解反应的机理产生了兴趣。查阅资料:Fe3+催化H2O2分解反应时发生了两步氧化还原反应:
i.2Fe3++H2O2 = 2Fe2++O2↑+2H+ ;ⅱ.……
①ii的离子方程式是_______ 。
②该小组同学利用下列实验方案了证实上述催化过程。请将实验方案补充完整。
a.取2 mL 5%H2O2溶液于试管中,滴加5滴0.1mol/L FeCl3溶液,充分振荡,迅速产生气泡,_______ ,证明反应ⅰ的发生。
b.另取2mL 5%H2O2溶液于试管中,滴加_______ ,证明反应ⅱ的发生。
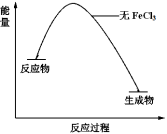
③H2O2溶液中无FeCl3时“反应过程—能量”示意图如图所示,请在图中画出H2O2溶液中加入FeCl3后,对应的“反应过程—能量”图__________ 。
(1)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,甲同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1mol/LFeCl3 | 5滴0.1mol/L CuCl2 | 5滴0.3 mol/LNaCl |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
②实验Ⅲ的目的是
(2)为分析不同微粒对H2O2分解的催化作用,乙同学向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:
试管 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
滴加试剂 | 2滴1mol/L Na2SO4 | 2滴1mol/L CuSO4 | 2滴1mol/L CuSO4和2滴1mol/L NaCl | 2滴1mol/L CuSO4和4滴1mol/L NaCl |
产生气泡情况 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅱ到Ⅳ依次加快 | ||
(3)丙同学对实验中Fe3+催化H2O2分解反应的机理产生了兴趣。查阅资料:Fe3+催化H2O2分解反应时发生了两步氧化还原反应:
i.2Fe3++H2O2 = 2Fe2++O2↑+2H+ ;ⅱ.……
①ii的离子方程式是
②该小组同学利用下列实验方案了证实上述催化过程。请将实验方案补充完整。
a.取2 mL 5%H2O2溶液于试管中,滴加5滴0.1mol/L FeCl3溶液,充分振荡,迅速产生气泡,
b.另取2mL 5%H2O2溶液于试管中,滴加
③H2O2溶液中无FeCl3时“反应过程—能量”示意图如图所示,请在图中画出H2O2溶液中加入FeCl3后,对应的“反应过程—能量”图

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某小组同学探究影响H2O2分解反应速率的因素。
(1)在MnO2作催化剂的条件下,H2O2发生分解反应的化学方程式为___ 。
【实验方案】
(2)对比实验①和实验②,目的是探究___ 对H2O2分解反应速率的影响。
(3)对比实验②和实验③,目的是探究H2O2溶液的浓度对H2O2分解反应速率的影响,则实验③中x是___ (填字母)。
a.15 b.30
【实验过程及分析】
在恒温恒容的密闭容器中完成以上实验,测量反应过程中容器内的气体压强随时间的变化,实验数据如图所示。___ 。
(1)在MnO2作催化剂的条件下,H2O2发生分解反应的化学方程式为
【实验方案】
| 实验编号 | H2O2溶液 | 蒸馏水 | 催化剂 | 温度/℃ | |
| c(mol·L-1) | V/mL | V/mL | |||
| ① | 3 | 10 | 20 | 无催化剂 | 20 |
| ② | 3 | 10 | 20 | 0.5gMnO2固体 | 20 |
| ③ | 3 | 15 | x | 0.5gMnO2固体 | 20 |
(3)对比实验②和实验③,目的是探究H2O2溶液的浓度对H2O2分解反应速率的影响,则实验③中x是
a.15 b.30
【实验过程及分析】
在恒温恒容的密闭容器中完成以上实验,测量反应过程中容器内的气体压强随时间的变化,实验数据如图所示。

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某化学课外小组的同学通过实验探究认识化学反应速率和化学反应限度。
I.实验一:探究温度和浓度对反应速率的影响。
实验原理及方案:在酸性溶液中,碘酸钾( )和亚硫酸钠可发生反应生成碘,反应原理是
)和亚硫酸钠可发生反应生成碘,反应原理是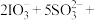
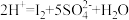 ,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。实验出现蓝
,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。实验出现蓝
(1)则
_______ mL,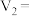
_______ mL。
Ⅱ.实验二:探究KI和 混合时生成KCl、I2和
混合时生成KCl、I2和 的反应存在一定的限度。
的反应存在一定的限度。
实验原理: 。
。
实验步骤:向5mL 0.1 KI溶液中滴加5~6滴0.1
KI溶液中滴加5~6滴0.1
 溶液,充分反应后,将所得溶液分成甲、乙、丙三等份。
溶液,充分反应后,将所得溶液分成甲、乙、丙三等份。
(2)向甲中滴加 ,充分振荡、静置,下层溶液出现紫红色,说明有
,充分振荡、静置,下层溶液出现紫红色,说明有 生成;向乙中滴加试剂
生成;向乙中滴加试剂_______ ,若现象为_______ ,则说明该反应有一定的限度。
Ⅲ.800℃时A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图,分析图像回答问题:

(3)该反应的化学方程式为_______ 。
(4)2min内,用C来表示的化学反应速率为_______ 。
(5)在其他条件下,测得A的反应速率为0.05 ,此时的反应与800℃时相比,
,此时的反应与800℃时相比,_______ (填字母)。
A.比800℃时快B.比800℃时慢C.和800℃时速率一样
I.实验一:探究温度和浓度对反应速率的影响。
实验原理及方案:在酸性溶液中,碘酸钾(
 )和亚硫酸钠可发生反应生成碘,反应原理是
)和亚硫酸钠可发生反应生成碘,反应原理是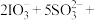
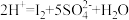 ,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。实验出现蓝
,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。实验出现蓝| 实验序号 | 0.01  酸性溶液(含淀粉)的体积/mL 酸性溶液(含淀粉)的体积/mL | 0.01  溶液的体积/mL 溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
| ① | 5 | 5 |  | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 |  | 35 | 25 |

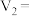
Ⅱ.实验二:探究KI和
 混合时生成KCl、I2和
混合时生成KCl、I2和 的反应存在一定的限度。
的反应存在一定的限度。实验原理:
 。
。实验步骤:向5mL 0.1
 KI溶液中滴加5~6滴0.1
KI溶液中滴加5~6滴0.1
 溶液,充分反应后,将所得溶液分成甲、乙、丙三等份。
溶液,充分反应后,将所得溶液分成甲、乙、丙三等份。(2)向甲中滴加
 ,充分振荡、静置,下层溶液出现紫红色,说明有
,充分振荡、静置,下层溶液出现紫红色,说明有 生成;向乙中滴加试剂
生成;向乙中滴加试剂Ⅲ.800℃时A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图,分析图像回答问题:

(3)该反应的化学方程式为
(4)2min内,用C来表示的化学反应速率为
(5)在其他条件下,测得A的反应速率为0.05
 ,此时的反应与800℃时相比,
,此时的反应与800℃时相比,A.比800℃时快B.比800℃时慢C.和800℃时速率一样
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题。
Ⅰ.钠是一种非常活泼、具有广泛应用的金属。请回答:
(1)将一小块金属钠投入水中,可观察到的实验现象是有:钠浮在水面,熔成小球,四处游动,有嘶嘶声,若滴加酚酞,溶液变红,写出发生反应的化学方程式___________ 。
(2)用金属钠制取氧化钠通常利用 ,而不是钠与氧气的反应,是因为产物中只有
,而不是钠与氧气的反应,是因为产物中只有 固体生成,且
固体生成,且___________ 。
Ⅱ.现有含有 杂质的
杂质的 样品,用如图所示实验装置测定
样品,用如图所示实验装置测定 样品的纯度。(可供选用的反应物有
样品的纯度。(可供选用的反应物有 固体、盐酸、稀硫酸和蒸馏水)
固体、盐酸、稀硫酸和蒸馏水)

(3)装置 中反应的化学方程式是
中反应的化学方程式是___________ 。
(4)装置 中碱石灰的作用是
中碱石灰的作用是___________ 。
(5)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后中液面的读数并求其差值的过程中,需要待恢复室温后,___________ ,且视线与凹液面最低处相平才能读数。
(6)若开始时测得样品的质量为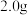 ,反应结束后测得气体体积(折合为标准状况)为
,反应结束后测得气体体积(折合为标准状况)为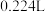 ,则
,则 试样的纯度为
试样的纯度为___________ 。
Ⅰ.钠是一种非常活泼、具有广泛应用的金属。请回答:
(1)将一小块金属钠投入水中,可观察到的实验现象是有:钠浮在水面,熔成小球,四处游动,有嘶嘶声,若滴加酚酞,溶液变红,写出发生反应的化学方程式
(2)用金属钠制取氧化钠通常利用
 ,而不是钠与氧气的反应,是因为产物中只有
,而不是钠与氧气的反应,是因为产物中只有 固体生成,且
固体生成,且Ⅱ.现有含有
 杂质的
杂质的 样品,用如图所示实验装置测定
样品,用如图所示实验装置测定 样品的纯度。(可供选用的反应物有
样品的纯度。(可供选用的反应物有 固体、盐酸、稀硫酸和蒸馏水)
固体、盐酸、稀硫酸和蒸馏水)
(3)装置
 中反应的化学方程式是
中反应的化学方程式是(4)装置
 中碱石灰的作用是
中碱石灰的作用是(5)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后中液面的读数并求其差值的过程中,需要待恢复室温后,
(6)若开始时测得样品的质量为
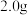 ,反应结束后测得气体体积(折合为标准状况)为
,反应结束后测得气体体积(折合为标准状况)为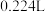 ,则
,则 试样的纯度为
试样的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】实验室里除了用二氧化锰和浓盐酸加热制取氯气,也可以在常温下利用反应:
制取并收集纯净、干燥的氯气,装置如图所示:

(1)装置A中盛放浓盐酸的仪器名称是_______ ,该装置相比普通分液漏斗的优点是_______ 。
(2)装置B的作用是_______ ,装置C中盛装的药品是_______ 。
(3)D装置收集氯气采用了方法_______。(填序号)
(4)装置E中发生反应的化学方程式是_______ 。
(5)工业上制备氯气通常利用反应_______ (填化学方程式),阴极的产物是_______ 。

制取并收集纯净、干燥的氯气,装置如图所示:

(1)装置A中盛放浓盐酸的仪器名称是
(2)装置B的作用是
(3)D装置收集氯气采用了方法_______。(填序号)
| A.向下排空气法 | B.向上排空气法 | C.排水法 | D.排饱和食盐水 |
(5)工业上制备氯气通常利用反应
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】 具有较强的氧化性,常用于医药、印染、漂白等领域。某化学兴趣小组探究
具有较强的氧化性,常用于医药、印染、漂白等领域。某化学兴趣小组探究 与
与 反应的产物成分。
反应的产物成分。
(1)实验室用70%的硫酸溶液与亚硫酸钠反应制备 ,该反应的化学方程式为
,该反应的化学方程式为___________ ,最适宜的发生装置是___________ (填标号)。

(2)甲同学认为 与
与 的反应类似
的反应类似 与
与 的反应,而乙同学认为
的反应,而乙同学认为 与
与 反应会生成
反应会生成 ,按照甲同学的猜想,该反应的化学方程式应为
,按照甲同学的猜想,该反应的化学方程式应为___________ 。
(3)丙同学按照如下实验步骤探究 与
与 的反应:将电脑、数据采集器、氧气传感器依次相连(如图1),用三颈烧瓶收集干燥纯净的
的反应:将电脑、数据采集器、氧气传感器依次相连(如图1),用三颈烧瓶收集干燥纯净的 ,将氧气传感器塞入三颈烧瓶中间接口,用药匙取少量
,将氧气传感器塞入三颈烧瓶中间接口,用药匙取少量 从右端加入三颈烧瓶中,迅速塞紧瓶塞,电脑上采集到的三颈烧瓶内氧气含量随时间变化的数据如图2所示。
从右端加入三颈烧瓶中,迅速塞紧瓶塞,电脑上采集到的三颈烧瓶内氧气含量随时间变化的数据如图2所示。
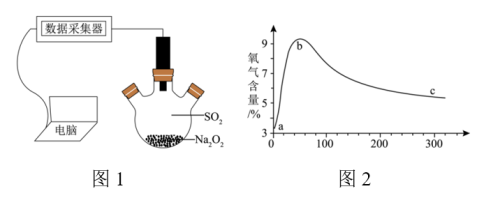
①上述实验___________ (填“能”或“不能”)说明 与
与 反应有
反应有 产生。
产生。
②分析图2中氧气含量变化趋势并解释该变化可能的原因___________ 。
③请设计实验,证明上述实验后所得的固体产物中存在 :
:___________ 。
 具有较强的氧化性,常用于医药、印染、漂白等领域。某化学兴趣小组探究
具有较强的氧化性,常用于医药、印染、漂白等领域。某化学兴趣小组探究 与
与 反应的产物成分。
反应的产物成分。(1)实验室用70%的硫酸溶液与亚硫酸钠反应制备
 ,该反应的化学方程式为
,该反应的化学方程式为
(2)甲同学认为
 与
与 的反应类似
的反应类似 与
与 的反应,而乙同学认为
的反应,而乙同学认为 与
与 反应会生成
反应会生成 ,按照甲同学的猜想,该反应的化学方程式应为
,按照甲同学的猜想,该反应的化学方程式应为(3)丙同学按照如下实验步骤探究
 与
与 的反应:将电脑、数据采集器、氧气传感器依次相连(如图1),用三颈烧瓶收集干燥纯净的
的反应:将电脑、数据采集器、氧气传感器依次相连(如图1),用三颈烧瓶收集干燥纯净的 ,将氧气传感器塞入三颈烧瓶中间接口,用药匙取少量
,将氧气传感器塞入三颈烧瓶中间接口,用药匙取少量 从右端加入三颈烧瓶中,迅速塞紧瓶塞,电脑上采集到的三颈烧瓶内氧气含量随时间变化的数据如图2所示。
从右端加入三颈烧瓶中,迅速塞紧瓶塞,电脑上采集到的三颈烧瓶内氧气含量随时间变化的数据如图2所示。
①上述实验
 与
与 反应有
反应有 产生。
产生。②分析图2中氧气含量变化趋势并解释该变化可能的原因
③请设计实验,证明上述实验后所得的固体产物中存在
 :
:
您最近一年使用:0次



