“五一”假期,聪聪同学和家人到安徽省博物馆去参观,发现博物馆内许多铜制品表面有一层绿色物质。绿色物质是什么?它是怎样形成的?化学活动课上,同学们设计实验对这种绿色物质进行了如下探究活动。
【查阅资料】
①铜在空气中易生成铜锈,它为绿色,其主要成分是Cu2(OH)2CO3;
②白色的硫酸铜粉末遇水能变为蓝色。
探究活动一:验证铜锈的组成。
【进行实验1】
同学们设计了如图所示装置并进行实验。

探究活动二:探究铜生锈的条件。
【进行实验2】
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。
【实验结论】铜生锈的条件是_____ 。
【反思与拓展】
(1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其目的是_____ 。
(2)如果要除去铜制品表面的铜锈,可以用稀盐酸浸泡,写出反应的化学方程式_____ 。
【查阅资料】
①铜在空气中易生成铜锈,它为绿色,其主要成分是Cu2(OH)2CO3;
②白色的硫酸铜粉末遇水能变为蓝色。
探究活动一:验证铜锈的组成。
【进行实验1】
同学们设计了如图所示装置并进行实验。

| 实验操作 | 实验现象 | 实验结论 |
| ①按如图组装仪器,装入药品。 ②加热铜锈,直至不再有气体产生,停止加热 | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊 | 加热铜锈生成的物质有 |
| ③冷却后,向试管中固体加入适量稀硫酸,稍加热 | 黑色固体溶解,溶液变为蓝色 | 发生反应的化学方程式为: |
探究活动二:探究铜生锈的条件。
【进行实验2】
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。
| 序号 | 实验1 | 实验2 | 实验3 | 实验4 |
| 实验内容 | 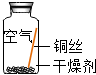 | 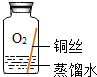 |  | 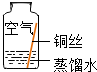 |
| 实验现象 | 在干燥环境中,铜不生锈 | 铜仅与氧气和水接触,不生锈 | 铜仅与二氧化碳和水接触,不生锈 | 铜生锈 |
【实验结论】铜生锈的条件是
【反思与拓展】
(1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其目的是
(2)如果要除去铜制品表面的铜锈,可以用稀盐酸浸泡,写出反应的化学方程式
更新时间:2020-04-24 10:50:45
|
相似题推荐
【推荐1】青竹湖湘一化学兴趣小组同学取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂(如图所示),打开瓶盖看到原本粉末状生石灰已经部分结块变得较为坚硬。

该兴趣小组的同学经过讨论后认为生石灰长时间放置后吸收了空气中的_________ (填物质的化学式)变质结块才导致体积膨胀使塑料试剂瓶破裂。
同学们对变质后产生的物质产生了浓厚的探究兴趣。小青同学提出试剂瓶中最多只有两种固体,小竹同学提出了不同意见。小组同学经过讨论后一致同意小竹同学的意见,变质后的固体中还可能存在_______ (填物质的化学式)。该兴趣小组同学设计了如下实验证明上述物质是否存在。
I.小青同学从破裂的塑料试剂瓶中取少量固体样品,放在研钵中研碎,取部分研碎后的粉末倒入烧杯中,再加入100mL20℃的蒸馏水,充分搅拌,马上用温度计测得温度____ 20℃,证明了第三种物质的存在。
II.小竹同学另取少量研碎后的粉末倒入烧杯中,加入足量的水充分溶解,烧杯中仍然有较多的浑浊物,小竹得出原破裂的塑料试剂瓶中存在CaCO3,接着小竹将烧杯内的混合物过滤,再往得到的澄清的滤液中通入CO2,发现澄清的滤液变浑浊,小竹得出原破裂的塑料试剂瓶中还存在Ca(OH)2,小湖同学否定了小竹同学的部分结论,理由是________ 。
小湖同学设计了下图1所示实验装置探究破裂的塑料试剂瓶内所含固体中CaCO3的质量分数(氢氧化钠能吸收二氧化碳,浓硫酸能吸收水,稀盐酸的挥发性不考虑,各种试剂均足量)。

【实验步骤】①检查装置的气密性。写出检查装置B(上图2所示)的气密性的方法____ (可适当添加其他仪器或实验用品)。
②称取m1克破裂塑料试剂瓶内固体样品加入锥形瓶中,从左侧缓缓通入一段时间空气。再称取装置D的初始质量为m2克。
③打开分液漏斗活塞,缓缓将稀盐酸滴入,直到B装置中不再产生气泡,称量装置D的最终质量为m3克
④计算:反应生成的二氧化碳的质量为m3-m2克,通过化学方程式计算得到样品中碳酸钙的质量,最终计算出样品中碳酸钙的质量分数。
老师指出小湖的实验中碳酸钙的质量分数测定不准确。请你提出改进方法____ 。

该兴趣小组的同学经过讨论后认为生石灰长时间放置后吸收了空气中的
同学们对变质后产生的物质产生了浓厚的探究兴趣。小青同学提出试剂瓶中最多只有两种固体,小竹同学提出了不同意见。小组同学经过讨论后一致同意小竹同学的意见,变质后的固体中还可能存在
I.小青同学从破裂的塑料试剂瓶中取少量固体样品,放在研钵中研碎,取部分研碎后的粉末倒入烧杯中,再加入100mL20℃的蒸馏水,充分搅拌,马上用温度计测得温度
II.小竹同学另取少量研碎后的粉末倒入烧杯中,加入足量的水充分溶解,烧杯中仍然有较多的浑浊物,小竹得出原破裂的塑料试剂瓶中存在CaCO3,接着小竹将烧杯内的混合物过滤,再往得到的澄清的滤液中通入CO2,发现澄清的滤液变浑浊,小竹得出原破裂的塑料试剂瓶中还存在Ca(OH)2,小湖同学否定了小竹同学的部分结论,理由是
小湖同学设计了下图1所示实验装置探究破裂的塑料试剂瓶内所含固体中CaCO3的质量分数(氢氧化钠能吸收二氧化碳,浓硫酸能吸收水,稀盐酸的挥发性不考虑,各种试剂均足量)。

【实验步骤】①检查装置的气密性。写出检查装置B(上图2所示)的气密性的方法
②称取m1克破裂塑料试剂瓶内固体样品加入锥形瓶中,从左侧缓缓通入一段时间空气。再称取装置D的初始质量为m2克。
③打开分液漏斗活塞,缓缓将稀盐酸滴入,直到B装置中不再产生气泡,称量装置D的最终质量为m3克
④计算:反应生成的二氧化碳的质量为m3-m2克,通过化学方程式计算得到样品中碳酸钙的质量,最终计算出样品中碳酸钙的质量分数。
老师指出小湖的实验中碳酸钙的质量分数测定不准确。请你提出改进方法
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O).老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
【提出问题】①该瓶溶液中溶质的成分是什么?②该瓶溶液中亚硫酸钠的质量分数是多少?
【查阅资料】
(1)Na2SO3有较强还原性,在空气中易被氧气氧化:2Na2SO3+O2=2Na2SO4;(2)Na2SO3能与酸反应产生SO2气体;
(3)SO32-、SO42-均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
【作出猜想】
猜想1没有变质,成分是Na2SO3;猜想2完全变质,成分是Na2SO4;
你认为还可能有的猜想3______ 。
【实验探究I】甲、乙两组分别进行实验探究溶液是否变质:
【评价】有同学质疑甲组方案不合理,理由是______ 。
【实验探究Ⅱ】
甲组设计如下实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)
(1)连好装置并检查装置气密性,在锥形瓶中放入126g该样品;
(2)实验前称量C装置的质量;
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
(4)打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
(5)再次称量C装置的质量发现比反应前增重6.4g;

D装置的作用为______ 。计算出该溶液中Na2SO3的质量分数为______ 。
【解释】若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际的______ (填“偏小”或”偏大”)。
【反思】由此可得出,保存亚硫酸钠时应______ 。
【提出问题】①该瓶溶液中溶质的成分是什么?②该瓶溶液中亚硫酸钠的质量分数是多少?
【查阅资料】
(1)Na2SO3有较强还原性,在空气中易被氧气氧化:2Na2SO3+O2=2Na2SO4;(2)Na2SO3能与酸反应产生SO2气体;
(3)SO32-、SO42-均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
【作出猜想】
猜想1没有变质,成分是Na2SO3;猜想2完全变质,成分是Na2SO4;
你认为还可能有的猜想3
【实验探究I】甲、乙两组分别进行实验探究溶液是否变质:
| 小组 | 实验操作 | 现象 | 结论 |
| 甲组 | 取少量样品于试管中加入过量稀盐酸 | 产生气泡 | 没有变质,还是Na2SO3 |
| 乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸 | 已部分变质 |
【评价】有同学质疑甲组方案不合理,理由是
【实验探究Ⅱ】
甲组设计如下实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)
(1)连好装置并检查装置气密性,在锥形瓶中放入126g该样品;
(2)实验前称量C装置的质量;
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
(4)打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
(5)再次称量C装置的质量发现比反应前增重6.4g;

D装置的作用为
【解释】若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际的
【反思】由此可得出,保存亚硫酸钠时应
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐3】某化学活动小组的同学在一次实验中进行如图所示实验。
【观察与表达】U形管左侧有白色沉淀生成,右侧产生的现象是________ 。

实验后,小组同学用胶塞塞紧U形管两端,充分振荡,发现管内仍有白色固体残留。将混合物过滤后,同学们对滤液中溶质的成分产生了兴趣,于是继续进行探究。
【提出问题】滤液中可能含有哪些溶质?
【猜想与假设】同学们讨论后指出,滤液中的溶质一定有NaCl,还可能有BaCl2、HCl和Na2CO3中的一种或多种。
【分析与交流】
(1)小红指出,滤液中不可能同时含有BaCl2和Na2CO3理由是________ (用化学方程式解释)。
(2)小兰指出,振荡后U形管内的白色固体一定是_______ (填化学式),故滤液中溶质一定不含HCl。
【实验探究】为探究滤液中的溶质,同学们设计了如下实验。
【反思评价】老师指出,小兰组的实验不能得出相应的实验结论,理由是_________ 。
【观察与表达】U形管左侧有白色沉淀生成,右侧产生的现象是

实验后,小组同学用胶塞塞紧U形管两端,充分振荡,发现管内仍有白色固体残留。将混合物过滤后,同学们对滤液中溶质的成分产生了兴趣,于是继续进行探究。
【提出问题】滤液中可能含有哪些溶质?
【猜想与假设】同学们讨论后指出,滤液中的溶质一定有NaCl,还可能有BaCl2、HCl和Na2CO3中的一种或多种。
【分析与交流】
(1)小红指出,滤液中不可能同时含有BaCl2和Na2CO3理由是
(2)小兰指出,振荡后U形管内的白色固体一定是
【实验探究】为探究滤液中的溶质,同学们设计了如下实验。
| 实验方案 | 实验现象 | 实验结论 | |
| 小兰组 | 取少量滤液于试管中,加入足量AgNO3溶液和稀硝酸 | 产生 | 滤液中的溶质只含有NaCl |
| 小红组 | 取少量滤液于试管中,加入足量 | 无明显现象 |
您最近一年使用:0次
科学探究题
|
较难
(0.4)
【推荐1】某化学兴趣小组对铜器表面生成的绿色铜锈展开如下探究,请回答有关问题.
(1)探究铜锈的组成.
【实验过程】
实验一:
实验二:另取少量铜锈隔绝空气加热,发现绿色粉末变黑色,试管壁上有水珠.
【实验结论】综合以上两实验,可以确认铜锈中含有_____ 种元素.
(2)探究铜生锈的条件.
【猜想】同学们对空气中有哪些物质参与了铜的生锈作出以下三种猜想:①CO2、H2O ②O2、H2O ③CO2、H2O、O2
根据铜锈的组成元素并结合铁生锈的知识,你认为上述猜想错误的是_____ (填序号).
【实验设计】为验证另外两种猜想,同学们设计了下图中A、B两个对比实验,请你在方框内完成实验B的设计.(语言叙述或画图说明均可)_____ .

【预计结论】若A中的铜生锈,B中的铜不生锈,则正确的猜想是_____ (填序号).
(1)探究铜锈的组成.
【实验过程】
实验一:
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量铜锈于试管中,加入适量稀硫酸 | 固体溶解,产生气泡,溶液呈 | 铜锈中含有Cu2+ |
| b.将生成气体通入 | 铜锈中含有CO32﹣ |
实验二:另取少量铜锈隔绝空气加热,发现绿色粉末变黑色,试管壁上有水珠.
【实验结论】综合以上两实验,可以确认铜锈中含有
(2)探究铜生锈的条件.
【猜想】同学们对空气中有哪些物质参与了铜的生锈作出以下三种猜想:①CO2、H2O ②O2、H2O ③CO2、H2O、O2
根据铜锈的组成元素并结合铁生锈的知识,你认为上述猜想错误的是
【实验设计】为验证另外两种猜想,同学们设计了下图中A、B两个对比实验,请你在方框内完成实验B的设计.(语言叙述或画图说明均可)

【预计结论】若A中的铜生锈,B中的铜不生锈,则正确的猜想是
您最近一年使用:0次
【推荐2】铜片在潮湿的空气中久置,表面会产生绿色的铜锈。某小组同学设计并进行实验,探究铜生锈的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与铜片接触的物质,利用如图装置(铜片长度为3 cm,试管容积为20 mL)分别进行下列5个实验,并持续观察30天。

【解释与结论】
(1)实验中,NaOH浓溶液的作用是________ (用化学方程式表示)。
(2)实验1的目的是________ 。
(3)实验2中,试管内的气体主要含有CO2、________ 。
(4)得出“铜生锈一定与H2O有关”的结论,依据的两个实验是________ (填编号)。
(5)由上述实验可推知,铜片生锈的条件是________ 。
【反思与评价】
(6)在猜想与假设时,同学们认为铜生锈与N2无关,其理由是________ 。
(7)兴趣小组的同学认为不需进行上述实验,他们向铜锈中加入稀盐酸并把的气体通入澄清的石灰水变浑浊,即可得出铜生锈与空气中的二氧化碳有关。他们的依据是________ 。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与铜片接触的物质,利用如图装置(铜片长度为3 cm,试管容积为20 mL)分别进行下列5个实验,并持续观察30天。

| 编号 | 主要实验操作 | 实验现象 |
| 1 | 先充满用NaOH浓溶液洗涤过的空气 再加入2 mL浓硫酸 | 铜片始终无明显变化 |
| 2 | 先加入4 mL饱和Na2SO3溶液 再充满CO2 | 铜片始终无明显变化 |
| 3 | 加入2 mL NaOH浓溶液 | 铜片始终无明显变化 |
| 4 | 先加入2 mL浓硫酸 再通入约4 mL CO2 | 铜片始终无明显变化 |
| 5 | 先加入2 mL蒸馏水 再通入约4 mL CO2 | 铜片表面变成绿色 |
(1)实验中,NaOH浓溶液的作用是
(2)实验1的目的是
(3)实验2中,试管内的气体主要含有CO2、
(4)得出“铜生锈一定与H2O有关”的结论,依据的两个实验是
(5)由上述实验可推知,铜片生锈的条件是
【反思与评价】
(6)在猜想与假设时,同学们认为铜生锈与N2无关,其理由是
(7)兴趣小组的同学认为不需进行上述实验,他们向铜锈中加入稀盐酸并把的气体通入澄清的石灰水变浑浊,即可得出铜生锈与空气中的二氧化碳有关。他们的依据是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐3】古文献记载:距今 5000-4000 年我国古代人们已开始冶铸青铜器(图 1)。青铜器表面常会有一层铜锈,对铜锈开展探究活动。

查阅资料:CuSO4+5H2O=CuSO4·5H2O,CuSO4为白色固体,CuSO4·5H2O为蓝色固体
探究 I:探究铜锈的组成
用图 2 所示装置进行实验。观察到澄清石灰水变浑浊,干燥管内白色粉末变为蓝色,试管中固体由绿色变为黑色。
探究Ⅱ:探究铜生锈的条件
在探究Ⅰ的基础上,同学们设计了如图 3 所示的装置。在同一实验室的自然环境中,进行了如下两个实验,回答下列问题:
(1)由探究 I 推测,铜锈中含有的元素有________________________ 。
(2)探究 II 的基本猜想是________________________ 。
(3)由探究 II 推断,防止铜生锈的思路是________________________ 。
(4)在上述探究的基础上,关于铜生锈,你还想继续探究的问题是________________________ 。
(5)针对你提出的问题,验证实验的设计是_____

查阅资料:CuSO4+5H2O=CuSO4·5H2O,CuSO4为白色固体,CuSO4·5H2O为蓝色固体
探究 I:探究铜锈的组成
用图 2 所示装置进行实验。观察到澄清石灰水变浑浊,干燥管内白色粉末变为蓝色,试管中固体由绿色变为黑色。
探究Ⅱ:探究铜生锈的条件
在探究Ⅰ的基础上,同学们设计了如图 3 所示的装置。在同一实验室的自然环境中,进行了如下两个实验,回答下列问题:
| 实验序号 | 甲 | 乙 |
实验操作 | 在 250mL 的集气瓶中装有 100mL 氧气、100mLCO2 和 50 毫升水 | 在250mL 的集气瓶中装有200mLCO2 和50毫升水 |
实验现象 | 第 3 天,出现黑色斑点,之后面积逐渐扩大 并增厚,第 9 天略显绿色 | 无明显现象 |
(2)探究 II 的基本猜想是
(3)由探究 II 推断,防止铜生锈的思路是
(4)在上述探究的基础上,关于铜生锈,你还想继续探究的问题是
(5)针对你提出的问题,验证实验的设计是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐1】像氢气、一氧化碳一样,氨气也有还原性,可以将金属从其氧化物中还原出来,同学们对此问题进行了深入探究。
【制取氨气】
(1)按图甲所示装好药品,其中浓氨水通过________ (填仪器名称)加入锥形瓶。
(2)将浓氨水滴到固体烧碱中,烧碱遇水放出大量的热,使浓氨水中的氨气大量挥发出来,从而得到氨气。固体烧碱还可以改用________ (填一种固体物质名称)。
①氨气还原氧化铜的反应如下: ;若两者反应不充分,还有氧化亚铜(
;若两者反应不充分,还有氧化亚铜( )生成。
)生成。
②氧化亚铜是不溶于水的红色固体,但它能与稀硫酸反应,生成金属铜和一种蓝色的溶液。
【实验探究】同学们按图乙装置,进行氨气的还原性实验。
取一根光亮的铜丝,将其一端绕成螺旋状,另一端插入橡皮塞中。
(3)将螺旋状铜丝放在酒精灯外焰上灼烧至发黑,再趁热插入充满氨气的集气瓶中,并及时塞紧橡皮塞;稍后,黑色的螺旋状铜丝逐渐变为光亮的红色,同时集气瓶内壁出现________ 。
(4)将上一步变红的螺旋状铜丝插入________ 中,观察到________ 现象,说明氨气与氧化铜的反应“不充分”。
【拓展延伸】
(5)进行图乙实验时,要及时封闭集气瓶口,这样做的主要目的是________ 。实验过程中闻到氨味,说明微粒具有________ 。
(6)若将氨气更换为氢气,图乙装置________ (填“不能”或“也能”)进行氢气还原氧化铜实验。
(7)现有铜和氧化亚铜的混合物,通过化学方法可将其全部转化为铜,请用化学方程式表示这一方法:________ 。
【制取氨气】
(1)按图甲所示装好药品,其中浓氨水通过
(2)将浓氨水滴到固体烧碱中,烧碱遇水放出大量的热,使浓氨水中的氨气大量挥发出来,从而得到氨气。固体烧碱还可以改用

①氨气还原氧化铜的反应如下:
 ;若两者反应不充分,还有氧化亚铜(
;若两者反应不充分,还有氧化亚铜( )生成。
)生成。②氧化亚铜是不溶于水的红色固体,但它能与稀硫酸反应,生成金属铜和一种蓝色的溶液。
【实验探究】同学们按图乙装置,进行氨气的还原性实验。
取一根光亮的铜丝,将其一端绕成螺旋状,另一端插入橡皮塞中。
(3)将螺旋状铜丝放在酒精灯外焰上灼烧至发黑,再趁热插入充满氨气的集气瓶中,并及时塞紧橡皮塞;稍后,黑色的螺旋状铜丝逐渐变为光亮的红色,同时集气瓶内壁出现
(4)将上一步变红的螺旋状铜丝插入
【拓展延伸】
(5)进行图乙实验时,要及时封闭集气瓶口,这样做的主要目的是
(6)若将氨气更换为氢气,图乙装置
(7)现有铜和氧化亚铜的混合物,通过化学方法可将其全部转化为铜,请用化学方程式表示这一方法:
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐2】化学兴趣小组的同学在探究碱的化学性质时,完成了如图1所示的两个实验,实验后,小明同学将废液倒入同一废液缸中,发现混合废液浑浊并显红色,请你完成下列问题:

(1)A实验中发生反应的现象为______ ,反应的化学方程式是______ ;
(2)B实验中反应的化学方程式是______ ;
(3)【提出问题】废液中,能使酚酞溶液变红的物质可能是那些呢?
【作出猜想】
猜想一:废液中,能使酚酞溶液变红的物质可能是氢氧化钠;
猜想二:废液中,能使酚酞溶液变红的物质还可能是______ ;
猜想三:废液中,能使酚酞溶液变红的物质还可能是氢氧化钙;
【实验验证】同学们对可能含有的性物质进行确定,取一定量的废液过滤,向滤液中逐滴加入稀盐酸,根据反应现象得到了如图2所示的图象;
【结论】分析图象数据得出,废液中使酚酞溶液变红的物质一定是______ ,一定不是______ ;
【拓展提高】为了使以上废液实现安全排放,你的做法是______ 。

(1)A实验中发生反应的现象为
(2)B实验中反应的化学方程式是
(3)【提出问题】废液中,能使酚酞溶液变红的物质可能是那些呢?
【作出猜想】
猜想一:废液中,能使酚酞溶液变红的物质可能是氢氧化钠;
猜想二:废液中,能使酚酞溶液变红的物质还可能是
猜想三:废液中,能使酚酞溶液变红的物质还可能是氢氧化钙;
【实验验证】同学们对可能含有的性物质进行确定,取一定量的废液过滤,向滤液中逐滴加入稀盐酸,根据反应现象得到了如图2所示的图象;
【结论】分析图象数据得出,废液中使酚酞溶液变红的物质一定是
【拓展提高】为了使以上废液实现安全排放,你的做法是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】化学兴趣小组学习完盐的化学性质后,进行了如下探究实验。

(1)试管甲中发生反应的化学方程式为__________ 。
(2)可说明试管乙中发生反应的现象为__________ 。
(3)试管丙验证了盐能与__________ (填物质类别)反应的这一化学性质。
实验结束后,小组同学将试管甲、乙过滤后的滤液与试管丙中反应后的溶液,倒入同一个废液杯中,静置,得到无色溶液。
【提出问题】无色溶液中溶质成分有哪些?
【分析讨论】经过讨论,同学们一致认为无色溶液中溶质一定含有NaCl,可能含有NaOH、Na2CO3、BaCl2、HCl中的一种或几种。
【实验验证】
【拓展迁移】步骤二中所加溶液需过量的目的是__________ 。

(1)试管甲中发生反应的化学方程式为
(2)可说明试管乙中发生反应的现象为
(3)试管丙验证了盐能与
实验结束后,小组同学将试管甲、乙过滤后的滤液与试管丙中反应后的溶液,倒入同一个废液杯中,静置,得到无色溶液。
【提出问题】无色溶液中溶质成分有哪些?
【分析讨论】经过讨论,同学们一致认为无色溶液中溶质一定含有NaCl,可能含有NaOH、Na2CO3、BaCl2、HCl中的一种或几种。
【实验验证】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤一:取少量无色溶液于试管中,加入足量稀盐酸 | 有气泡产生 | 无色溶液中含有 |
| 步骤二:另取少量无色溶液于试管中,滴加过量 | 产生白色沉淀 | 无色溶液中含有NaOH |
| 步骤三:取步骤二中上层清液,滴加无色酚酞溶液 |
您最近一年使用:0次



