铜及铜的化合物在生产、生活中有着广泛的应用。
(一)铜的广泛应用
(1)我国在西汉时期就有“曾青(硫酸铜)得铁则化为铜”之说,用化学方程式表示其原理:_______ ,该反应的基本反应类型是_______ 。
(二)硫酸铜晶体的制备
工业上用含铜废料(如:碎铜、电缆皮等)。某化学小组的同学提出可以用含铜废料制备硫酸铜晶体(CuSO4·xH2O).主要流程如下:
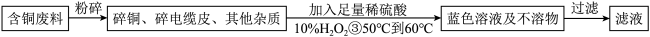
(2)含铜废料粉碎的目的是______ 。
(3)该流程中,加入H2O2后要求温度控制在50℃到60℃加热的原因为______ 。
(4)兴趣小组同学一致指出,将滤液经蒸发浓缩、______ (填结晶方法)、过滤等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体(CuSO4·xH2O),晶体采用酒精淋洗而不用水的原因是______ 。
(三)铜生锈会生成碱式碳酸铜,而工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。
资料:xCuCO3·yCu(OH)2·zH2O加热至200℃时会分解得到氧化铜,二氧化碳和水。
测定某种产品的组成,该兴趣小组准确称量了25.8g的样品,设计了如下装置并进行实验:
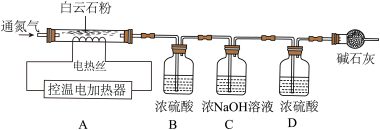
实验数据记录如下表:
实验分析和数据处理
(5)实验前应该先______ ,再鼓入一段时间氮气后称量B、C、D、E的质量。
(6)停止鼓入氮气,调控温电加热220℃持续加热,观察到装置B中______ 时表明碱式碳酸铜已经完全分解。
(7)反应结束后,再缓缓鼓入一段时间氮气的目的是______ 。
(8)该碱式碳酸铜的化学式是_____ 。(写出详细的计算过程)
(一)铜的广泛应用
(1)我国在西汉时期就有“曾青(硫酸铜)得铁则化为铜”之说,用化学方程式表示其原理:
(二)硫酸铜晶体的制备
工业上用含铜废料(如:碎铜、电缆皮等)。某化学小组的同学提出可以用含铜废料制备硫酸铜晶体(CuSO4·xH2O).主要流程如下:
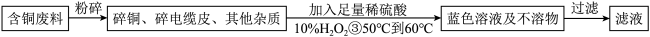
(2)含铜废料粉碎的目的是
(3)该流程中,加入H2O2后要求温度控制在50℃到60℃加热的原因为
(4)兴趣小组同学一致指出,将滤液经蒸发浓缩、
(三)铜生锈会生成碱式碳酸铜,而工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。
资料:xCuCO3·yCu(OH)2·zH2O加热至200℃时会分解得到氧化铜,二氧化碳和水。
测定某种产品的组成,该兴趣小组准确称量了25.8g的样品,设计了如下装置并进行实验:

实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | E中固体质量/g | |
反应前 | 100.0 | 100.0 | 100.0 | 120.5 |
反应后 | 105.4 | 104.2 | 100.2 | 120.5 |
(5)实验前应该先
(6)停止鼓入氮气,调控温电加热220℃持续加热,观察到装置B中
(7)反应结束后,再缓缓鼓入一段时间氮气的目的是
(8)该碱式碳酸铜的化学式是
更新时间:2023-03-17 22:11:02
|
相似题推荐
综合应用题
|
较难
(0.4)
名校
解题方法
【推荐1】能源既是国家经济发展的命脉,也是国家发展战略的重要支柱。氢气被看做是理想的“绿色能源”,氢气的制备及应用是目前的研究热点。
I、氢气的制备
(1)铁酸锌(ZnFe2O4)可用于催化循环分解水制取氢气,其中涉及的反应有:
a: 6ZnFe2O4 6ZnO+4Fe3O4+O2↑ b: 3ZnO+2Fe3O4+H2O
6ZnO+4Fe3O4+O2↑ b: 3ZnO+2Fe3O4+H2O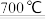 3ZnFe2O4+H2↑
3ZnFe2O4+H2↑
该循环制氢的总化学反应方程式为___________ 。
(2)科学家研发出一种以铝镓合金(镓:Ga)和水为原料制取氢气的新工艺,流程如图1所示:反应①的化学方程式是___________ ,与电解水制取氢气相比,用铝镓合金和水为原料制取氢气的优点是___________ 。(答出一点即可)该流程中可循环利用的物质是___________ 。

(3)利用甲烷(CH4)和水蒸气催化重整制氢,主要在500℃以上发生下列反应:
a:CH4+H2O=CO+3H2; b:CO+H2O=CO2+H2。

①提纯氢气的方法之一是使用金属膜透氢,微观过程如图2所示,从微观角度描述该过程___________ 。
②提纯氢气还可以用CaO作为吸附剂吸收除去CO2.使用一段时间后氧化钙会转化为碳酸钙而失效。失效的吸附剂经煅烧可再次投入使用,但经多次循环后,吸附效果仍会降低。固体结构变化如图3所示,请分析吸附剂效果降低的原因是________ 。
Ⅱ、氢气的储存
(4)储氢金属是一类能够与H2结合呈金属氢化物的材料,如Na可与H2结合生成氢化钠(NaH),氢化钠与水反应可释放出H2,同时生成一种碱,该反应的化学方程式为________ 。
Ⅲ、氢能的应用
(5)利用“活泼金属”可以制得氢气,氢气可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有___________(填字母)。
I、氢气的制备
(1)铁酸锌(ZnFe2O4)可用于催化循环分解水制取氢气,其中涉及的反应有:
a: 6ZnFe2O4
 6ZnO+4Fe3O4+O2↑ b: 3ZnO+2Fe3O4+H2O
6ZnO+4Fe3O4+O2↑ b: 3ZnO+2Fe3O4+H2O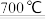 3ZnFe2O4+H2↑
3ZnFe2O4+H2↑该循环制氢的总化学反应方程式为
(2)科学家研发出一种以铝镓合金(镓:Ga)和水为原料制取氢气的新工艺,流程如图1所示:反应①的化学方程式是

(3)利用甲烷(CH4)和水蒸气催化重整制氢,主要在500℃以上发生下列反应:
a:CH4+H2O=CO+3H2; b:CO+H2O=CO2+H2。

①提纯氢气的方法之一是使用金属膜透氢,微观过程如图2所示,从微观角度描述该过程
②提纯氢气还可以用CaO作为吸附剂吸收除去CO2.使用一段时间后氧化钙会转化为碳酸钙而失效。失效的吸附剂经煅烧可再次投入使用,但经多次循环后,吸附效果仍会降低。固体结构变化如图3所示,请分析吸附剂效果降低的原因是
Ⅱ、氢气的储存
(4)储氢金属是一类能够与H2结合呈金属氢化物的材料,如Na可与H2结合生成氢化钠(NaH),氢化钠与水反应可释放出H2,同时生成一种碱,该反应的化学方程式为
Ⅲ、氢能的应用
(5)利用“活泼金属”可以制得氢气,氢气可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有___________(填字母)。
| A.金属原料的成本 | B.生成过程中的能耗和污染 | C.金属的回收利用 |
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】山梨酸是国际卫生组织推荐的高效安全的防腐保鲜剂,广泛应用于食品、饮料等行业。实验小组欲探究山梨酸的元素组成,进行如下实验。
(1)小青取适量的山梨酸按图1进行操作,分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置在火焰上方,根据实验现象确定山梨酸中一定含有碳、氢元素。其他同学认为小青的实验设计不严谨,原因是_____
(2)为了进一步确定山梨酸的元素组成,小明取4.48g山梨酸利用图2进行实验。


①实验前要通一会儿氮气,目的是_____
②装置A中需配制360g5%的过氧化氢溶液,需要向一定量30%的过氧化氢溶液中加入_____
③装置B中氧化钙固体的作用是_____
④装置C中的氧化铜能将山梨酸中的碳元素完全转化为二氧化碳,若有少量的一氧化碳,氧化铜的颜色变化为_____
⑤将生成的气体缓慢通过装置D,装置D应选图3中的_____

山梨酸的相对分子质量为112,根据以上数据计算山梨酸的化学式_____
若没有装置E,通过实验测得氢、氧元素的质量比会_____
(1)小青取适量的山梨酸按图1进行操作,分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置在火焰上方,根据实验现象确定山梨酸中一定含有碳、氢元素。其他同学认为小青的实验设计不严谨,原因是
(2)为了进一步确定山梨酸的元素组成,小明取4.48g山梨酸利用图2进行实验。


①实验前要通一会儿氮气,目的是
②装置A中需配制360g5%的过氧化氢溶液,需要向一定量30%的过氧化氢溶液中加入
③装置B中氧化钙固体的作用是
④装置C中的氧化铜能将山梨酸中的碳元素完全转化为二氧化碳,若有少量的一氧化碳,氧化铜的颜色变化为
⑤将生成的气体缓慢通过装置D,装置D应选图3中的

| 装置 | 反应前质量 | 反应后质量 |
| 浓硫酸 | 125.3g | 128.18g |
| 浓NaOH溶液 | 85.6g | 96.16g |
山梨酸的相对分子质量为112,根据以上数据计算山梨酸的化学式
若没有装置E,通过实验测得氢、氧元素的质量比会
您最近一年使用:0次
【推荐3】实现“碳达峰”、“碳中和”,需要我们对二氧化碳有全面的认识。
Ⅰ.二氧化碳的发现
(1)1772年,拉瓦锡进行木炭在纯氧燃烧的实验,发现只生成一种气体,由此得出该气体是由碳、氧两种元素组成的化合物。拉瓦锡得出这一结论的依据是:_______ 。后来,人们用更精确的实验方法证明了二氧化碳分子中碳、氧原子的个数比为1:2。
Ⅱ.二氧化碳的实验室制法_______ (选填编号)。用图2装置收集CO2时,空气从_______ (选填“a”或“b”)口排出。
Ⅲ.二氧化碳的捕集与资源化利用
(3)控制CO2的排放,主要是为了减缓温室效应。加压水洗法可捕集CO2,是因为_______ 。
(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。
①CaC2O4·H2O热分解可制备CaO。CaC2O4·H2O加热升温过程中固体的质量变化见图3。_______ 。第二阶段反应产生的气体是_______ 。
②365g含CaC2O4·H2O80%的固体分解,最终制得得CaО质量为_______ g。
Ⅰ.二氧化碳的发现
(1)1772年,拉瓦锡进行木炭在纯氧燃烧的实验,发现只生成一种气体,由此得出该气体是由碳、氧两种元素组成的化合物。拉瓦锡得出这一结论的依据是:
Ⅱ.二氧化碳的实验室制法

Ⅲ.二氧化碳的捕集与资源化利用
(3)控制CO2的排放,主要是为了减缓温室效应。加压水洗法可捕集CO2,是因为
(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。
①CaC2O4·H2O热分解可制备CaO。CaC2O4·H2O加热升温过程中固体的质量变化见图3。

②365g含CaC2O4·H2O80%的固体分解,最终制得得CaО质量为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】铜是与人类关系非常密切的有色金属,被广泛地应用于电气、交通、轻工、机械制造、冶金、能源、高科技、石油化工、建筑工业、国防工业等领域,在中国有色金属材料的消费中仅次于铝。人们以辉铜矿(住要成分为Cu2S)为原料可以冶炼铜。Cu2S在高温下与氧气反应的部分转化关系如下图:

(1)Cu2O中铜元素的质量分数为______ (保留一位小数)。
(2)反应2的基本类型是______ 。
(3)Cu2S在高温下与氧气反应会产生大气污染物SO2,严重时会产生______ 型酸雨。
(4)从含有CuSO4和H2SO4的混合溶液中加入铁屑可以回收铜:现有100gCuSO4和H2SO4的混合溶液。加入足量铁屑充分反应后回收到32g铜,求混合溶液中CuSO4的质量分数(要求写出详细的计算过程)。

(1)Cu2O中铜元素的质量分数为
(2)反应2的基本类型是
(3)Cu2S在高温下与氧气反应会产生大气污染物SO2,严重时会产生
(4)从含有CuSO4和H2SO4的混合溶液中加入铁屑可以回收铜:现有100gCuSO4和H2SO4的混合溶液。加入足量铁屑充分反应后回收到32g铜,求混合溶液中CuSO4的质量分数(要求写出详细的计算过程)。
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】金属及其化合物在生产生活中应用广泛。
(一)金属的性质和应用
(1)人类使用金属先后经历了:“青铜”、“铁器”时代,近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性不同,其由强到弱的顺序是___________ 。
(2)我国西汉就有“曾青得铁则化为铜”之说,用化学方程式表示其原理___________ 。
(3)铁生锈主要与空气中的___________ 有关。
(4)如图实验说明NaC1在铁生锈中的作用是___________ 。

铁生锈的主要过程为:
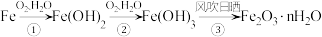
(5)写出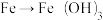 的化学方程式
的化学方程式___________ 。
(6)铁锈中一定含Fe2O3.nH2O,可能含FeCO3(FeCO3和稀HCl的反应与CaCO3相似),在某铁锈样品中加稀HCl,___________ (填现象),证明不含FeCO3.
(二)铁的化合物制备
用废铁屑制备铁红(主要成分为Fe2O3)的部分流程如下图所示:
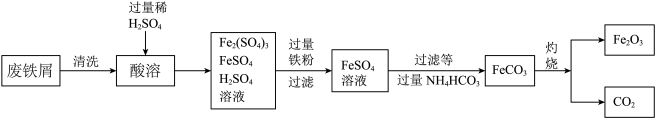
(7)清洗时利用洗涤剂的___________ 作用,用其除废铁屑表面的油污。
(8)流程中加入的铁粉除和H2SO4反应外,还和Fe2(SO4)3发生化合反应,此化合反应的化学方程式为___________ 。
(9)加过量NH4HCO3反应时温度不宜过高的原因为___________ 。
(10)在空气中灼烧FeCO3的反应为___________ (写化学方程式)。
(三)CH4还原Fe2O3的探究
取48.0gFe2O3粉末,用下图装置进行实验,并对反应及产物等作探究。
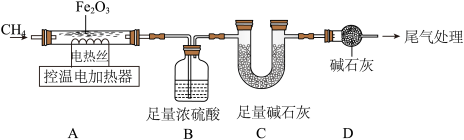
资料:①浓硫酸有吸水性,碱石灰可吸收H2O和CO2.② 。
。
(11)装配好实验装置后,先要___________ 。
(12)加热前后及过程中均通入CH4,停止加热后继续通CH4的目的是防止倒吸和___________ 。
(13)A中有如下反应: ,下列说法正确的是
,下列说法正确的是___________ (填序号)。
a、y=2x b、装置B、C增加的质量比为9:22
(14)控温加热一段时间后,继续通CH4至冷却,A中剩余的35.2g固体为Fe和FeO的混合物。在剩余固体中加一定量硫酸溶液,反应刚好完全。
①剩余固体中FeO质量为___________ g。
②剩余固体和稀硫酸完全反应形成FeSO4的质量为___________ g。
(一)金属的性质和应用
(1)人类使用金属先后经历了:“青铜”、“铁器”时代,近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性不同,其由强到弱的顺序是
(2)我国西汉就有“曾青得铁则化为铜”之说,用化学方程式表示其原理
(3)铁生锈主要与空气中的
(4)如图实验说明NaC1在铁生锈中的作用是

铁生锈的主要过程为:
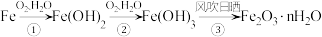
(5)写出
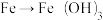 的化学方程式
的化学方程式(6)铁锈中一定含Fe2O3.nH2O,可能含FeCO3(FeCO3和稀HCl的反应与CaCO3相似),在某铁锈样品中加稀HCl,
(二)铁的化合物制备
用废铁屑制备铁红(主要成分为Fe2O3)的部分流程如下图所示:

(7)清洗时利用洗涤剂的
(8)流程中加入的铁粉除和H2SO4反应外,还和Fe2(SO4)3发生化合反应,此化合反应的化学方程式为
(9)加过量NH4HCO3反应时温度不宜过高的原因为
(10)在空气中灼烧FeCO3的反应为
(三)CH4还原Fe2O3的探究
取48.0gFe2O3粉末,用下图装置进行实验,并对反应及产物等作探究。

资料:①浓硫酸有吸水性,碱石灰可吸收H2O和CO2.②
 。
。(11)装配好实验装置后,先要
(12)加热前后及过程中均通入CH4,停止加热后继续通CH4的目的是防止倒吸和
(13)A中有如下反应:
 ,下列说法正确的是
,下列说法正确的是a、y=2x b、装置B、C增加的质量比为9:22
(14)控温加热一段时间后,继续通CH4至冷却,A中剩余的35.2g固体为Fe和FeO的混合物。在剩余固体中加一定量硫酸溶液,反应刚好完全。
①剩余固体中FeO质量为
②剩余固体和稀硫酸完全反应形成FeSO4的质量为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
解题方法
【推荐3】金属材料在生产、生活中使用广泛。
(1)用生铁制成铁锅是利用了其良好的______ 性;生铁比纯铁硬度大,其原因是______ 。
(2)在Cu(NO3)2、AgNO3和Zn(NO3)2的混合溶液中加入一定量的镁粉,充分反应后过滤,可得到滤渣和滤液。
①写出反应过程中一定发生的化学反应方程式:______ 。
②反应后得到滤液质量一定小于原混合溶液的质量,请分析原因:______ 。
③若取6.5g反应后所得的滤渣,向其中加入足量的稀盐酸,得到0.2g氢气,则滤渣的组成可能是______ 。
A.银、铜、锌 B.银、铜、镁 C.银、铜、锌、镁
(3)利用如图装置进行模拟冶铁的实验,并检验该反应的气体产物。已知由A装置制取的一氧化碳气体中混有少量二氧化碳和水蒸气。

①要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接______ 、______ 接______ 、______ 接______ 、______ 接______ 、______ 接i。
②D装置在冷却过程中,应该如何防止其中的黑色粉末与空气接触而变为红色______ 。
(4)100t含Fe2O380%的赤铁矿石理论上能炼出含杂质4%的生铁的质量是多少?(保留一位小数)
(1)用生铁制成铁锅是利用了其良好的
(2)在Cu(NO3)2、AgNO3和Zn(NO3)2的混合溶液中加入一定量的镁粉,充分反应后过滤,可得到滤渣和滤液。
①写出反应过程中一定发生的化学反应方程式:
②反应后得到滤液质量一定小于原混合溶液的质量,请分析原因:
③若取6.5g反应后所得的滤渣,向其中加入足量的稀盐酸,得到0.2g氢气,则滤渣的组成可能是
A.银、铜、锌 B.银、铜、镁 C.银、铜、锌、镁
(3)利用如图装置进行模拟冶铁的实验,并检验该反应的气体产物。已知由A装置制取的一氧化碳气体中混有少量二氧化碳和水蒸气。

①要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接
②D装置在冷却过程中,应该如何防止其中的黑色粉末与空气接触而变为红色
(4)100t含Fe2O380%的赤铁矿石理论上能炼出含杂质4%的生铁的质量是多少?(保留一位小数)
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】物质的性质和用途是化学的重要研究内容。
(1)浓硫酸有吸水性,在实验室中常用它做______ 剂。
(2)用石灰浆粉刷墙壁,干燥后墙面就变硬了,用化学原理解释该现象。
(3)如图中,用滤纸做成的小花喷洒某溶液后放在烧杯上方,片刻后变成红色,请推测喷洒液和烧杯中溶液可能是什么?(写出一组即可)

(4)配制一瓶如图溶液需氯化钠______ g;配制50g6%氯化钠溶液,若用量筒量取水时俯视读数(其他操作正确),则溶液的质量分数______ 6%(填“>”、“<”或“=”)。

(5)已知: ;
;
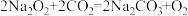 。实验室做口放置的过氧化钠(Na2O2)已部分变质,取少量该固体样品于试管中,加足量水。可观察到什么现象?如何检验该水溶液中含有的氢氧化钠?(请简要写出实验步骤和现象)
。实验室做口放置的过氧化钠(Na2O2)已部分变质,取少量该固体样品于试管中,加足量水。可观察到什么现象?如何检验该水溶液中含有的氢氧化钠?(请简要写出实验步骤和现象)
(6)钛和钛合金性能优良,广泛用于航空、造船和化学工业中、工业上常用钠来制取钛。在高温时,钠与四氧化钛(TiCl4)反应生成氯化钠和钛。若要用该方法制取2.4kg钛,理论上需要钠的质量是多少?
(1)浓硫酸有吸水性,在实验室中常用它做
(2)用石灰浆粉刷墙壁,干燥后墙面就变硬了,用化学原理解释该现象。
(3)如图中,用滤纸做成的小花喷洒某溶液后放在烧杯上方,片刻后变成红色,请推测喷洒液和烧杯中溶液可能是什么?(写出一组即可)

(4)配制一瓶如图溶液需氯化钠

(5)已知:
 ;
;
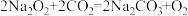 。实验室做口放置的过氧化钠(Na2O2)已部分变质,取少量该固体样品于试管中,加足量水。可观察到什么现象?如何检验该水溶液中含有的氢氧化钠?(请简要写出实验步骤和现象)
。实验室做口放置的过氧化钠(Na2O2)已部分变质,取少量该固体样品于试管中,加足量水。可观察到什么现象?如何检验该水溶液中含有的氢氧化钠?(请简要写出实验步骤和现象)(6)钛和钛合金性能优良,广泛用于航空、造船和化学工业中、工业上常用钠来制取钛。在高温时,钠与四氧化钛(TiCl4)反应生成氯化钠和钛。若要用该方法制取2.4kg钛,理论上需要钠的质量是多少?
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】Na2CO3在工业和生活中有重要的作用。它的来源主要有以下两种途径:
I.将制碱与制氨结合起来的联合制碱法。这个方法是由我国的制碱工业先驱_ 发明的。
A 张青莲
B 道尔顿
C 侯德榜
D 华罗庚
Ⅱ.自然界有很多咸水湖,人们通过“冬天捞喊,夏天晒盐”的方式获得湖盐,其中就含有Na2CO3。
(1)小明同学想对某夏天制得的湖盐样品成分进行探究,查阅资料后他对样品成分做出了三种猜想。
猜想一:NaCl、Na2CO3
猜想二:NaCl、Na2SO4;
猜想三:NaCl、Na2CO3、Na2SO4请帮助他完成如下实验:
(2)小明同学为进一步确定上述湖盐样品中Na2CO3 的质量分数,取该湖盐样品10.0g做了如图所示的补充实验。(注:所用药品均足量)

①反应结束之后打开止水夹并通入空气的目的是____ 。
②装置D中发生的反应为____ (用化学方程式表示)。
③实验中碱石灰(含氧化钙和氢氧化钠)的作用是___ 。
④实验结束后,测得装置D增重0.33g,则该湖盐样品中Na2CO3的质量分数为多少___ ?
I.将制碱与制氨结合起来的联合制碱法。这个方法是由我国的制碱工业先驱
A 张青莲
B 道尔顿
C 侯德榜
D 华罗庚
Ⅱ.自然界有很多咸水湖,人们通过“冬天捞喊,夏天晒盐”的方式获得湖盐,其中就含有Na2CO3。
(1)小明同学想对某夏天制得的湖盐样品成分进行探究,查阅资料后他对样品成分做出了三种猜想。
猜想一:NaCl、Na2CO3
猜想二:NaCl、Na2SO4;
猜想三:NaCl、Na2CO3、Na2SO4请帮助他完成如下实验:
| 实验操作 | 实验现象 | 实验结论 | |
| 实验一 | 取少量样品于试管中,加适量水溶解后,加入过量稀HNO3 | 产生能使澄清石灰水变浑浊的气体 | 猜想 |
| 实验二 | 向实验一所得的溶液中加入适量的 | 猜想三成立 |
(2)小明同学为进一步确定上述湖盐样品中Na2CO3 的质量分数,取该湖盐样品10.0g做了如图所示的补充实验。(注:所用药品均足量)

①反应结束之后打开止水夹并通入空气的目的是
②装置D中发生的反应为
③实验中碱石灰(含氧化钙和氢氧化钠)的作用是
④实验结束后,测得装置D增重0.33g,则该湖盐样品中Na2CO3的质量分数为多少
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】有一包固体粉末,可能是BaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种,某实验小组对其组成成分进行了以下探究活动:
(1)【思考与交流】上述物质中,不溶于水的是________ (填化学式)
【资料查阅】Na2CO3溶液与CuSO4溶液混合能产生蓝色沉淀。
(2)【活动与探究】取一定量上述固体粉末,加足量水溶解,在溶解过程中一定要用到的玻璃仪器有________ 和玻璃棒。
(3)【现象与结论】经上述操作,得到蓝色的澄清溶液,则原固体粉末中一定有________ ,一定没有________ 和_______ ,可能有________ (填化学式)。
(4)【探索与拓展】
该实验小组在确定了原固体粉末的组成后继续进行如下实验:先用托盘天平称取30.2g原固体粉末,将其溶于水配成137.3g溶液,再往其中加入溶质质量分数为16%的NaOH溶液,产生沉淀的质量与所加NaOH溶液质量的关系如图所示。请据图计算A点所示溶液中溶质的质量分数?________________________

(1)【思考与交流】上述物质中,不溶于水的是
【资料查阅】Na2CO3溶液与CuSO4溶液混合能产生蓝色沉淀。
(2)【活动与探究】取一定量上述固体粉末,加足量水溶解,在溶解过程中一定要用到的玻璃仪器有
(3)【现象与结论】经上述操作,得到蓝色的澄清溶液,则原固体粉末中一定有
(4)【探索与拓展】
该实验小组在确定了原固体粉末的组成后继续进行如下实验:先用托盘天平称取30.2g原固体粉末,将其溶于水配成137.3g溶液,再往其中加入溶质质量分数为16%的NaOH溶液,产生沉淀的质量与所加NaOH溶液质量的关系如图所示。请据图计算A点所示溶液中溶质的质量分数?

您最近一年使用:0次



