某兴趣小组用铁钉与硫酸铜溶液反应验证质量守恒定律时,发现铁钉表面有气泡产生、溶液没有变成浅绿色的异常现象,请你和兴趣小组一起探究,并回答问题。
【查阅资料】1.硫酸亚铁与氧气和水能发生反应,使得溶液中的氢离子浓度增加
2溶液中氢离子浓度越大,酸性越强
(1)探究一:铁钉表面产生的是什么气体?
【做出猜想】
猜想一:二氧化硫;猜想二:氧气;猜想三:氢气。
做出猜想的依据是___________ 。
【进行实验】
【实验分析】
硫酸铜溶液呈酸性,溶液中含有氢离子,该气体可看成由稀硫酸与铁钉反应产生的,请用化学方程式表示该气体产生的原因___________ 。
(2)探究二:铁和硫酸铜溶液反应的最佳条件是什么?
【实验探究】
分别用蒸馏水配置4%和2%的硫酸铜的冷、热溶液,各取5ml分别加入4支试管中,放入用砂纸打磨过的相同铁钉,比较反应现象,记录如下表:
①为探究反应物浓度对实验的影响,可选择实验___________ 进行对照(填实验编号)
②结合表格数据分析,铁和硫酸铜溶液反应的最佳条件是___________ 。
(3)探究三:反应中溶液pH值为什么减小?
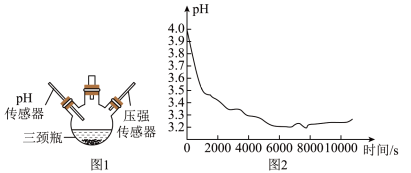
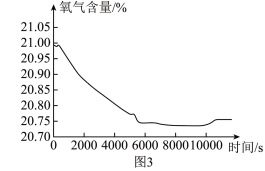
结合探究一中氢气产生的原理,兴趣小组的同学推测,随着反应的进行,溶液中氢离子浓度应该减小,pH值应该逐渐增大,于是利用如图1装置,用pH传感器测量溶液pH值的变化,同时测定了该装置中氧气含量的变化,结果如图2、图3所示,试分析溶液pH值下降的原因___________ 。
【反思与交流】
(4)结合以上探究综合分析
①探究二中配置硫酸铜溶液的蒸馏水应该___________ 。
②利用铁与硫酸铜反应验证质量守恒定律时,应注意___________ 。
【查阅资料】1.硫酸亚铁与氧气和水能发生反应,使得溶液中的氢离子浓度增加
2溶液中氢离子浓度越大,酸性越强
(1)探究一:铁钉表面产生的是什么气体?
【做出猜想】
猜想一:二氧化硫;猜想二:氧气;猜想三:氢气。
做出猜想的依据是
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①小芳用手在冒气泡的试管口轻轻扇动,使少量气体进入鼻孔 | 猜想一不正确 | |
| ②小刚用带火星的木条伸入收集该气体的试管中 | 木条不复燃 | 猜想二不正确 |
| ③小明将收集该气体的试管移近酒精灯火焰,松开拇指 | 猜想三正确 |
硫酸铜溶液呈酸性,溶液中含有氢离子,该气体可看成由稀硫酸与铁钉反应产生的,请用化学方程式表示该气体产生的原因
(2)探究二:铁和硫酸铜溶液反应的最佳条件是什么?
【实验探究】
分别用蒸馏水配置4%和2%的硫酸铜的冷、热溶液,各取5ml分别加入4支试管中,放入用砂纸打磨过的相同铁钉,比较反应现象,记录如下表:
| 实验编号 | 硫酸铜溶液 | 变为浅绿色 | 有红色固体 | 无气泡 | 符合标准现象 |
| 1 | 2%硫酸铜冷溶液 | √较慢 | √ | √ | √ |
| 2 | 2%硫酸铜热溶液 | √较快 | √ | √ | √ |
| 3 | 4%硫酸铜冷溶液 | √缓慢 | √ | √ | √ |
| 4 | 4%硫酸铜热溶液 | √较快 | √ | × | × |
②结合表格数据分析,铁和硫酸铜溶液反应的最佳条件是
(3)探究三:反应中溶液pH值为什么减小?
结合探究一中氢气产生的原理,兴趣小组的同学推测,随着反应的进行,溶液中氢离子浓度应该减小,pH值应该逐渐增大,于是利用如图1装置,用pH传感器测量溶液pH值的变化,同时测定了该装置中氧气含量的变化,结果如图2、图3所示,试分析溶液pH值下降的原因


【反思与交流】
(4)结合以上探究综合分析
①探究二中配置硫酸铜溶液的蒸馏水应该
②利用铁与硫酸铜反应验证质量守恒定律时,应注意
2023·安徽合肥·一模 查看更多[4]
更新时间:2023-04-08 07:15:20
|
相似题推荐
科学探究题
|
较难
(0.4)
解题方法
【推荐1】某小组同学在实验室研究铝与氯化铜溶液的反应。
(1)打磨铝片的目的是__________________ 。
(2)现象①和现象③中的红色物质均为Cu,生成该物质的化学方程式为_______________ 。
(3)经检验,现象②中的无色气体为氢气。小涛猜测可能是氯化铜溶液显酸性.并用pH试纸检验。pH试纸的使用方法是:_______________ ,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH。测得结果pH______ 7(填“>”、“=”或“ <”),证实了小涛的猜想。
(4)小明通过查阅资料探究白色沉淀的成分,认为可能是氯化亚铜( CuCl)。
[查阅资料]
①CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-。
②Cu( NH3)2+在空气中易被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
[进行实验]
①取烧杯底部的白色沉淀,充分洗涤过滤;
③向其中加入浓氨水,沉淀溶解得到无色溶液,并分为两份;
④取其中一份无色溶液
⑤将另一份无色溶液放置于空气中
以上步骤③的实验方案是_____ ,步骤④的实验现象是____________ 。
[得出结论]通过实验可以确定,该白色固体是CuCl
[反思与评价]A1和CuCl2溶液反应为什么会出现CuCl呢?
小颖猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
小颖为了验证猜想,取Cu粉与15%CuCl2溶液混合,无白色沉淀产生。
(5)小颖通过分析Al与CuCl2溶液反应的实验现象,改进了实验,从而证明了Cu与CuCl2溶液反应生成了CuCl。改进之处是_________________ 。
| 实验操作 | 实验现象 |
 | ①红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(2)现象①和现象③中的红色物质均为Cu,生成该物质的化学方程式为
(3)经检验,现象②中的无色气体为氢气。小涛猜测可能是氯化铜溶液显酸性.并用pH试纸检验。pH试纸的使用方法是:
(4)小明通过查阅资料探究白色沉淀的成分,认为可能是氯化亚铜( CuCl)。
[查阅资料]
①CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-。
②Cu( NH3)2+在空气中易被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
[进行实验]
①取烧杯底部的白色沉淀,充分洗涤过滤;
③向其中加入浓氨水,沉淀溶解得到无色溶液,并分为两份;
④取其中一份无色溶液
⑤将另一份无色溶液放置于空气中
以上步骤③的实验方案是
[得出结论]通过实验可以确定,该白色固体是CuCl
[反思与评价]A1和CuCl2溶液反应为什么会出现CuCl呢?
小颖猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
小颖为了验证猜想,取Cu粉与15%CuCl2溶液混合,无白色沉淀产生。
(5)小颖通过分析Al与CuCl2溶液反应的实验现象,改进了实验,从而证明了Cu与CuCl2溶液反应生成了CuCl。改进之处是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐2】某化学兴趣小组的同学为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动。
【进行猜想】同学们对三种金属的活动性顺序作出如下猜想:
猜想一:R>Fe>Cu; 猜想二:Fe>R>Cu; 猜想三:Fe>Cu>R
【实验探究】同学们根据实验药品和仪器,分别用下列两种方案完成探究实验。
【表达交流】写出铁丝在氧气中燃烧的化学方程式_____ 。
【探究结论】两种实验方案都得出猜想一正确。
【归纳总结】比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与_____ 是否反应。
【拓展应用】利用下列五组试剂验证锌、铜、银三种金属的活动性顺序,从原理上分析,可以达到实验目的的是_____ 。
①Cu、ZnSO4溶液、Ag
②Zn、Cu、Ag、稀硫酸
③Ag、Zn、CuSO4溶液
④稀硫酸、Zn、Cu、AgNO3溶液
⑤ZnSO4溶液、Cu、AgNO3溶液
【进行猜想】同学们对三种金属的活动性顺序作出如下猜想:
猜想一:R>Fe>Cu; 猜想二:Fe>R>Cu; 猜想三:Fe>Cu>R
【实验探究】同学们根据实验药品和仪器,分别用下列两种方案完成探究实验。
| 方案 | 主要操作 | 主要现象 | 实验结论 |
| 甲 | (1)将打磨好的粗细相同的R丝、铁丝分别放在酒精灯火焰上灼烧,并将铁丝趁热伸入装满氧气的集气瓶中 | R丝在空气中剧烈燃烧;铁丝在纯氧中才能剧烈燃烧、火星四射,生成 | 金属活动性: |
| (2) | 铁丝表面附着红色固体,蓝色溶液变为浅绿色 | 金属活动性:Fe>Cu | |
| 乙 | 将打磨好的粗细相同的R丝、铁丝、铜丝分别插入体积和浓度都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率 | 金属活动性:R>Fe>Cu |
【表达交流】写出铁丝在氧气中燃烧的化学方程式
【探究结论】两种实验方案都得出猜想一正确。
【归纳总结】比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与
【拓展应用】利用下列五组试剂验证锌、铜、银三种金属的活动性顺序,从原理上分析,可以达到实验目的的是
①Cu、ZnSO4溶液、Ag
②Zn、Cu、Ag、稀硫酸
③Ag、Zn、CuSO4溶液
④稀硫酸、Zn、Cu、AgNO3溶液
⑤ZnSO4溶液、Cu、AgNO3溶液
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】某化学兴趣小组的学生,发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动:
【作出猜想】他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:
猜想一:Al>Cu>R,猜想二:_______ ,猜想三:R> Al>Cu,
【查阅资料】R是一种银白色的金属,在R的盐溶液中只有+2价R的盐溶液呈蓝色,常温下铝的表面会形成一层致密的氧化膜;硫酸铝、氯化铝、硝酸铝的溶液均为无色。
【实验探究】为了探究哪一种猜想成立,甲、乙、丙三位同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。
【交流反思】究竟哪种猜想成立?三位同学经讨论交流,发现丙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到丙同学做实验用过的溶液中,一段时间后,溶液的颜色______ ;进而确认猜想三不成立,猜想二成立。
【归纳总结】探究结束后,他们总结得出:通过金属与______ 反应或金属与盐溶液反应可以比较金属活动性强弱。
【作出猜想】他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:
猜想一:Al>Cu>R,猜想二:
【查阅资料】R是一种银白色的金属,在R的盐溶液中只有+2价R的盐溶液呈蓝色,常温下铝的表面会形成一层致密的氧化膜;硫酸铝、氯化铝、硝酸铝的溶液均为无色。
【实验探究】为了探究哪一种猜想成立,甲、乙、丙三位同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。
| 猜想 | 主要操作 | 主要现象 | 实验结论 |
| 猜想一 | 打磨R丝,并将其插入到硫酸铜溶液中. | R丝表面覆盖了一层红色的物质. | 猜想一 |
| 猜想二 | 打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中. | ①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色.②铝丝表面产生气泡较快.③铜丝表面没有气泡产生. | 猜想二成立. |
| 猜想三 | 将打磨过的铝丝插入到 | 无明显现象. | 猜想三成立 |
【归纳总结】探究结束后,他们总结得出:通过金属与
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐1】纳米铁粉在环保领域应用广泛,以菱铁矿(主要成分为FeCO3,杂质不与酸发生反应)为原料,制备纳米铁粉的反应为: 。反应一段时间后,某学习小组对剩余固体的成分进行探究,并测定菱镁矿中 FeCO3的质量分数。
。反应一段时间后,某学习小组对剩余固体的成分进行探究,并测定菱镁矿中 FeCO3的质量分数。
【查阅资料】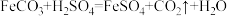
【实验探究】已知B、D装置中试剂足量,该学习小组利用下图装置,称取m1克剩余固体于A装置进行探究,先向A中鼓入氮气,待装置中的空气排尽后,再向装置A中加入足量的稀硫酸,A中产生气泡且溶液变为浅绿色,装置B中溶液变浑浊,装置 E固体变蓝,待A中反应结束后,再次向A中鼓入氮气,最终从装置B中得到的白色沉淀质量为w克。回答下列问题。
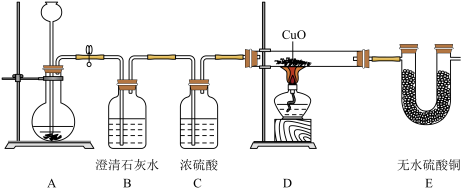
(1)依据上述实验现象,可得出剩余固体的成分为_______ 。
(2)依据A中产生气泡且溶液变为浅绿色,小玉同学判断剩余固体为铁,小刚同学认为小玉的判断不合理,理由是:_______ 。
(3)装置D中反应的化学方程式是_______ 。
(4)待A中反应结束后,再次鼓入氮气的目的是_______ 。
(5)依据实验数据,菱镁矿中FeCO3的质量分数为_______ 。
 。反应一段时间后,某学习小组对剩余固体的成分进行探究,并测定菱镁矿中 FeCO3的质量分数。
。反应一段时间后,某学习小组对剩余固体的成分进行探究,并测定菱镁矿中 FeCO3的质量分数。【查阅资料】
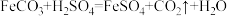
【实验探究】已知B、D装置中试剂足量,该学习小组利用下图装置,称取m1克剩余固体于A装置进行探究,先向A中鼓入氮气,待装置中的空气排尽后,再向装置A中加入足量的稀硫酸,A中产生气泡且溶液变为浅绿色,装置B中溶液变浑浊,装置 E固体变蓝,待A中反应结束后,再次向A中鼓入氮气,最终从装置B中得到的白色沉淀质量为w克。回答下列问题。

| 装置 | B | D | E |
| 反应前质量(克) | m2 | m3 | m4 |
| 反应后质量(克) | m′2 | m′3 | m′4 |
(2)依据A中产生气泡且溶液变为浅绿色,小玉同学判断剩余固体为铁,小刚同学认为小玉的判断不合理,理由是:
(3)装置D中反应的化学方程式是
(4)待A中反应结束后,再次鼓入氮气的目的是
(5)依据实验数据,菱镁矿中FeCO3的质量分数为
您最近一年使用:0次
【推荐2】社会发展离不开金属,生产生活中铁、铝及其合金制品随处可见,了解不同金属的化学性质有利于人们合理地使用并改造金属。
铝制易拉罐:某品牌碳酸饮料的易拉罐是由铝合金制成的,内壁附着一层有机薄膜。该铝合金中铝的含量约为97%,还含有镁、锰、铁、铟(In)等。

(1)制备铝及其它金属
工业上常用电解氧化铝的方法制备金属铝,反应的化学方程式为_______ 。分别写出还原法、湿法冶炼其他金属的方程式_______ 。
(2)铝合金中的铟(In)
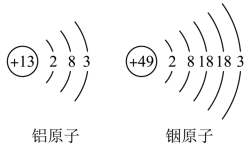
如图为铝、铟的原子结构示意图。某同学推测金属铟与铝的化学性质相似,理由是_______ 。实验证明,铟可以与稀盐酸反应,其反应的化学方程式_______ 。
探究金属R:
现有铜与另一种金属R(可能是银、镁、铁中的一种)的混合粉末。欲确定R的成分,请你一起完成:
(3)取少最的金属粉末于试管中,逐滴滴加稀硫酸,有气泡产生,待不再产生气泡时,再进行_______ (填写一种实验操作方法),得到溶液和铜。然后往溶液中加入洁净的锌片,锌片表面有金属析出,则R是_______ 。
(4)金属R与稀硫酸反应的化学方程式为_______ ,该反应质于基本反应类型中的_______ 反应。描述该反应的微观过程_______ 。
(5)下图是铝片与硫酸铜溶液反应的微观示意图:

通过以上分析可以知道,不同金属的化学性质不同的原因是_______ 。
探究金属镁、铝、锌的活动性强弱
(6)请利用金属能与酸反应的性质,自选仪器和药品,探究金属镁、铝、锌的活动性强弱,完成下列实验报告:
请以反应时间为横坐标,生成氢气质量为纵坐标,画出等质量的镁、铝、锌三种金属与足量的等质量等质量分数的稀盐酸反应的图像_______ 。
探究蒸汽眼罩
(7)蒸汽眼罩逐渐走进日常生活,它借助铁生锈产生热量,使材料内部的水分稳定蒸发,利用产生的热度和湿度缓解眼部疲劳。
【实验探究】
①探究一:蒸汽眼罩快速发热的原因
铁生锈,是铁与_______ 共同作用的结果,但放热缓慢。哪些因素能加快反应,使蒸汽眼罩快速发热?某小组同学采用对照实验展开探究,设计实验方案如下:
(查阅资料:蒸汽眼罩内部材料有铁粉、活性炭、氯化钠、水等。)
下列方案之间能否形成对照?若能,请指出变量;若不能,请说明理由。
方案二与方案四_______ ;
方案一与方案四_______ 。
使用温度传感器收集数据并生成图像如图:


对比分析图像,你获得的结论是_______ 。
②探究二:测量蒸汽眼罩内部材料中铁的质量分数
温馨提示:a.实验仪器和药品自选。b.实验中的数据可分别用m1、m2、m3等来表示。
你的实验方案_______ 。
数据,计算蒸汽眼罩内部材料中铁的质量分数_______ 。
【反思评价】结合上述探究谈谈你对铁生锈的辩证认识_______ 。
铝制易拉罐:某品牌碳酸饮料的易拉罐是由铝合金制成的,内壁附着一层有机薄膜。该铝合金中铝的含量约为97%,还含有镁、锰、铁、铟(In)等。

(1)制备铝及其它金属
工业上常用电解氧化铝的方法制备金属铝,反应的化学方程式为
(2)铝合金中的铟(In)

如图为铝、铟的原子结构示意图。某同学推测金属铟与铝的化学性质相似,理由是
探究金属R:
现有铜与另一种金属R(可能是银、镁、铁中的一种)的混合粉末。欲确定R的成分,请你一起完成:
(3)取少最的金属粉末于试管中,逐滴滴加稀硫酸,有气泡产生,待不再产生气泡时,再进行
(4)金属R与稀硫酸反应的化学方程式为
(5)下图是铝片与硫酸铜溶液反应的微观示意图:

通过以上分析可以知道,不同金属的化学性质不同的原因是
探究金属镁、铝、锌的活动性强弱
(6)请利用金属能与酸反应的性质,自选仪器和药品,探究金属镁、铝、锌的活动性强弱,完成下列实验报告:
| 实验步骤 | 实验现象 | 实验结论 |
探究蒸汽眼罩
(7)蒸汽眼罩逐渐走进日常生活,它借助铁生锈产生热量,使材料内部的水分稳定蒸发,利用产生的热度和湿度缓解眼部疲劳。
【实验探究】
①探究一:蒸汽眼罩快速发热的原因
铁生锈,是铁与
(查阅资料:蒸汽眼罩内部材料有铁粉、活性炭、氯化钠、水等。)
| 药品 | |
| 方案一 | 4g铁粉、2mL水 |
| 方案二 | 4g铁粉、2mL水、2g氯化钠 |
| 方案三 | 4g铁粉、2mL水、2g活性炭 |
| 方案四 | 4g铁粉、2mL水、2g活性炭、2g氯化钠 |
方案二与方案四
方案一与方案四
使用温度传感器收集数据并生成图像如图:


对比分析图像,你获得的结论是
②探究二:测量蒸汽眼罩内部材料中铁的质量分数
温馨提示:a.实验仪器和药品自选。b.实验中的数据可分别用m1、m2、m3等来表示。
你的实验方案
数据,计算蒸汽眼罩内部材料中铁的质量分数
【反思评价】结合上述探究谈谈你对铁生锈的辩证认识
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】化学活动小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应。那么,铜与浓硫酸能否发生反应呢?
[猜想与假设]猜想①:在常温下能反应;猜想②:在常温下不能反应,但在加热条件下能反应;猜想③:在加热条件下不能反应。
[实验与事实] 操作①:将一小块铜片放入试管中,加入足量的浓硫酸,无明显现象;操作②:加热该试管,铜片上有气泡产生,并闻到刺激性气味;操作③:检验产生的有刺激性气味的气体(检验方法及现象略);操作④:立即停止加热;操作⑤:将试管中残液慢慢倒入少量水中,溶液呈蓝色。
[结论与解释]
(1)由以上探究可知:猜想_______ 是正确的。
(2)经检验产生的气体是SO2;立即停止加热是为了避免产生更多的SO2。
(3)铜跟浓硫酸在加热条件下反应的产物是SO2和CuSO4。
[反思与评价]
(1)操作⑤中,从安全角度考虑,__________ (填“能”或“不能”)将水倒入剩余的液体里。
(2)探究结论中对产物是SO2和CuSO4的判断是否正确?_______ ,理由是__________ 。
[拓展与应用]根据以上探究和已掌握的知识,同学们又设计了两个利用废铜屑、硫酸为原料制取硫酸铜的实验方案。
甲方案:利用废铜屑跟浓硫酸在加热条件下反应制取CuSO4。
乙方案:在加热条件下将废铜屑在空气中氧化成CuO,再将CuO与稀硫酸反应制取CuSO4。
请你从安全、节约、环保等方面进行评价,较好的方案是________ ,理由是_______ (答出一点即可)。
[猜想与假设]猜想①:在常温下能反应;猜想②:在常温下不能反应,但在加热条件下能反应;猜想③:在加热条件下不能反应。
[实验与事实] 操作①:将一小块铜片放入试管中,加入足量的浓硫酸,无明显现象;操作②:加热该试管,铜片上有气泡产生,并闻到刺激性气味;操作③:检验产生的有刺激性气味的气体(检验方法及现象略);操作④:立即停止加热;操作⑤:将试管中残液慢慢倒入少量水中,溶液呈蓝色。
[结论与解释]
(1)由以上探究可知:猜想
(2)经检验产生的气体是SO2;立即停止加热是为了避免产生更多的SO2。
(3)铜跟浓硫酸在加热条件下反应的产物是SO2和CuSO4。
[反思与评价]
(1)操作⑤中,从安全角度考虑,
(2)探究结论中对产物是SO2和CuSO4的判断是否正确?
[拓展与应用]根据以上探究和已掌握的知识,同学们又设计了两个利用废铜屑、硫酸为原料制取硫酸铜的实验方案。
甲方案:利用废铜屑跟浓硫酸在加热条件下反应制取CuSO4。
乙方案:在加热条件下将废铜屑在空气中氧化成CuO,再将CuO与稀硫酸反应制取CuSO4。
请你从安全、节约、环保等方面进行评价,较好的方案是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
【推荐1】养鱼师傅有时会向鱼塘中撒一种微黄色的固体(主要成分为过氧化钙)。
【查阅资料】过氧化钙能与水能缓慢反应生成氢氧化钙和一种气体。
【提出问题】该固体的作用是什么?该反应吸热还是放热?
【实验探究】某同学用如右图所示的装置进行实验,打开仪器a的活塞,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,烧杯中的导管口有气泡产生。

【分析讨论】
(1)按要求装配好仪器,实验前首先要___________________ 。
(2)过氧化钙与水反应产生的气体是________ ;写出反应的文字表达式 ______________ 。
(3)该反应____________ 反应。(选填“吸热”或“放热”)
(4)养鱼师傅向鱼塘中撒过氧化钙的目的是____________________ 。
【拓展思考】
(5)养鱼师傅说一般在温度比较高的夏天使用过氧化钙较多,说明氧气的溶解能力随着温度的升高而_________ (填“增大”或“减小”)
(6)过氧化钙应_______________ 保存。
【查阅资料】过氧化钙能与水能缓慢反应生成氢氧化钙和一种气体。
【提出问题】该固体的作用是什么?该反应吸热还是放热?
【实验探究】某同学用如右图所示的装置进行实验,打开仪器a的活塞,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,烧杯中的导管口有气泡产生。

【分析讨论】
(1)按要求装配好仪器,实验前首先要
(2)过氧化钙与水反应产生的气体是
(3)该反应
(4)养鱼师傅向鱼塘中撒过氧化钙的目的是
【拓展思考】
(5)养鱼师傅说一般在温度比较高的夏天使用过氧化钙较多,说明氧气的溶解能力随着温度的升高而
(6)过氧化钙应
您最近一年使用:0次
【推荐2】柠檬中含有丰富的维生素C和柠檬酸。为了得到维生素C含量高的柠檬水,小组同学开展了如下研究。
查阅资料:
①维生素C易溶于水,易被氧化,具有酸性,能与碘水反应。
②柠檬酸是一种易溶于水的酸,不能与碘水反应。
③柠檬中除维生素C外,其他物质不与碘水反应;淀粉溶液遇碘水变为蓝色。
【活动一】
(1)选择测定柠檬水中维生素C含量的试剂。
实验结论:实验1-1、1-2都能测定柠檬水中维生素C含量。
(2)反思评价:同学们思考后,认为实验1-1不能测定维生素C含量,理由是___________ 。
【活动二】
用实验1-2的方法,探究泡制温度、时间对柠檬水中维生素C含量的影响。从同一柠檬中取形状和质量相近的柠檬片,柠檬水的泡制过程如图所示:
(3)表格中,x=___________ 。
(4)活动二中,当观察到___________ 时,记录柠檬水滴数。
(5)补充方案:探究浸泡时水的用量对柠檬水中维生素C含量的影响,实验设计的基本思路是_____ 。
(6)除上述活动中涉及的因素外,影响柠檬水中维生素C含量的因素还可能有________ (写出一点即可)。
(7)同学们得知,维生素C在酸性环境中比较稳定,在高温时易被破坏。所以,泡制柠檬水时,要避免高温及长时间浸泡。由此想到:如何食用黄瓜,才能充分利用黄瓜中丰富的维生素C?写出你的方法:___________ 。
【活动三】
提出问题:比较不同果蔬中维生素C的含量高低?
进行实验:分别取等质量的可食用部分的猕猴桃、黄瓜、紫甘蓝、西红柿,切碎,加入等体积蒸馏水→榨汁→过滤→果蔬汁,重复实验1-2。
(8)制作果汁时,除去溶解在蒸馏水中的少量O2的方法是___________ ,这样做的依据是___________ 。
(9)果蔬汁液中存在一定色素,会对维生素C含量测定造成一定干扰。利用学过的知识,提出改进意见:___________ 。
解决了问题之后,同学们继续进行科学探究之旅……
查阅资料:
①维生素C易溶于水,易被氧化,具有酸性,能与碘水反应。
②柠檬酸是一种易溶于水的酸,不能与碘水反应。
③柠檬中除维生素C外,其他物质不与碘水反应;淀粉溶液遇碘水变为蓝色。
【活动一】
(1)选择测定柠檬水中维生素C含量的试剂。
| 实验序号 | 1-1 | 1-2 |
| 实验操作 |
|
|
| 实验现象 | 溶液 | 溶液蓝色褪去 |
实验结论:实验1-1、1-2都能测定柠檬水中维生素C含量。
(2)反思评价:同学们思考后,认为实验1-1不能测定维生素C含量,理由是
【活动二】
用实验1-2的方法,探究泡制温度、时间对柠檬水中维生素C含量的影响。从同一柠檬中取形状和质量相近的柠檬片,柠檬水的泡制过程如图所示:

| 序号 | ① | ② | ③ | ④ | ⑤ |
| 泡制温度/℃ | 24 | 65 | 65 | 65 | 65 |
| 泡制时间/min | 15 | 10 | x | 20 | 30 |
| 柠檬水滴数 | 96 | 59 | 50 | 43 | 34 |
(3)表格中,x=
(4)活动二中,当观察到
(5)补充方案:探究浸泡时水的用量对柠檬水中维生素C含量的影响,实验设计的基本思路是
(6)除上述活动中涉及的因素外,影响柠檬水中维生素C含量的因素还可能有
(7)同学们得知,维生素C在酸性环境中比较稳定,在高温时易被破坏。所以,泡制柠檬水时,要避免高温及长时间浸泡。由此想到:如何食用黄瓜,才能充分利用黄瓜中丰富的维生素C?写出你的方法:
【活动三】
提出问题:比较不同果蔬中维生素C的含量高低?
进行实验:分别取等质量的可食用部分的猕猴桃、黄瓜、紫甘蓝、西红柿,切碎,加入等体积蒸馏水→榨汁→过滤→果蔬汁,重复实验1-2。
(8)制作果汁时,除去溶解在蒸馏水中的少量O2的方法是
(9)果蔬汁液中存在一定色素,会对维生素C含量测定造成一定干扰。利用学过的知识,提出改进意见:
解决了问题之后,同学们继续进行科学探究之旅……
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】在复习“镁及其性质”时,化学兴趣小组同学查阅资料发现:镁在空气中燃烧时,不仅能与氧气反应,还能与二氧化碳、氮气反应。同学们在老师指导下展开了相关探究。
I.铁在中气中燃烧
(1)镁在空气中燃烧,发出耀跟的白光,生成白色粉末状固体。人们将镁粉广泛用于节日焰火,主要是该反应把化学能转化为_________ 能。
【质疑】镁燃烧后得到白色粉末状固体,为什么几乎看不到淡黄色固体?
Ⅱ.镁在二氧化碳中燃烧(如图)

(2)镁在二氧化碳中剧烈燃烧,产生大量白烟,瓶内壁有黑色物质附着,该反应属于______ 反应(填基本反应类型)。
(3)实验可知:燃烧______ (填“一定”或“不一定”)需要氧气,盛放金属镁的仓库着火,_____ (填“能”或“不能”)使用二氧化碳灭火器灭火。
(4)甲同学认为:由于镁也能与CO2反应,所以不能用“镁燃烧法”来粗略测定空气中氧气含量,你赞成他的说法吗?说明理由。_____________
III.镁在氮气中燃烧
【资料】①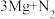

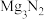 。
。
②氮化镁(MgN2)是一种淡黄色粉末,能与水反应。
兴趣小组同学设计如下图实验研究镁在氮气中的燃烧(假设各步反应完全,仅考虑空气中的N2、O2、CO2和水蒸气,不考虑其它成分)。

(5)A中的现象是________ ,B的作用是________ 。
(6)C中固体变成暗红色,有大量白烟,冷却后有淡黄色粉末;D中液体变成红色且有白色沉淀,湿润的红色石蕊试纸变蓝,冷却后D中红色褪去。写出D中反应的化学方程式____ ,该反应_______ (填“是”或“不是”)复分解反应。热水的作用是:①使产生的气体全部逸出;_______ 。
(7)根据以上信息,24g镁在足量空气中充分燃烧,得到固体质量可能为__________ 。
A.33.3g B.35g C.39g D.40g
I.铁在中气中燃烧
(1)镁在空气中燃烧,发出耀跟的白光,生成白色粉末状固体。人们将镁粉广泛用于节日焰火,主要是该反应把化学能转化为
【质疑】镁燃烧后得到白色粉末状固体,为什么几乎看不到淡黄色固体?
Ⅱ.镁在二氧化碳中燃烧(如图)

(2)镁在二氧化碳中剧烈燃烧,产生大量白烟,瓶内壁有黑色物质附着,该反应属于
(3)实验可知:燃烧
(4)甲同学认为:由于镁也能与CO2反应,所以不能用“镁燃烧法”来粗略测定空气中氧气含量,你赞成他的说法吗?说明理由。
III.镁在氮气中燃烧
【资料】①
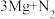

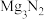 。
。②氮化镁(MgN2)是一种淡黄色粉末,能与水反应。
兴趣小组同学设计如下图实验研究镁在氮气中的燃烧(假设各步反应完全,仅考虑空气中的N2、O2、CO2和水蒸气,不考虑其它成分)。

(5)A中的现象是
(6)C中固体变成暗红色,有大量白烟,冷却后有淡黄色粉末;D中液体变成红色且有白色沉淀,湿润的红色石蕊试纸变蓝,冷却后D中红色褪去。写出D中反应的化学方程式
(7)根据以上信息,24g镁在足量空气中充分燃烧,得到固体质量可能为
A.33.3g B.35g C.39g D.40g
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐1】Ⅰ、探究学习小组在实验室中用图 1 所示装置制取 CO2 并探究CO2 与过氧化钠(Na2O2)的反应。

查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O 发生反应: 2Na2O2+2CO2===2Na2CO3+O2,2Na2O2+2H2O===4NaOH+O2↑。
请回答下列问题:
(1)装置A中发生反应的化学方程式为_____________________ ,利用装置 A 制取 CO2 的优点是 ____ ;
(2)装置B的作用是吸收CO2中混有的HCl,发生反 应 的 化 学 方 程 式 为_________ ;
(3)装置 D 的作用是_________ ;
(4)装置E中收集到的气体是______ (填化学式),该气体还可以用图装置中的 _______ 进行收集(填写字母序号);
Ⅱ、皮蛋是我国传统的蛋制品,深受人们喜爱,由少量 NaCl,CaO 和过量的 Na2CO3 混合得到的粉末状混合物 A 是制皮蛋的配方之一。
(1)某化学兴趣小组从市场获取少量的混合物 A 于烧杯中,缓慢加入足量的蒸馏水,边加边搅拌,静置,过滤得滤液。滤液中含有 Cl- 、OH- ,还含有的阴离子是__________ 。
(2)在混合物 A 中加入少量的 ZnSO4 可改善皮蛋品质,该兴趣小组获得某样品,探究混合物中是否添加了少量的 ZnSO4 。
设计实验方案,完成下述表格。
限选用品与试剂:稀盐酸、pH 试纸、BaCl2 溶液、蒸馏水、AgNO3 溶液
______________ 、 _____________ 、 __________ 、 _____________ 。

查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O 发生反应: 2Na2O2+2CO2===2Na2CO3+O2,2Na2O2+2H2O===4NaOH+O2↑。
请回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)装置B的作用是吸收CO2中混有的HCl,发生反 应 的 化 学 方 程 式 为
(3)装置 D 的作用是
(4)装置E中收集到的气体是

Ⅱ、皮蛋是我国传统的蛋制品,深受人们喜爱,由少量 NaCl,CaO 和过量的 Na2CO3 混合得到的粉末状混合物 A 是制皮蛋的配方之一。
(1)某化学兴趣小组从市场获取少量的混合物 A 于烧杯中,缓慢加入足量的蒸馏水,边加边搅拌,静置,过滤得滤液。滤液中含有 Cl- 、OH- ,还含有的阴离子是
(2)在混合物 A 中加入少量的 ZnSO4 可改善皮蛋品质,该兴趣小组获得某样品,探究混合物中是否添加了少量的 ZnSO4 。
设计实验方案,完成下述表格。
限选用品与试剂:稀盐酸、pH 试纸、BaCl2 溶液、蒸馏水、AgNO3 溶液
实验验操作 | 预期现象和必要结论 |
步骤1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤。 | |
步骤2:取少量步骤1所得的滤液于试管中, 。 |
|
步骤3: 。 | ,说明样品中样品中有ZnSO4; ,说明样品中没样品中有ZnSO4. |
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】化学兴趣小组同学将氢氧化钠溶液滴入硫酸铜溶液进行实验时,观察到产生不同颜色的沉淀,于是对沉淀的成分、性质及产生过程展开探究。
I.氢氧化铜是一种难溶于水的蓝色物质,在80℃时分解生成氧化铜和水;
Ⅱ.碱式硫酸铜【Cu4(OH)6SO4】是一种难溶于水的绿色物质,可溶于酸,在沸水中不分解:
III.硫酸钡是一种难溶于水且难溶于酸的白色物质。
[实验一]检验氢氧化钠溶液与硫酸铜溶液反应产生沉淀的成分。
将反应后的混合物过滤,滤渣经多次洗涤后备用。甲乙两位同学分别取滤渣进行如下图1和图2所示实验。

(1)甲同学观察到图1实验中的滤渣经沸水加热后出现________ 色,证明该滤渣中含有氢氧化铜。写出反应生成氢氧化铜的化学方程式_________________ 。
(2)乙同学观察到图2实验中,滴入BaCl2溶液后产生白色沉淀,认为滤渣中含有_____________ 。
(3)丙同学提出质疑,滴入BaCl2溶液产生白色沉淀,可能是滤渣没有洗净造成的。并设计实验进行验证:取最后一次洗涤液样品于试管中,滴加适量的______________ 溶液,若观察到_____________ ,则证明滤渣已经洗净。
[实验二]利用传感技术揭示氢氧化钠溶液与硫酸铜溶液反应的基本过程。
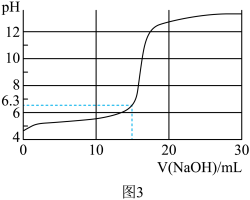
取1.6%的硫酸铜溶液l0mL于烧杯中,逐滴滴入0.4%的氢氧化钠溶液,实验现象如左下表1,用传感器测得烧杯中溶液pH变化如右下图3:
(4)硫酸铜溶液呈_____________ (填“酸”“中”或“碱”)性。
(5)硫酸铜溶液与氢氧化钠溶液反应产生蓝色沉淀的条件是__________________ 。
(6)根据上述表1和图3可推知碱式硫酸铜可以与____________ 发生反应,简述验证该化学性质的实验方案:________________ (写出实验步骤和现象)。
【联想与启示】
(7)反应物种类和反应条件相同时,若反应物的质量比不同,生成物可能不同。试再举一例说明:_________ 。
I.氢氧化铜是一种难溶于水的蓝色物质,在80℃时分解生成氧化铜和水;
Ⅱ.碱式硫酸铜【Cu4(OH)6SO4】是一种难溶于水的绿色物质,可溶于酸,在沸水中不分解:
III.硫酸钡是一种难溶于水且难溶于酸的白色物质。
[实验一]检验氢氧化钠溶液与硫酸铜溶液反应产生沉淀的成分。
将反应后的混合物过滤,滤渣经多次洗涤后备用。甲乙两位同学分别取滤渣进行如下图1和图2所示实验。

(1)甲同学观察到图1实验中的滤渣经沸水加热后出现
(2)乙同学观察到图2实验中,滴入BaCl2溶液后产生白色沉淀,认为滤渣中含有
(3)丙同学提出质疑,滴入BaCl2溶液产生白色沉淀,可能是滤渣没有洗净造成的。并设计实验进行验证:取最后一次洗涤液样品于试管中,滴加适量的
[实验二]利用传感技术揭示氢氧化钠溶液与硫酸铜溶液反应的基本过程。
取1.6%的硫酸铜溶液l0mL于烧杯中,逐滴滴入0.4%的氢氧化钠溶液,实验现象如左下表1,用传感器测得烧杯中溶液pH变化如右下图3:
| 氢氧化钠溶液的体积/mL | 实验现象 | ||
| 绿色沉淀 | 蓝色沉淀 | 上层清液颜色 | |
| 0.00~2.00 | 产生 | 无 | 蓝色 |
| 2.00~15.00 | 增加 | 无 | 浅蓝色 |
| 15.00~18.00 | 减少 | 产生 | 无色 |
| 18.00-20.00 | 更少 | 增加 | 无色 |

(4)硫酸铜溶液呈
(5)硫酸铜溶液与氢氧化钠溶液反应产生蓝色沉淀的条件是
(6)根据上述表1和图3可推知碱式硫酸铜可以与
【联想与启示】
(7)反应物种类和反应条件相同时,若反应物的质量比不同,生成物可能不同。试再举一例说明:
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐3】学习小组的同学在实验室中进行探究实验,请你参与进来:

甲实验中,通过______ 的现象,证明了稀盐酸和氢氧化钙发生了反应。向乙中滴加稀盐酸一段时间后,意外发现溶液中产生了气泡,但溶液的颜色却一直没有发生变化。产生上述现象的原因是______ 。
实验后,小组同学对甲试管中无色溶液的成分产生了浓厚的兴趣,进行了进一步的探究活动。
【提出问题】甲试管中溶质成分是什么?
【猜想与假设】小工的猜想:氯化钙
小附的猜想:氯化钙、氢氧化钙
你的猜想:______ 。
【评价与交流】请对小附同学的猜想进行评价:______ 。
【实验探究】取少量甲中溶液于试管中,加入铁粉,观察到______ 的现象,证明你的猜想正确。
【总结与反思】甲试管中的废液不能直接排放到下水道,同学们想到向废液中加入过量的______ ,既可以使废水达标排放,又能通过一定操作后得到只含一种溶质的溶液。

甲实验中,通过
实验后,小组同学对甲试管中无色溶液的成分产生了浓厚的兴趣,进行了进一步的探究活动。
【提出问题】甲试管中溶质成分是什么?
【猜想与假设】小工的猜想:氯化钙
小附的猜想:氯化钙、氢氧化钙
你的猜想:
【评价与交流】请对小附同学的猜想进行评价:
【实验探究】取少量甲中溶液于试管中,加入铁粉,观察到
【总结与反思】甲试管中的废液不能直接排放到下水道,同学们想到向废液中加入过量的
您最近一年使用:0次





