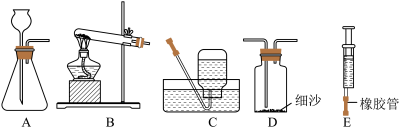
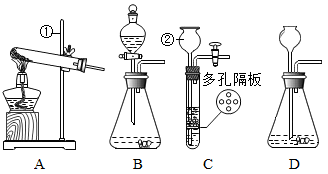
某兴趣小组利用下列所示的仪器进行实验并探究。______ ,若要收集到干燥的氧气,则收集装置为______ (从 A~E 中选择)。
(2)若用 H2O2溶液和 MnO2来制氧气,应选用的发生装置是______ (从 A~E 中选择)。为了证明 MnO2的催化作用,甲同学通过以下装置来进行实验探究:______ 。再通过漏斗加入 4g MnO2,如图 3 所示,此时观察到的现象是______ 。充分反应后,将图 3 的混合液进行过滤、洗涤、干燥、称量,固体仍为 4g,甲同学认为 MnO2是催化剂。
(3)乙同学认为甲同学的结论不严谨,理由是______ 。
(4)图 4 中发生反应的化学方程式为______ 。
(5)小明取氯酸钾(KClO3)和二氧化锰的混合物 20g 放入试管,加热至完全反应后,剩余固体质量为 15.2g,求原混合物中氯酸钾的质量是多少?
(2)若用 H2O2溶液和 MnO2来制氧气,应选用的发生装置是

(3)乙同学认为甲同学的结论不严谨,理由是
(4)图 4 中发生反应的化学方程式为
(5)小明取氯酸钾(KClO3)和二氧化锰的混合物 20g 放入试管,加热至完全反应后,剩余固体质量为 15.2g,求原混合物中氯酸钾的质量是多少?
更新时间:2023/07/09 18:28:28
|
相似题推荐
综合应用题
|
适中
(0.65)
解题方法
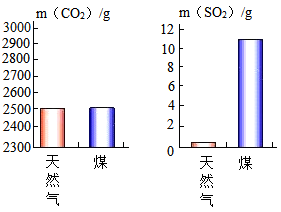
【推荐1】天然气广泛应用于生产生活,其主要成分是甲烷(CH4)。
(1)室温下,充分燃烧1g天然气和1g煤,产生的CO2和SO2气体的质量如下图所示,据图分析,与煤相比,用天然气作燃料的优点有_____ 。 ________ 。
(3)甲烷无氧催化重整可获得碳氢化合物X,X的相对分子质量为106,且碳、氢元素的质量比为48:5,则X的化学式为______ 。
(4)通常用石灰石为原料吸收SO2,发生反应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2,若每天需要吸收0.64t二氧化硫,则该发电厂每个月(按30天计)需要含碳酸钙为90%的石灰石多少t?(杂质不参与反应)
(1)室温下,充分燃烧1g天然气和1g煤,产生的CO2和SO2气体的质量如下图所示,据图分析,与煤相比,用天然气作燃料的优点有
(3)甲烷无氧催化重整可获得碳氢化合物X,X的相对分子质量为106,且碳、氢元素的质量比为48:5,则X的化学式为
(4)通常用石灰石为原料吸收SO2,发生反应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2,若每天需要吸收0.64t二氧化硫,则该发电厂每个月(按30天计)需要含碳酸钙为90%的石灰石多少t?(杂质不参与反应)
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】结合下列装置图回答问题。

(1)写出仪器名称:①________ 。
(2)用氯酸钾和二氧化锰制取氧气,可选用装置_________ (选填序号)和D组合,化学方程式为________ ,二氧化锰的作用是_______ 。
(3)鸡蛋壳的主要成分是碳酸钙,用鸡蛋壳与稀盐酸反应制CO2可用装置B或装置C,装置C相对于B的优点有_______ 。
(4)氨气(NH3)是一种无色有刺激性气味,密度比空气小,极易溶于水的气体。实验室用加热固体氯化铵和消石灰的混合物制取氨气(NH3),可选装置________ (选填序号),用E装置收集氨气,气体应从_________ (选填“a”或“b”)端通入。
(5)将30.9g氯酸钾(KClO3)和二氧化锰的固体混合物装入试管中,加热制取氧气,同时生成氯化钾。待反应完全后,将试管冷却、称量,可以得到21.3g固体物质。请计算原固体混合物中氯酸钾的质量________ 。

(1)写出仪器名称:①
(2)用氯酸钾和二氧化锰制取氧气,可选用装置
(3)鸡蛋壳的主要成分是碳酸钙,用鸡蛋壳与稀盐酸反应制CO2可用装置B或装置C,装置C相对于B的优点有
(4)氨气(NH3)是一种无色有刺激性气味,密度比空气小,极易溶于水的气体。实验室用加热固体氯化铵和消石灰的混合物制取氨气(NH3),可选装置
(5)将30.9g氯酸钾(KClO3)和二氧化锰的固体混合物装入试管中,加热制取氧气,同时生成氯化钾。待反应完全后,将试管冷却、称量,可以得到21.3g固体物质。请计算原固体混合物中氯酸钾的质量
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐3】二氧化碳是碳循环中的重要一员,具有广泛的应用价值。
一、 的制取
的制取
(1)①实验室用块状石灰石和稀盐酸制备 ,该反应的化学方程式为
,该反应的化学方程式为______ ,该实验______ (填“能”或“不能”)使用稀硫酸代替稀盐酸。(已知 微溶于水)
微溶于水)
②下列仪器中,制备并收集 时需选用的是
时需选用的是______ (填字母),仪器C的名称为______ 。 的是
的是______ (填字母)。
A.碱石灰 B.浓硫酸 C.氢氧化钠固体
二、 的性质:
的性质: 可用于灭火
可用于灭火
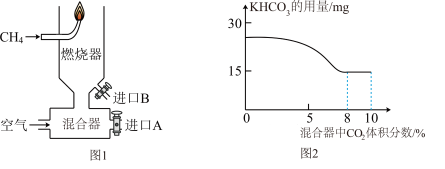
(2)如图1所示,向燃烧器内通入 和空气,点燃,待火焰稳定后,再从进口A分别通入
和空气,点燃,待火焰稳定后,再从进口A分别通入 、
、 、He。改变通入的三种气体用量,测得火焰刚好熄灭时,通入的
、He。改变通入的三种气体用量,测得火焰刚好熄灭时,通入的 、He在混合器中的体积分数如下表所示。
、He在混合器中的体积分数如下表所示。
______ (填化学式)。
(3)研究 与
与 联合使用时的灭火效果。
联合使用时的灭火效果。
① 灭火的原理较复杂。
灭火的原理较复杂。 受热分解时吸收能量,反应的化学方程式为
受热分解时吸收能量,反应的化学方程式为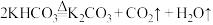 。以初中所学燃烧和灭火的原理分析,
。以初中所学燃烧和灭火的原理分析, 可用于灭火的原因有
可用于灭火的原因有______ 。
②向燃烧器内通入 和空气,点燃,待火焰稳定后,从进口A通入
和空气,点燃,待火焰稳定后,从进口A通入 ,进口B加入
,进口B加入 粉末,控制其他条件不变,测得火焰刚好熄灭时,
粉末,控制其他条件不变,测得火焰刚好熄灭时, 的用量与混合器中通入的
的用量与混合器中通入的 体积分数的关系如图2所示。
体积分数的关系如图2所示。 体积分数在8%~10%,随
体积分数在8%~10%,随 体积分数的增加,使火焰熄灭所需的
体积分数的增加,使火焰熄灭所需的 用量不再减少,且燃烧器内残留的
用量不再减少,且燃烧器内残留的 增多,原因是
增多,原因是______ 。
(4)实验时制取2.2g二氧化碳,至少需要多少10%的稀盐酸溶液?(写出计算过程)
一、
 的制取
的制取(1)①实验室用块状石灰石和稀盐酸制备
 ,该反应的化学方程式为
,该反应的化学方程式为 微溶于水)
微溶于水)②下列仪器中,制备并收集
 时需选用的是
时需选用的是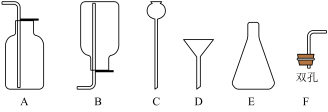
 的是
的是A.碱石灰 B.浓硫酸 C.氢氧化钠固体
二、
 的性质:
的性质: 可用于灭火
可用于灭火(2)如图1所示,向燃烧器内通入
 和空气,点燃,待火焰稳定后,再从进口A分别通入
和空气,点燃,待火焰稳定后,再从进口A分别通入 、
、 、He。改变通入的三种气体用量,测得火焰刚好熄灭时,通入的
、He。改变通入的三种气体用量,测得火焰刚好熄灭时,通入的 、He在混合器中的体积分数如下表所示。
、He在混合器中的体积分数如下表所示。| 气体 |  |  | He |
| 体积分数/% | 17.65 | 27.15 | 23.84 |
(3)研究
 与
与 联合使用时的灭火效果。
联合使用时的灭火效果。①
 灭火的原理较复杂。
灭火的原理较复杂。 受热分解时吸收能量,反应的化学方程式为
受热分解时吸收能量,反应的化学方程式为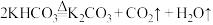 。以初中所学燃烧和灭火的原理分析,
。以初中所学燃烧和灭火的原理分析, 可用于灭火的原因有
可用于灭火的原因有②向燃烧器内通入
 和空气,点燃,待火焰稳定后,从进口A通入
和空气,点燃,待火焰稳定后,从进口A通入 ,进口B加入
,进口B加入 粉末,控制其他条件不变,测得火焰刚好熄灭时,
粉末,控制其他条件不变,测得火焰刚好熄灭时, 的用量与混合器中通入的
的用量与混合器中通入的 体积分数的关系如图2所示。
体积分数的关系如图2所示。 体积分数在8%~10%,随
体积分数在8%~10%,随 体积分数的增加,使火焰熄灭所需的
体积分数的增加,使火焰熄灭所需的 用量不再减少,且燃烧器内残留的
用量不再减少,且燃烧器内残留的 增多,原因是
增多,原因是(4)实验时制取2.2g二氧化碳,至少需要多少10%的稀盐酸溶液?(写出计算过程)
您最近一年使用:0次
综合应用题
|
适中
(0.65)
名校
解题方法
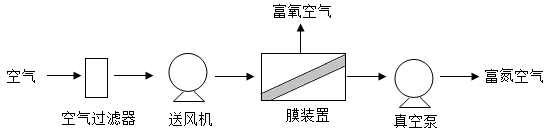
【推荐1】I“温控保鲜”和“气调保鲜”是两类食品保鲜技术。它们通过降低温度和改变气体成分,达到抑制储藏物细胞呼吸的目的。如图所示是工业上用膜分离技术实现“气调保鲜”的流程。_______ (填“富氧空气”或“富氮空气”)。
(2)膜装置内发生的是_______ 变化(填“物理变化”或“化学变化”)。
(3)富氧空气中氧气和其他气体的体积比可能是 (填字母)。
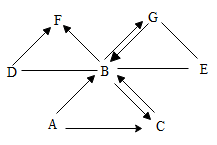
Ⅱ.A一G是初中常见的7种物质。它们有如下图所示的转化关系。其中,“一”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质(反应条件和部分反应物已经略去)。已知A和C是两种组成元素相同的无色液体;B、G是无色气体;E、F是黑色固体;水通电可以产生氧气。请回答下列问题:_______ 、E_______ 。
(5) B可用于_______ 。
(6)请写出下列符号表达式:
①B→F_______ ,反应的基本类型为_______ 。
②G→B可以通过自然界常见的_______ 实现。
(7)鉴别A和C两种无色液体的实验方法为_____ 。
(2)膜装置内发生的是
(3)富氧空气中氧气和其他气体的体积比可能是 (填字母)。
| A.1:3 | B.1:4 | C.1:5 | D.1:6 |
Ⅱ.A一G是初中常见的7种物质。它们有如下图所示的转化关系。其中,“一”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质(反应条件和部分反应物已经略去)。已知A和C是两种组成元素相同的无色液体;B、G是无色气体;E、F是黑色固体;水通电可以产生氧气。请回答下列问题:
(5) B可用于
(6)请写出下列符号表达式:
①B→F
②G→B可以通过自然界常见的
(7)鉴别A和C两种无色液体的实验方法为
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
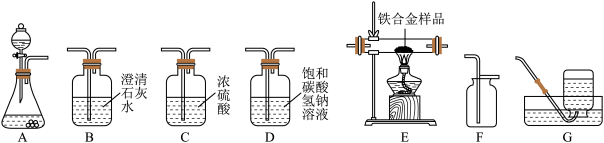
【推荐2】如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器,假设发生的化学反应都充分反应),某化学小组的同学欲利用其进行下列实验。
①所选仪器的连接顺序为___ (从左到右填写仪器序号字母)。
②上述方法制取二氧化碳的化学方程式为___ 。
(2)小玲同学在实验室中以过氧化氢溶液为原料(二氧化锰作催化剂)制取氧气,并测定某铁合金样品中碳元素的质量分数(资料显示铁合金主要含铁、碳两种元素,假设其他杂质成分不参加反应),设计方案,所选仪器的连接顺序为A→C→B→B碱石灰干燥管。
①装置A中用过氧化氢溶液和MnO2制取氧气的化学方程式为___ 。
②若装置E中放入1.0g铁合金样品粉末,充分反应后,测得装置B中生成白色沉淀0.2g,则该铁合金样品中碳元素的质量分数为___ (结果精确至0.1%),该铁合金样品应属于 ___ (选填“生铁”或“钢”之一)。(已知:生铁含碳量2.0%~4.3%,钢含碳量0.03%~2.0%)。
(3)因发现青蒿素而获诺贝尔奖的科学家屠呦呦及其团队还发现了双氢青蒿素。查阅资料可知,双氢青蒿素由碳、氢、氧三种元素组成。为测定双氢青蒿素的元素组成。某化学兴趣小组进行了以下探究。
【设计实验】兴趣小组设计并进行了如图所示的实验,加热前通入空气一段时间。(装置气密性良好)
①装置a、b中盛放的试剂分别是___ (填选项序号)。
A.足量NaOH溶液、足量浓硫酸 B.足量浓硫酸、足量NaOH溶液
【记录数据】加热前,先通入空气一段时间,再分别称量装置d、装置e的质量(反应前的质量)。双氢青蒿素完全反应后,停止加热,继续通入空气一段时间,再次分别称量装置d、装置e的质量(反应后的质量),实验数据如表所示。
【实验结论】②根据表中数据分析,双氢青蒿素中碳、氢两种元素的质量比是 ___ (填最简整数比)。
【拓展分析】③双氢青蒿素分子中氢、氧原子的个数比是___ (填最简整数比)。
①所选仪器的连接顺序为
②上述方法制取二氧化碳的化学方程式为
(2)小玲同学在实验室中以过氧化氢溶液为原料(二氧化锰作催化剂)制取氧气,并测定某铁合金样品中碳元素的质量分数(资料显示铁合金主要含铁、碳两种元素,假设其他杂质成分不参加反应),设计方案,所选仪器的连接顺序为A→C→B→B碱石灰干燥管。
①装置A中用过氧化氢溶液和MnO2制取氧气的化学方程式为
②若装置E中放入1.0g铁合金样品粉末,充分反应后,测得装置B中生成白色沉淀0.2g,则该铁合金样品中碳元素的质量分数为
(3)因发现青蒿素而获诺贝尔奖的科学家屠呦呦及其团队还发现了双氢青蒿素。查阅资料可知,双氢青蒿素由碳、氢、氧三种元素组成。为测定双氢青蒿素的元素组成。某化学兴趣小组进行了以下探究。
【设计实验】兴趣小组设计并进行了如图所示的实验,加热前通入空气一段时间。(装置气密性良好)
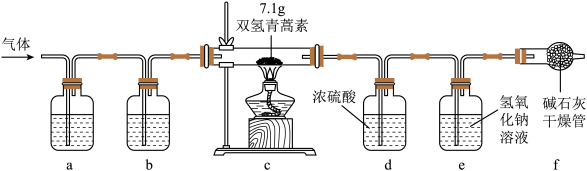
①装置a、b中盛放的试剂分别是
A.足量NaOH溶液、足量浓硫酸 B.足量浓硫酸、足量NaOH溶液
【记录数据】加热前,先通入空气一段时间,再分别称量装置d、装置e的质量(反应前的质量)。双氢青蒿素完全反应后,停止加热,继续通入空气一段时间,再次分别称量装置d、装置e的质量(反应后的质量),实验数据如表所示。
| 装置 | 反应前的质量/g | 反应后的质量/g |
| d | 84.7 | 90.1 |
| e | 90.3 | 106.8 |
【拓展分析】③双氢青蒿素分子中氢、氧原子的个数比是
您最近一年使用:0次
【推荐3】下图是实验室常用制备气体的装置。________ 。小李同学在用加热高锰酸钾并用排水法收集氧气的实验过程中,发现收集装置中的水慢慢变成紫红色了,他仔细思考发现反应装置中缺少_______ 。
(2)氧气收集完成后,测得其纯度明显偏低,原因可能是 (填字母,可多选)。
(3)若用装置G收集氧气,气体应从_______ (填“a”或“b”)端通入。若瓶中装满水,则气体应从_______ (填“a”或“b”)端通入。
(4)实验室利用过氧化氢溶液制取氧气,实验过程中能获得平稳的氧气流,应选用的发生装置是________ ,写出该反应的文字表达式________ 。若用D装置收集生成的氧气,如何验满:________ 。
(5)若收集一瓶氧气,供铁丝在氧气中燃烧的实验,最好选用气体的收集装置中的_______ (填序号)。
(6)某兴趣小组设计如下表所示的对比实验来比较MnO2、CuO对过氧化氢分解的催化效果,所用实验装置如图所示。
①MnO2、CuO都能做反应的催化剂,则两者在化学反应前后_______ 和_______ 均不发生改变。
②实验需要测量并记录的数据有:氧气体积和________ 。
③实验时,分别将过氧化氢溶液一次性注入盛有催化剂的小试管中,测量并记录数据,实验过程中发现U型管内右测液面上升,原因是_______ 。
④结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是________ 。

(2)氧气收集完成后,测得其纯度明显偏低,原因可能是 (填字母,可多选)。
| A.高锰酸钾中混入了二氧化锰 | B.收集前,集气瓶中未注满水 |
| C.收集后,集气瓶中仍有少量水 | D.未见气泡连续均匀冒出时就开始收集 |
(4)实验室利用过氧化氢溶液制取氧气,实验过程中能获得平稳的氧气流,应选用的发生装置是
(5)若收集一瓶氧气,供铁丝在氧气中燃烧的实验,最好选用气体的收集装置中的
(6)某兴趣小组设计如下表所示的对比实验来比较MnO2、CuO对过氧化氢分解的催化效果,所用实验装置如图所示。
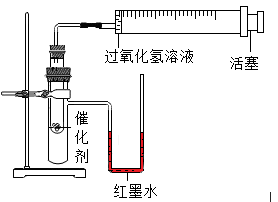
| 实验序号 | 过氧化氢溶液 | 催化剂 |
| 实验1 | 5mL 4% | 粉末状MnO2 0.2g |
| 实验2 | 5mL 4% | 粉末状CuO 0.2g |
②实验需要测量并记录的数据有:氧气体积和
③实验时,分别将过氧化氢溶液一次性注入盛有催化剂的小试管中,测量并记录数据,实验过程中发现U型管内右测液面上升,原因是
④结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐1】小明同学利用下列五种装置探究气体制取,请你参与小明同学研究,并回答下列问题:
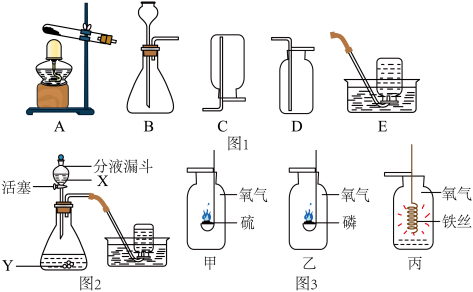
(1)指出上述有编号的仪器名称:①________ ,②________ .
(2)小明用加热氯酸钾和二氧化锰制取氧气,气体检验时,发现“用带火星的木条伸入集气瓶内,木条不会复燃”请你帮小明找出导致这种现象的原因________ (写一个).写出加热氯酸钾和二氧化锰制取氧气的化学方程式为:________ .
(3)用加热高锰酸钾制取氧气,可选用________ 装置(填编号,下同),该装置不足的地方是______ ,收集O2可选用______ 装置,写出用加热高锰酸钾制取氧气的化学方程式为:______ .用高锰酸钾制取氧气时有如下操作步骤:①点燃酒精灯,②检查装置的气密性,③装药品,④用排水集气法收集,⑤把导气管撤离水面,⑥熄灭酒精灯,⑦连接仪器,⑧把试管固定在铁架台上.请你帮小明排出正确的操作顺序________ .(将正确的答案填在横线上)
A②⑦③⑧①④⑥⑤ B⑦②③⑧①④⑤⑥
C⑤⑦⑧③②①④⑥ D⑦③①⑧②④⑥⑤
(4)小明若用金属锌和稀硫酸制取氢气,他选用________ 作反应装置(填A或B),该装置的气密性检查方法是________ .
(5)小明同学选用图2的装置制取氧气,你知道小明加入的药品中:
①X是________ ,Y是________ ;
②刚产生的气体不宜马上收集的原因:________ .
(6)小明同学利用此方法制出的氧气进行了如图3的氧气性质探究活动.现请你根据右下图所发生的化学反应现象及化学反应原理,帮助小杰同学总结归纳出三个共同点,分别是:
①________ ;
②________ ;
③________ .

(1)指出上述有编号的仪器名称:①
(2)小明用加热氯酸钾和二氧化锰制取氧气,气体检验时,发现“用带火星的木条伸入集气瓶内,木条不会复燃”请你帮小明找出导致这种现象的原因
(3)用加热高锰酸钾制取氧气,可选用
A②⑦③⑧①④⑥⑤ B⑦②③⑧①④⑤⑥
C⑤⑦⑧③②①④⑥ D⑦③①⑧②④⑥⑤
(4)小明若用金属锌和稀硫酸制取氢气,他选用
(5)小明同学选用图2的装置制取氧气,你知道小明加入的药品中:
①X是
②刚产生的气体不宜马上收集的原因:
(6)小明同学利用此方法制出的氧气进行了如图3的氧气性质探究活动.现请你根据右下图所发生的化学反应现象及化学反应原理,帮助小杰同学总结归纳出三个共同点,分别是:
①
②
③
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】某研究性学习小组利用下列装置进行气体的制取实验,请分析回答下列问题。

(1)写出标号①仪器的名称________ 。
(2)B装置中长颈漏斗下端管口必须伸入液面下的原因是________ 。
(3)若用水将装置F中的氧气排出,水从_________ 端通入。(填字母)
(4)A、E连接,制取的氧气不纯的原因是___________ (写一点即可)。
(5)氨气是一种无色气体,密度比空气的小,极易溶于水,有刺激性气味。加热氯化铵和熟石灰的固体混合物可制取氨气。应选用装置________ (填字母序号)所示方法收集氨气。
(6)实验室有一瓶含杂质的氯酸钾(杂质不参加反应)。某同学用A发生装置来制氧气,实验数据记录如下:

请回答下列问题:
①写出该反应的化学方程式________ 。
②a=________ 。
③计算受热分解的氯酸钾的质量________ (精确到0.1g)。

(1)写出标号①仪器的名称
(2)B装置中长颈漏斗下端管口必须伸入液面下的原因是
(3)若用水将装置F中的氧气排出,水从
(4)A、E连接,制取的氧气不纯的原因是
(5)氨气是一种无色气体,密度比空气的小,极易溶于水,有刺激性气味。加热氯化铵和熟石灰的固体混合物可制取氨气。应选用装置
(6)实验室有一瓶含杂质的氯酸钾(杂质不参加反应)。某同学用A发生装置来制氧气,实验数据记录如下:

请回答下列问题:
①写出该反应的化学方程式
②a=
③计算受热分解的氯酸钾的质量
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐3】结合图示实验装置,回答下列问题。______ ,②__________ 。
(2)常温下块状电石与水剧烈反应生成乙炔(C2H2)气体,已知乙炔难溶于水。实验室要用该反应制取乙炔气体,选用的发生和收集装置是________ (填装置序号)。
(3)如用H装置收集CO2,气体应从____ (填“a”或“b”)通入,验满的方法是_____ 。
(4)实验室用A制取氧气,反应的化学方程式为__________ ,实验室制取氢气可选用D装置,也可用C装置替代,选用C装置的优点是_________ 。
(5)实验室用碳酸钙与稀盐酸制取二氧化碳,若制取二氧化碳2.2g,需要碳酸钙的质量是____ ?(在答题卡上写出计算过程)

(2)常温下块状电石与水剧烈反应生成乙炔(C2H2)气体,已知乙炔难溶于水。实验室要用该反应制取乙炔气体,选用的发生和收集装置是
(3)如用H装置收集CO2,气体应从
(4)实验室用A制取氧气,反应的化学方程式为
(5)实验室用碳酸钙与稀盐酸制取二氧化碳,若制取二氧化碳2.2g,需要碳酸钙的质量是
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐1】观察与思考:
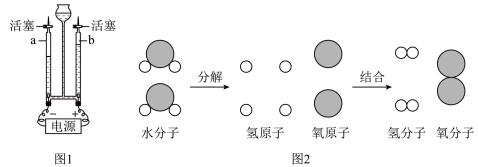
(1)图1是水电解的实验装置图,其中a管产生的气体是_____ ;该实验说明了水是由_____ 组成的。也能得到相同结论的实验是_____ 。
(2)图2是水电解过程的微观模拟示意图。试分析在化学变化前后一定不变的是_____。
联想与启示:
(3)水电解过程中发生反应的化学方程式为_____ 。
(4)自然界的水因含有多种杂质而不能直接饮用。需要经过自来水厂处理后才能饮用,目前很多自来水厂用氯气进行消毒,消毒过程中发生的化学反应可用如图微观模拟示意图表示:写出图3中所示反应的化学方程式_____ 。
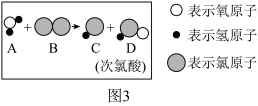
拓展与探究
化学兴趣小组的同学对氯气的制取、性质进行如下探究
【查阅资料】
①氯气通常情况下为黄绿色、有刺激性气味的有毒气体。难溶于饱和食盐水、化学性质很活泼,能与多种金属和非金属直接化合,还能与水、碳等化合物反应;与氢氧化钠溶液反应可表为: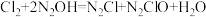
②氯气可用于消毒、杀菌、漂白等
③实验室常用二氧化锰固体和浓盐酸加热制取氯气,化学反应方程式为
【探究一】制取氯气
在老师的指导下,同学们设计了如图实验装置制取并收集氯气,试回答下列问题
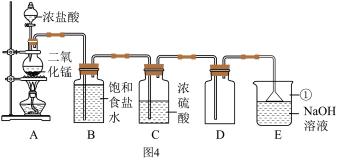
(5)图中仪器①的名称是_____ 。
(6)B装置的作用是_____ 。
(7)D装置用于收集氯气。可知氯气还具有的物理性质是_____ 。
【探究二】氯气的化学性质
(8)用图一装置探究氯气的漂白性:
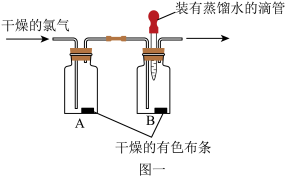
实验步骤:
I.将滴管内的蒸馏水滴到B瓶中的干燥有色布条上,布条没有褪色;
Ⅱ.通入干燥的Cl2.发现A瓶中的布条没有褪色,而B瓶的布条褪色
①通过上述实验,小明能得到的结论是_____ 。
②小颖根据资料信息(即氯气与水反应的原理),做了一个补充实验:(写出实验步骤和现象)_____ 。
从而得出“次氯酸具有漂白性”的结论。
③小明同学认为,图一实验装置中有一个明显的缺陷是_____ 。
(9)用图二装置探究氯气的助燃性:
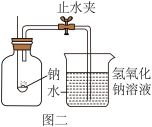
实验步骤:
I.在燃烧匙中放入一小块金属钠。将乳胶管上的止水夹夹紧;
Ⅱ.把燃烧匙中的金属钠放在酒精灯火焰上点燃,并迅速伸入装有气的集气瓶中。塞紧橡皮塞
Ⅲ.待冷却后打开止水夹
①钠在氯气中燃烧产生大量白烟,该白烟是_____ (填物质名称)。
②实验反思:通过金属钠能在氯气中燃烧的实验,你对燃烧有什么新的认识:_____ 。

(1)图1是水电解的实验装置图,其中a管产生的气体是
(2)图2是水电解过程的微观模拟示意图。试分析在化学变化前后一定不变的是_____。
| A.元素种类 | B.分子种类 | C.原子种类 | D.分子数目 | E.原子数目 | F.元素的化合价 |
联想与启示:
(3)水电解过程中发生反应的化学方程式为
(4)自然界的水因含有多种杂质而不能直接饮用。需要经过自来水厂处理后才能饮用,目前很多自来水厂用氯气进行消毒,消毒过程中发生的化学反应可用如图微观模拟示意图表示:写出图3中所示反应的化学方程式

拓展与探究
化学兴趣小组的同学对氯气的制取、性质进行如下探究
【查阅资料】
①氯气通常情况下为黄绿色、有刺激性气味的有毒气体。难溶于饱和食盐水、化学性质很活泼,能与多种金属和非金属直接化合,还能与水、碳等化合物反应;与氢氧化钠溶液反应可表为:
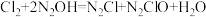
②氯气可用于消毒、杀菌、漂白等
③实验室常用二氧化锰固体和浓盐酸加热制取氯气,化学反应方程式为

【探究一】制取氯气
在老师的指导下,同学们设计了如图实验装置制取并收集氯气,试回答下列问题

(5)图中仪器①的名称是
(6)B装置的作用是
(7)D装置用于收集氯气。可知氯气还具有的物理性质是
【探究二】氯气的化学性质
(8)用图一装置探究氯气的漂白性:

实验步骤:
I.将滴管内的蒸馏水滴到B瓶中的干燥有色布条上,布条没有褪色;
Ⅱ.通入干燥的Cl2.发现A瓶中的布条没有褪色,而B瓶的布条褪色
①通过上述实验,小明能得到的结论是
②小颖根据资料信息(即氯气与水反应的原理),做了一个补充实验:(写出实验步骤和现象)
从而得出“次氯酸具有漂白性”的结论。
③小明同学认为,图一实验装置中有一个明显的缺陷是
(9)用图二装置探究氯气的助燃性:

实验步骤:
I.在燃烧匙中放入一小块金属钠。将乳胶管上的止水夹夹紧;
Ⅱ.把燃烧匙中的金属钠放在酒精灯火焰上点燃,并迅速伸入装有气的集气瓶中。塞紧橡皮塞
Ⅲ.待冷却后打开止水夹
①钠在氯气中燃烧产生大量白烟,该白烟是
②实验反思:通过金属钠能在氯气中燃烧的实验,你对燃烧有什么新的认识:
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐2】通过半年的化学学习,你已经掌握了实验室制取气体的有关规律,以下是老师提供的一些实验装置。请结合下图回答问题:
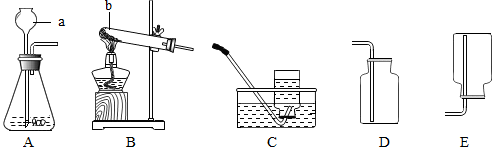
(1)写出图中标号的仪器名称:b_________ 。
(2)写出实验室用A装置制取CO2的化学方程式:_______ 。
(3)通过查阅资料得知:①氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水,氨水能使无色酚酞变红;②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体。小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生装置是_________ ,收集装置是__________ 。(填字母编号)
(4)小芳将收集满氨气的集气瓶倒扣在滴有无色酚酞的水中,观察到的现象是_________ ,_________ 。
(5)请写出氨气和氧化铜反应的化学方程式___________ 。
(6)实验室用大理石与盐酸反应制取二氧化碳,如果消耗了25g含80%碳酸钙的石灰石(杂质不与酸反应),问可生成多少克二氧化碳___________ ?

(1)写出图中标号的仪器名称:b
(2)写出实验室用A装置制取CO2的化学方程式:
(3)通过查阅资料得知:①氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水,氨水能使无色酚酞变红;②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体。小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生装置是
(4)小芳将收集满氨气的集气瓶倒扣在滴有无色酚酞的水中,观察到的现象是
(5)请写出氨气和氧化铜反应的化学方程式
(6)实验室用大理石与盐酸反应制取二氧化碳,如果消耗了25g含80%碳酸钙的石灰石(杂质不与酸反应),问可生成多少克二氧化碳
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐3】为了制取氧气,实验室提供了以下药品和仪器装置。
【药品】①二氧化锰 ②氯酸钾 ③过氧化氢溶液 ④高锰酸钾
【装置】
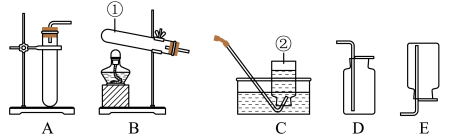
(1)、写出标号仪器的名称:①___________ ;②___________ 。
(2)、实验室用高锰酸钾制取氧气,装置B还需做的一点改动是___________ ,反应化学方程式为___________ 。
(3)、实验室用加热氯化铵和氢氧化钙固体混合物的方法制取氨气(注:同温同压下,氨气的密度接近于空气密度的60%,且极易溶于水),制取氨气的发生装置为___________ (填装置编号),选取的理由是___________ 。
(4)、实验室常用石灰石和稀盐酸制取二氧化碳,其反应的化学方程式为:___________ 。
(5)、将30.9g氯酸钾和二氧化锰的固体混合物装入试管中,加热制取氧气,待反应完全后将试管冷却,称量得到21.3g固体物质,请计算原固体混合物中氯酸钾的质量_________ 。
【药品】①二氧化锰 ②氯酸钾 ③过氧化氢溶液 ④高锰酸钾
【装置】

(1)、写出标号仪器的名称:①
(2)、实验室用高锰酸钾制取氧气,装置B还需做的一点改动是
(3)、实验室用加热氯化铵和氢氧化钙固体混合物的方法制取氨气(注:同温同压下,氨气的密度接近于空气密度的60%,且极易溶于水),制取氨气的发生装置为
(4)、实验室常用石灰石和稀盐酸制取二氧化碳,其反应的化学方程式为:
(5)、将30.9g氯酸钾和二氧化锰的固体混合物装入试管中,加热制取氧气,待反应完全后将试管冷却,称量得到21.3g固体物质,请计算原固体混合物中氯酸钾的质量
您最近一年使用:0次



