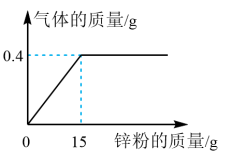
小丽同学为了测定黄铜样品中铜的质量分数,进行了如下实验。请回答下列问题:
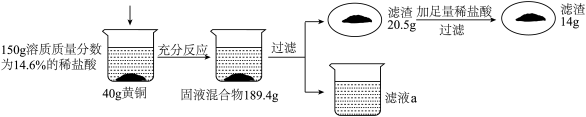
(1)上述实验过程中发生反应的化学方程式为________ 。
(2)列出求解第一次加入稀盐酸后黄铜中参加反应的锌的质量(x)的比例式________ 。
(3)此黄铜中铜的质量分数为________ 。
(4)若将反应后的滤液a加入31.1g水,所得溶液中氯化锌的质量分数为________ 。
(5)若要生产该黄铜320t,需要含杂质20%的辉铜矿的质量为________ 。

(1)上述实验过程中发生反应的化学方程式为
(2)列出求解第一次加入稀盐酸后黄铜中参加反应的锌的质量(x)的比例式
(3)此黄铜中铜的质量分数为
(4)若将反应后的滤液a加入31.1g水,所得溶液中氯化锌的质量分数为
(5)若要生产该黄铜320t,需要含杂质20%的辉铜矿的质量为
更新时间:2023/11/03 09:20:48
|
相似题推荐
计算题
|
较难
(0.4)
解题方法
【推荐1】为测定某敞口放置的氢氧化钠溶液的变质情况,某同学实验并记录如图:

(1)D烧杯溶液中溶质的化学式为_____;
(2)求100g样品溶液中碳酸钠的质量?(简要写出计算过程)

(1)D烧杯溶液中溶质的化学式为_____;
(2)求100g样品溶液中碳酸钠的质量?(简要写出计算过程)
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐2】小宇同学在实验室里将16g高锰酸钾放在试管里加热制取氧气,反应一段时间后,他称得剩余固体物质的质量为14.4g,通过计算回答:
(1)生成氧气的质量为多少克?
(2)高锰酸钾是否完全参加反应.
(1)生成氧气的质量为多少克?
(2)高锰酸钾是否完全参加反应.
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐3】已知胃酸的主要成分是盐酸,能与含有碳酸钙的补钙剂发生化学反应。如图2为某钙片的商品标签,为测定钙片中钙元素的质量分数(假设钙片中其他物质不含钙元素,且不溶于水,也不与任何物质发生反应),某化学兴趣小组取20片钙片,进行如下实验:_________ 。
(2)上述实验过程中产生气体的质量为_____ g。
(3)计算钙片中钙元素的质量分数(写出计算过程)。
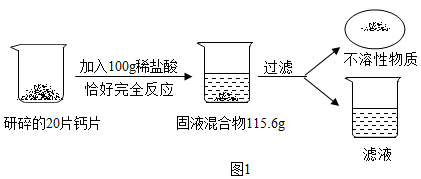
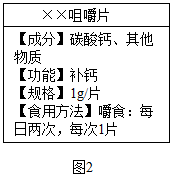
(2)上述实验过程中产生气体的质量为
(3)计算钙片中钙元素的质量分数(写出计算过程)。
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】某兴趣小组测定石灰石中碳酸钙的含量。现取12g石灰石样品,放入烧杯中,然后向其中加入73g稀盐酸,充分反应。(石灰石中的杂质都不溶于水,且不与稀盐酸反应)。测得烧杯中的反应剩余物的质量为80.6g。试求:
(1)产生二氧化碳的质量为_____。
(2)该样品中碳酸钙的质量分数_____(结果保留0.1%)
(3)反应后所得溶液的溶质质量分数_____。(结果保留0.1%)
(1)产生二氧化碳的质量为_____。
(2)该样品中碳酸钙的质量分数_____(结果保留0.1%)
(3)反应后所得溶液的溶质质量分数_____。(结果保留0.1%)
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐2】碳酸氢钠固体受热易分解生成一种盐和两种氧化物,反应的化学方程式为______ ;将10g碳酸钠和碳酸氢钠的混合物充分加热至固体的质量不再改变,冷却,称量剩余固体的质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为______ 。
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐3】某钢铁厂实验室为测定赤铁矿中Fe2O3的含量,将矿石粉碎(其中杂质不溶于水,不与酸反应),进行如下实验,第一步反应的稀硫酸与生成的硫酸铁之间的质量关系如坐标图所示:
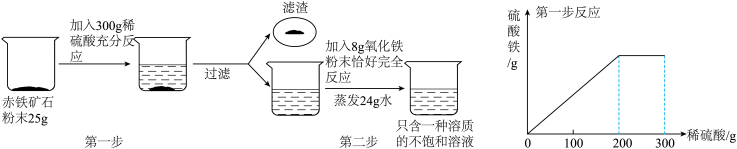
(1)上述实验过程中发生反应的化学方程式为_____________ ;
(2)根据已知条件列出求解第二步实验溶液中参加反应的物质质量(x)的比例式_____________ ;
(3)若用98%的浓酸硫配制实验所需的稀硫酸,则需要加水的质量为________ ;
(4)赤铁矿样品中Fe2O3的含量___________ ;
(5)在第二步实验结束后所得溶液中溶质的质量分数是________ ;
(6)该钢铁厂每天用上述赤铁矿石1800t来生产生铁,则理论上日产含杂质4%的生铁的质量为__________ 。

(1)上述实验过程中发生反应的化学方程式为
(2)根据已知条件列出求解第二步实验溶液中参加反应的物质质量(x)的比例式
(3)若用98%的浓酸硫配制实验所需的稀硫酸,则需要加水的质量为
(4)赤铁矿样品中Fe2O3的含量
(5)在第二步实验结束后所得溶液中溶质的质量分数是
(6)该钢铁厂每天用上述赤铁矿石1800t来生产生铁,则理论上日产含杂质4%的生铁的质量为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】黄铜是一种重要的金属材料,它是铜和锌的合金,外观很像黄金。为了测定黄铜样品的组成,某兴趣小组取五份样品分别加稀硫酸反应,其实验数据记录如表。
按要求完成下列问题:
(1)根据实验数据分析,第5份样品,___________ 有剩余。
(2)该样品中铜的质量为___________ g。
(3)恰好完全反应时所得溶液中溶质的质量分数为___________ 。(精确到0.1%)
(4)计算实验所用稀硫酸的溶质质量分数。(写出计算过程)
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
| 黄铜样品质量/g | 20 | 20 | 20 | 20 | 20 |
| 稀硫酸质量/g | 25 | 50 | 75 | 100 | 125 |
| 产生气体质量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.4 |
(1)根据实验数据分析,第5份样品,
(2)该样品中铜的质量为
(3)恰好完全反应时所得溶液中溶质的质量分数为
(4)计算实验所用稀硫酸的溶质质量分数。(写出计算过程)
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐2】为测定生铁中铁的含量,现将一定质量的生铁样品放入一定质量的稀硫酸中,恰好完全反应生成0.2g气体,生铁中的杂质不溶于水,也不与稀硫酸反应,反应后过滤,将所得的固体洗涤、干燥后称量为l.4g。请回答下列问题:
(1)写出上述反应的化学方程式_____。
(2)求解生铁样品中铁的质量(x)的比例式_____。
(3)该生铁中铁的含量为_____。
(4)某炼钢厂每天需消耗5000t含Fe2O376%的赤铁矿,该厂理论上可日产含Fe 98%的生铁的质量是多少?
(1)写出上述反应的化学方程式_____。
(2)求解生铁样品中铁的质量(x)的比例式_____。
(3)该生铁中铁的含量为_____。
(4)某炼钢厂每天需消耗5000t含Fe2O376%的赤铁矿,该厂理论上可日产含Fe 98%的生铁的质量是多少?
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】某化学兴趣小组为了测定当地的石灰石中的CaCO3的质量分数,他们做了如下实验:取24克样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用稀盐酸的质量与剩余固体的质量关系如图所示,请根据图中的数据进行计算:(方程式: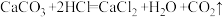 )
)______ 克。
(2)当稀盐酸加到______ 克时,样品与稀盐酸恰好完全反应,当盐酸加到100克时,溶液中的溶质为______ 。(写化学式)
(3)求所用稀盐酸中溶质的质量分数。(请根据化学方程式写出完整的计算步骤)
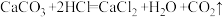 )
)
(2)当稀盐酸加到
(3)求所用稀盐酸中溶质的质量分数。(请根据化学方程式写出完整的计算步骤)
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐2】向一定量的H2SO4和CuSO4的混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图所示。
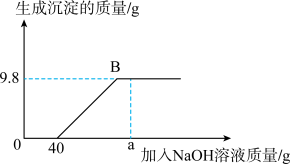
(1)当加入NaOH溶液质量为a g时,溶液中存在的微粒有(写微粒符号)______ 。
(2)上述实验中与硫酸铜反应的NaOH溶液的质量(写出计算过程,下同)。
(3)原混合溶液中溶质硫酸的质量。

(1)当加入NaOH溶液质量为a g时,溶液中存在的微粒有(写微粒符号)
(2)上述实验中与硫酸铜反应的NaOH溶液的质量(写出计算过程,下同)。
(3)原混合溶液中溶质硫酸的质量。
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐3】鸡蛋壳的主要成分是碳酸钙。某兴趣小组的同学为了测碳酸钙的质量分数,将鸡蛋壳洗净、干燥、捣碎,进行了如下实验(假设蛋壳中其它杂质不与盐酸反应):
①在三个烧杯中都加入了10g样品;
②向三个烧杯中加入质量不等相同浓度的稀盐酸;
③记录产生气体的质量。实验数据如下:
回答下列问题:
(1)样品中碳酸钙完全反应时,得到气体的质量为 g。
(2)烧杯Ⅲ反应后所得溶液中,溶质质量分数是多少?
①在三个烧杯中都加入了10g样品;
②向三个烧杯中加入质量不等相同浓度的稀盐酸;
③记录产生气体的质量。实验数据如下:
| 实验 | 加入稀盐酸的质量/g | 气体质量/g |
| 烧杯I | 36.5 | 2.2 |
| 烧杯II | 73 | 3.52 |
| 烧杯III | 100 | 3.52 |
回答下列问题:
(1)样品中碳酸钙完全反应时,得到气体的质量为 g。
(2)烧杯Ⅲ反应后所得溶液中,溶质质量分数是多少?
您最近一年使用:0次