某化学学习小组对泡腾片的成分和原理产生了兴趣。某品牌维生素C泡腾片部分标签如图所示,据此回答问题。
(1)碳酸氢钠(NaHCO3)属于_______ (填“酸”“碱”或“盐”)。
(2)取泡腾片溶于水,滴加紫色石蕊试剂,溶液变红﹐说明溶液pH______ 7(填“>”“<”或“=”)。
(3)泡腾片溶于水时闻到“橙味”香气,从微观角度解释其原因是______ 。
【任务二】测定柠檬酸的含量
(4)碳酸氢钠(NaHCO3)与柠檬酸(C6H8O7,相对分子质量为192)发生的反应为:3NaHCO3+ C6H8O7=Na3C6H5O7+3H2O+3CO2↑。该小组将4g泡腾片投入蒸馏水,反应过程中,相关测量数据如下表。根据化学方程式计算该品牌泡腾片中柠檬酸的质量分数。(假设泡腾片中的NaHCO3完全参与反应,其他物质均不产生气体)

(1)碳酸氢钠(NaHCO3)属于
(2)取泡腾片溶于水,滴加紫色石蕊试剂,溶液变红﹐说明溶液pH
(3)泡腾片溶于水时闻到“橙味”香气,从微观角度解释其原因是
【任务二】测定柠檬酸的含量
(4)碳酸氢钠(NaHCO3)与柠檬酸(C6H8O7,相对分子质量为192)发生的反应为:3NaHCO3+ C6H8O7=Na3C6H5O7+3H2O+3CO2↑。该小组将4g泡腾片投入蒸馏水,反应过程中,相关测量数据如下表。根据化学方程式计算该品牌泡腾片中柠檬酸的质量分数。(假设泡腾片中的NaHCO3完全参与反应,其他物质均不产生气体)
| 反应时间/min | 0 | t1 | t2 | t3 | t4 |
| 锥形瓶及瓶内物质总质量/g | 250.00 | 249.68 | 249.48 | 249.34 | 249.34 |
更新时间:2024-05-09 09:49:20
|
相似题推荐
综合应用题
|
适中
(0.65)
解题方法
【推荐1】环保石头纸的主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂。
【实验一】 探究影响石头纸与盐酸反应快慢的因素
(1)甲、乙两同学设计实验如下:
【实验二】 测定石头纸中碳酸钙的质量分数 提示:石头纸中其他成分均不与盐酸反应,也不溶于水。
(2)甲组同学:图Ⅰ为石头纸与稀盐酸反应的装置,图Ⅱ用于测量通常状况下CO2的体积。
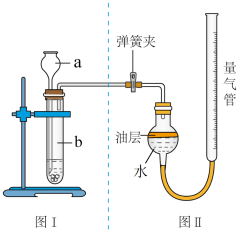
①实验前首先要_____ ;
② 图Ⅱ装置中油层的作用是_____ ;
③ 反应完成后,先
④根据V CO2和ρCO2计算出CO2的质量,计算碳酸钙质量。
(3)乙组同学:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。
通过对数据的分析和比较,回答下列有关问题
①在第_____ 份样品的实验中,样品中碳酸钙完全反应了; 。
② m的值为_____
③石头纸样品中碳酸钙的质量分数是多少_____ ?(请写出计算过程)
【实验一】 探究影响石头纸与盐酸反应快慢的因素
(1)甲、乙两同学设计实验如下:
| 甲 | 乙 | |
| 实验过程 |  | 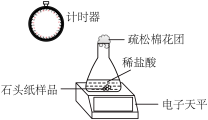 |
| 现象 | 试管①、②、③中产生气泡快慢的顺序为:①>②>③。 | |
| 分析结论 | Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 Ⅱ 对比甲同学实验①②可知, Ⅲ 对比甲同学实验 Ⅳ 乙同学的实验中,应该连续记录的实验数据是 | |
(2)甲组同学:图Ⅰ为石头纸与稀盐酸反应的装置,图Ⅱ用于测量通常状况下CO2的体积。

①实验前首先要
② 图Ⅱ装置中油层的作用是
③ 反应完成后,先
④根据V CO2和ρCO2计算出CO2的质量,计算碳酸钙质量。
(3)乙组同学:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。
| 第1份 | 第2份 | 第3份 | 第4份 | |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |
①在第
② m的值为
③石头纸样品中碳酸钙的质量分数是多少
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】化石燃料的燃烧、硫酸的生产都会产生二氧化硫,二氧化硫被雨水吸收后会形成酸雨,使农作物、建筑材料等遭到破坏。我国环境空气质量标准对空气中SO2的最高浓度进行了限定,其中一级标准为0.15 mg/mL。
(1)通过测定雨水的_______ 可粗略判断其是否为酸雨。
(2)测定某工业废气中 的含量。兴趣小组同学利用如图所示装置进行实验,步骤如下。
的含量。兴趣小组同学利用如图所示装置进行实验,步骤如下。
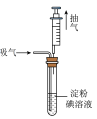
已知:SO2+I2+2H2O=H2SO4+2HI(无色溶液)。常温下,碘微溶于水,加入碘化钾可促进碘的溶解,增加SO2吸气的吸收量。
废气中的其他成分不与淀粉碘溶液反应。
步骤1:称取1.27g碘单质(I2),加入少量碘化钾,加水配制成1000mL溶液;
步骤2:取5mL上述溶液于试管中,滴入2~3滴淀粉试液,溶液变蓝;
步骤3:将注射器的活塞推到底后,插入试管的橡皮塞中,然后缓缓向外拉活塞,每次抽取80mL该工业废气样品,当溶液刚好变为无色时,共抽取100次。
①步骤2中,5mL溶液中溶有碘单质_______ mg;步骤3中缓缓向外拉活塞,“缓缓”的目的是________ 。
②计算该废气中SO2的含量,并判断是否达到国家一级标准_______ (请写出计算过程)。
(3)工业废渣(主要成分为Na2CO3)可吸收工业废气中的SO2,达到减少污染,节约资源的目的。反应过程中溶液组成的浓度变化如图所示。
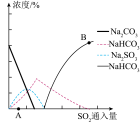
①吸收初期(图中A点以前)发生反应的化学方程式为_______ 。
②不断通入SO2(图中B点以后)的最终产物是_______ 。
(1)通过测定雨水的
(2)测定某工业废气中
 的含量。兴趣小组同学利用如图所示装置进行实验,步骤如下。
的含量。兴趣小组同学利用如图所示装置进行实验,步骤如下。
已知:SO2+I2+2H2O=H2SO4+2HI(无色溶液)。常温下,碘微溶于水,加入碘化钾可促进碘的溶解,增加SO2吸气的吸收量。
废气中的其他成分不与淀粉碘溶液反应。
步骤1:称取1.27g碘单质(I2),加入少量碘化钾,加水配制成1000mL溶液;
步骤2:取5mL上述溶液于试管中,滴入2~3滴淀粉试液,溶液变蓝;
步骤3:将注射器的活塞推到底后,插入试管的橡皮塞中,然后缓缓向外拉活塞,每次抽取80mL该工业废气样品,当溶液刚好变为无色时,共抽取100次。
①步骤2中,5mL溶液中溶有碘单质
②计算该废气中SO2的含量,并判断是否达到国家一级标准
(3)工业废渣(主要成分为Na2CO3)可吸收工业废气中的SO2,达到减少污染,节约资源的目的。反应过程中溶液组成的浓度变化如图所示。

①吸收初期(图中A点以前)发生反应的化学方程式为
②不断通入SO2(图中B点以后)的最终产物是
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐3】小李和小王同学对化学计算很有心得,以下是他们解答一道计算题的实录。请你一起参与研究并完成相关问题。( 计算结果精确到0.01g)
题目已知: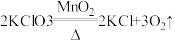 ,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
(1)两同学一致认为氯酸钾已经完全反应的时间为_____ (选填“t1”、 “t2”、“t3”、“t4”) 。
(2)小李根据质量守恒定律很快得到(2.5g+0.5g-2.04g)是_____ (填化学式)的质量。
(3)请你计算:该药品中氯酸钾的质量,并判断该药品是否纯净?_____
题目已知:
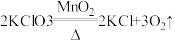 ,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量/g | 2.12 | 2.08 | 2.04 | 2.04 |
(2)小李根据质量守恒定律很快得到(2.5g+0.5g-2.04g)是
(3)请你计算:该药品中氯酸钾的质量,并判断该药品是否纯净?
您最近一年使用:0次
【推荐1】类价二维图反映的是元素的化合价与物质类别之间的关系,构建类价二维图是化学学习,的重要方法。图1是某向学绘制的关于碳元素的类价二维图。
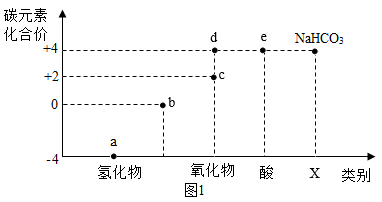
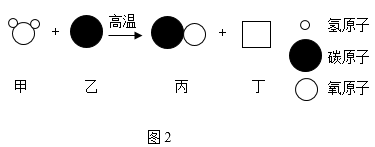
(1)写化学式:a是天然气的主要成分______ ;可乐、雪碧等饮料中均含有e,______ 。
(2)图1中X处对应物质的类别是______ 。
(3)已知煤中含有单质碳物质c通常情况下是无色无味的有毒气体,若氧气供应不足,碳燃烧不充分就会生成物质c,写出碳不完全燃烧生成物质c的化学方程式______ ;此外,在高温条件下炽热的碳也可以使物质d转化为物质c,请写出转化的化学方程式______ 因此生活中在使用物质c或含碳的燃料时,应该保证空气流通。
(4)图2是用煤合成水煤气的反应微观示意图。该反应中方框丁微粒的图示为______ ,写出图2反应的化学方程式______ 。
(5)“碳中和、碳达峰”在2021年两会首次列入政府工作报告,且被列为2021年重点任务之一。图1中d物质在空气中剧增会导致______ ;以下做法符合“低碳生活”理念的是______ 。(填字母)
A.禁止使用煤、石油、天然气等化石燃料
B.积极开发太阳能等新能源
C.大力建火力发电站以解决人们对电力的需求
D.提倡使用一次性餐具


(1)写化学式:a是天然气的主要成分
(2)图1中X处对应物质的类别是
(3)已知煤中含有单质碳物质c通常情况下是无色无味的有毒气体,若氧气供应不足,碳燃烧不充分就会生成物质c,写出碳不完全燃烧生成物质c的化学方程式
(4)图2是用煤合成水煤气的反应微观示意图。该反应中方框丁微粒的图示为
(5)“碳中和、碳达峰”在2021年两会首次列入政府工作报告,且被列为2021年重点任务之一。图1中d物质在空气中剧增会导致
A.禁止使用煤、石油、天然气等化石燃料
B.积极开发太阳能等新能源
C.大力建火力发电站以解决人们对电力的需求
D.提倡使用一次性餐具
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐2】从古至今,铁及其化合物一直被人类广泛应用。
一、铁的应用
(1)我因早在春秋战国时期就开始生产和使用铁器。深埋的古墓中有些铁器保存至今是因为______ (选填序号)。
a.铁不活泼 b.密封缺氧 c.干燥少水
(2)铁的化合物在现代更多领域发挥着重要作用。
补铁剂中所含的补铁成分基本分为两种:无机铁和有机铁。无机铁主要是硫酸亚铁,则硫酸亚铁的类别属于______ (选填序号)。
a.酸 b.碱 c.盐 d.化合物
二、铁的化合物制备
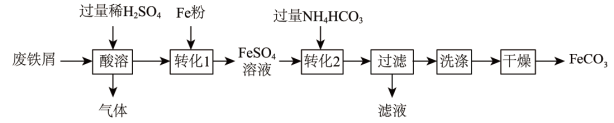
实验室利用废铁屑(含少量Fe2O3)为原料制备碳酸亚铁(FeCO3)的流程如下:
(3)酸溶时为了提高反应速率,除了适当提高反应温度和H2SO4浓度外,还可以______ 。
(4)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该化学反应前后铁的化合价的变化是______ 。
(5)在空气中灼烧FeCO3可获得颜料铁红(Fe2O3)和CO2,反应的化学方程式为______ 。
三、铁的化合物含量测定
称取含FeCO3的Fe2O3样品21.8g,放入下图所示装置中通入CO,控温在300℃,加热至质量不再改变,相应的化学反应方程式为: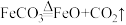 ,测得剩余固体质量为19.6g。
,测得剩余固体质量为19.6g。
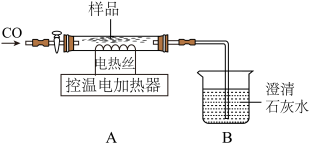
资料:①FeCO3在282℃分解为FeO。
②用CO还原Fe2O3炼铁的过程大致分为三个阶段:阶段1: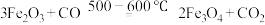 ;
;
阶段2: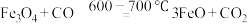 ;
;
阶段3: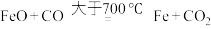 。
。
(6)通过实验计算出样品中FeCO3的质量。(写出计算过程)
(7)继续向装置中通CO,分阶段升温,进行CO还原铁的氧化物,加热时测得剩余固体质量随温度变化的曲线如图所示。
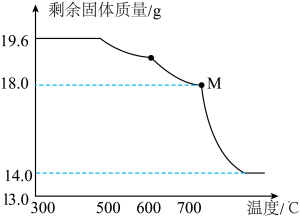
图中M点固体的成分的化学式为______ 。
一、铁的应用
(1)我因早在春秋战国时期就开始生产和使用铁器。深埋的古墓中有些铁器保存至今是因为
a.铁不活泼 b.密封缺氧 c.干燥少水
(2)铁的化合物在现代更多领域发挥着重要作用。
补铁剂中所含的补铁成分基本分为两种:无机铁和有机铁。无机铁主要是硫酸亚铁,则硫酸亚铁的类别属于
a.酸 b.碱 c.盐 d.化合物
二、铁的化合物制备

实验室利用废铁屑(含少量Fe2O3)为原料制备碳酸亚铁(FeCO3)的流程如下:
(3)酸溶时为了提高反应速率,除了适当提高反应温度和H2SO4浓度外,还可以
(4)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该化学反应前后铁的化合价的变化是
(5)在空气中灼烧FeCO3可获得颜料铁红(Fe2O3)和CO2,反应的化学方程式为
三、铁的化合物含量测定
称取含FeCO3的Fe2O3样品21.8g,放入下图所示装置中通入CO,控温在300℃,加热至质量不再改变,相应的化学反应方程式为:
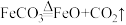 ,测得剩余固体质量为19.6g。
,测得剩余固体质量为19.6g。
资料:①FeCO3在282℃分解为FeO。
②用CO还原Fe2O3炼铁的过程大致分为三个阶段:阶段1:
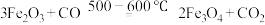 ;
;阶段2:
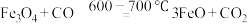 ;
;阶段3:
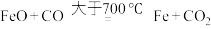 。
。(6)通过实验计算出样品中FeCO3的质量。(写出计算过程)
(7)继续向装置中通CO,分阶段升温,进行CO还原铁的氧化物,加热时测得剩余固体质量随温度变化的曲线如图所示。

图中M点固体的成分的化学式为
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐3】波尔多液是一种农业上常用的杀虫剂,它由硫酸铜、生石灰加水配制而成。
(1)硫酸铜属于______ (填“酸”、“碱”、“盐”),其所含阴离子的符号是______ ;生石灰加水过程中会______ (填“放”或“吸”)热。
(2)波尔多液不能用铁质容器来配制的原因是_______ (用化学方程式解释)。
(3)般烧石灰石(主要成分CaCO3)可制得生石灰(Ca0),同时放出二氧化碳气体,若现在有含碳酸钙80%的石灰石100g,根据化学方程式计算可以制得氧化钙的质量是多少?
(1)硫酸铜属于
(2)波尔多液不能用铁质容器来配制的原因是
(3)般烧石灰石(主要成分CaCO3)可制得生石灰(Ca0),同时放出二氧化碳气体,若现在有含碳酸钙80%的石灰石100g,根据化学方程式计算可以制得氧化钙的质量是多少?
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐1】实验室中Y形管用途很多。
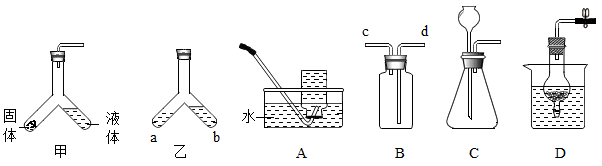
(1)利用装置甲在实验室制备少量二氧化碳:Y形管中盛放的固体物质是__________ (填名称),反应的化学方程式为______ ;若用装置B收集CO2应从导管________ (填“c”或“d”)通入。
(2)利用装置乙探究微粒性质:a处盛放浓氨水,向b处水中滴加_____ (填名称);最终____ (填“a”或“b”)处溶液变红。
(3)实验室用稀硫酸和锌粒制取氢气的发生装置可用装置C,装置D也可用来完成该实验,使用装置D的优点是____________ 。
(4)68g质量分数为5%的过氧化氢溶液与0.5g二氧化锰粉末混合,最多生成氧气的质量是多少?_____ (写出计算过程)

(1)利用装置甲在实验室制备少量二氧化碳:Y形管中盛放的固体物质是
(2)利用装置乙探究微粒性质:a处盛放浓氨水,向b处水中滴加
(3)实验室用稀硫酸和锌粒制取氢气的发生装置可用装置C,装置D也可用来完成该实验,使用装置D的优点是
(4)68g质量分数为5%的过氧化氢溶液与0.5g二氧化锰粉末混合,最多生成氧气的质量是多少?
您最近一年使用:0次
【推荐2】2022年北京成功举办冬奥会,化学功不可没。
(1)冬奥会环保人员的服装面料是利用回收废弃的塑料瓶加工制成。塑料属于______ (填字母)。
a.金属材料 b.复合材料 c.合成材料
(2)冬奥会速滑场馆“冰丝带”采用的是CO2跨临界直冷制冰。
①对CO2气体加压、降温,可得到干冰,从构成物质微粒角度分析,该过程主要改变的是分子的______ 。
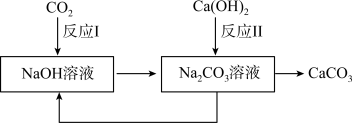
②捕集、利用和封存CO2是实现碳中和的一种途径。下图是利用氢氧化钠溶液吸收CO2的部分转化关系图。______ ,该转化中可以循环利用的物质是______ 。
(3)冬奥会上提供经过二氧化氯消毒处理的直饮水。
①二氧化氯的化学式为______ 。
②请设计实验证明该直饮水是软水,并完成实验报告。
(1)冬奥会环保人员的服装面料是利用回收废弃的塑料瓶加工制成。塑料属于
a.金属材料 b.复合材料 c.合成材料
(2)冬奥会速滑场馆“冰丝带”采用的是CO2跨临界直冷制冰。
①对CO2气体加压、降温,可得到干冰,从构成物质微粒角度分析,该过程主要改变的是分子的
②捕集、利用和封存CO2是实现碳中和的一种途径。下图是利用氢氧化钠溶液吸收CO2的部分转化关系图。
(3)冬奥会上提供经过二氧化氯消毒处理的直饮水。
①二氧化氯的化学式为
②请设计实验证明该直饮水是软水,并完成实验报告。
| 实验步骤 | 实验现象 | 实验结论 |
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐3】2023年5月30日,神舟十六号载人飞船成功发射。氧气和水是保障航天员生命的重要物质。
Ⅰ.“富氧空气”是指氧气含量高于普通空气的气体,可用于航天、医疗、炼钢等。化学兴趣小组对“富氧空气”开展相关探究,进行以下实验
实验一:测定“富氧空气”中氧气的含量
用如图1装置测定“富氧空气”中氧气的含量(集气瓶中“富氧空气”体积为200mL,底部残留少量水,燃烧匙内有足量红磷),操作如下。
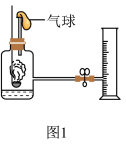
①往量筒内加入适量水,读出量筒内水的体积为100mL;
②用电点火装置点燃红磷,充分反应
③打开止水夹,待右侧量筒内液面不再变化时,排出气球中的气体,调节两边液面在同一水平面上,读出量筒内水的体积为20mL
回答以下问题:
(1)写出操作②中红磷燃烧的反应文字表达式:___________ 。
(2)本次实验测得“富氧空气”中氧气的体积分数为___________ 。
(3)实验过程中气球的作用是___________ 。
实验二:空气中氧气含量的再探究
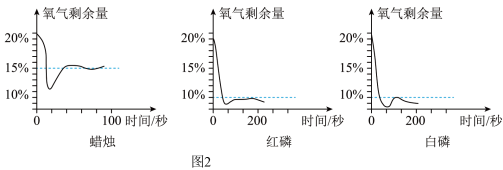
化学兴趣小组想探究用不同物质在空气中燃烧测定氧气含量方法的优劣。他们用足量的蜡烛、红磷和白磷分别在相同体积与状态的空气中燃烧,用氧气探测器测定密闭容器中剩余氧气与时间的关系如图2所示。
(4)下列说法正确的是___________。(填序号)
Ⅱ.下图为核心舱环控生保系统工作原理示意图。根据图中信息,回答下列问题。
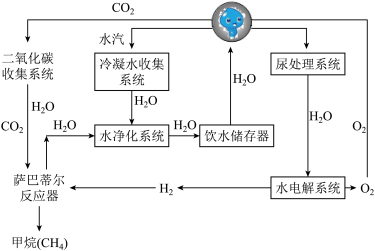
(5)航天员呼出气体中的二氧化碳可用分子筛设备分离出来,其原理类似于实验室中的___________ 操作。
(6)从微观角度分析,水冷凝过程中水分子的___________ 发生了改变。
(7)写出水电解系统中反应的文字表达式___________
(8)由上述流程图可知,空间站通过物质循环获得水的途径共有___________ 条。
Ⅰ.“富氧空气”是指氧气含量高于普通空气的气体,可用于航天、医疗、炼钢等。化学兴趣小组对“富氧空气”开展相关探究,进行以下实验
实验一:测定“富氧空气”中氧气的含量
用如图1装置测定“富氧空气”中氧气的含量(集气瓶中“富氧空气”体积为200mL,底部残留少量水,燃烧匙内有足量红磷),操作如下。

①往量筒内加入适量水,读出量筒内水的体积为100mL;
②用电点火装置点燃红磷,充分反应
③打开止水夹,待右侧量筒内液面不再变化时,排出气球中的气体,调节两边液面在同一水平面上,读出量筒内水的体积为20mL
回答以下问题:
(1)写出操作②中红磷燃烧的反应文字表达式:
(2)本次实验测得“富氧空气”中氧气的体积分数为
(3)实验过程中气球的作用是
实验二:空气中氧气含量的再探究
化学兴趣小组想探究用不同物质在空气中燃烧测定氧气含量方法的优劣。他们用足量的蜡烛、红磷和白磷分别在相同体积与状态的空气中燃烧,用氧气探测器测定密闭容器中剩余氧气与时间的关系如图2所示。

(4)下列说法正确的是___________。(填序号)
| A.测定空气中氧气含量效果最好的是蜡烛,因为它反应速率快 |
| B.该实验证明氧气的浓度较低时,红磷与白磷还能与之发生反应 |
| C.三个实验中均需要冷却至室温再读数 |
| D.若用这三种物质做实验,测得空气中氧气含量偏高 |
Ⅱ.下图为核心舱环控生保系统工作原理示意图。根据图中信息,回答下列问题。

(5)航天员呼出气体中的二氧化碳可用分子筛设备分离出来,其原理类似于实验室中的
(6)从微观角度分析,水冷凝过程中水分子的
(7)写出水电解系统中反应的文字表达式
(8)由上述流程图可知,空间站通过物质循环获得水的途径共有
您最近一年使用:0次
综合应用题
|
适中
(0.65)
名校
解题方法
【推荐1】酸、碱、盐在生产和生活中有广泛的应用。
(1)如图是氢氧化钠溶液与稀硫酸反应时溶液pH变化的示意图。
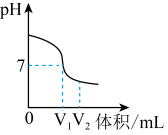
图1
①根据图示判断,该实验是将________ (填“氢氧化钠溶液”或“稀硫酸”)滴加到另一种溶液中。
②滴入溶液体积为V2mL时,溶液中的阳离子有_______ 。
(2)为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了如图2方案:
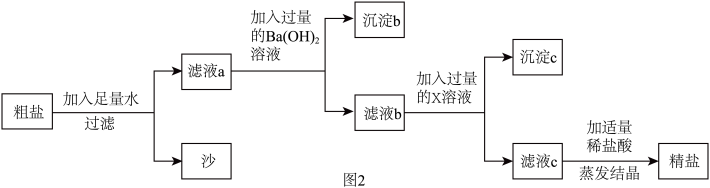
【提示】杂质含量较少,不考虑微溶物形成沉淀。
①过滤用到的玻璃仪器有烧杯、玻璃棒和_________ ;
②写出加入Ba(OH)2溶液时反应的化学方程式_______ ;
③滤液c中含有的杂质为__________ ;
④若样品中含a gNaCl,理论上最终所得NaCl固体的质量_______ a g(填“>”、“<”或者“=”)。
(1)如图是氢氧化钠溶液与稀硫酸反应时溶液pH变化的示意图。

图1
①根据图示判断,该实验是将
②滴入溶液体积为V2mL时,溶液中的阳离子有
(2)为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了如图2方案:

【提示】杂质含量较少,不考虑微溶物形成沉淀。
①过滤用到的玻璃仪器有烧杯、玻璃棒和
②写出加入Ba(OH)2溶液时反应的化学方程式
③滤液c中含有的杂质为
④若样品中含a gNaCl,理论上最终所得NaCl固体的质量
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】利用下图所示实验装置制备常见气体,请回答有关问题:
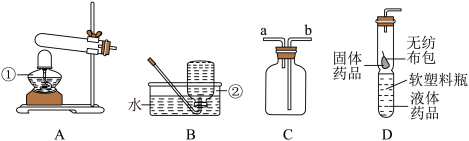
①实验室用装置A制取氧气,写出有关反应的化学方程式____________________ 。
②用装置C排空气法收集氧气,氧气从_______________ 端(选填“a”或“b”)进入。
③装置D是用软塑料管自制的气体发生装置,可控制反应的发生和停止,若利用该装置制取二氧化碳气体,药品加入完毕后(如图D 所示),欲产生二氧化碳接下来的操作是:________________ 。
④实验中用足量的石灰石和稀盐酸反应,制得二氧化碳为0.2mol。试计算:稀盐酸中参加反应的HCl的物质的量为多少mol?(根据化学方程式列式计算):____________________ 。
⑤“数字化实验”丰富了实验研究的方法,它可将实验过程中某些因素(酸碱性、气压等)的变化以数据、图像的形式呈现出来,下面是探究二氧化碳与水的反应的两种方案。请回答:
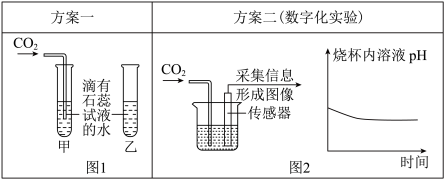
Ⅰ. 图1中可观察到甲试管中的紫色液体变为________________ 色,写出发生反应的化学方程式 _________________ ,乙试管的作用是 _______________ 。
Ⅱ. 由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变_____________ (填“强”或“弱”)。

①实验室用装置A制取氧气,写出有关反应的化学方程式
②用装置C排空气法收集氧气,氧气从
③装置D是用软塑料管自制的气体发生装置,可控制反应的发生和停止,若利用该装置制取二氧化碳气体,药品加入完毕后(如图D 所示),欲产生二氧化碳接下来的操作是:
④实验中用足量的石灰石和稀盐酸反应,制得二氧化碳为0.2mol。试计算:稀盐酸中参加反应的HCl的物质的量为多少mol?(根据化学方程式列式计算):
⑤“数字化实验”丰富了实验研究的方法,它可将实验过程中某些因素(酸碱性、气压等)的变化以数据、图像的形式呈现出来,下面是探究二氧化碳与水的反应的两种方案。请回答:

Ⅰ. 图1中可观察到甲试管中的紫色液体变为
Ⅱ. 由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐3】生活中常见物质的性质、制法的是化学研究的重要内容.
(1)复分解反应发生后,生成物肯定不会是______ (填“单质”或“化合物”).
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示.下列说法正确的___ .
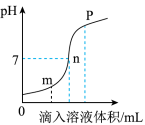
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液呈红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)如图装置可作一氧化碳还原氧化铁的实验,并检验生成的气体产物.
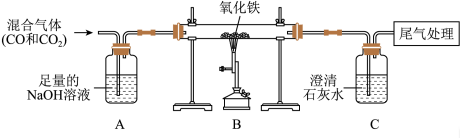
①B装置玻璃管里可观察到的现象为_____________________ .
②C装置中反应的化学方程式为_________________________ .
③工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?___________
(1)复分解反应发生后,生成物肯定不会是
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示.下列说法正确的

a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液呈红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)如图装置可作一氧化碳还原氧化铁的实验,并检验生成的气体产物.

①B装置玻璃管里可观察到的现象为
②C装置中反应的化学方程式为
③工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
您最近一年使用:0次



