红薯是人们喜爱的一种食物,某地准备种植特色农产品小红薯。由于担心该地土壤的酸碱性不适合种植小红薯,特邀请学校化学兴趣小组的同学利用所学化学知识对土壤的酸碱性进行项目式探究。
活动一:测定土壤的酸碱性
【实验方案】
1.取少量土壤样品,加蒸馏水充分搅拌,静置澄清后过滤;
2.用玻璃棒蘸取少量滤液滴在 pH 试纸上,等试纸显色后与标准比色卡对比,读出 pH,进一步确定土壤酸碱性。
【实验记录】同学们分别进行了四次实验测定土壤滤液的酸碱度,实验数据记录如下:
【实验结论】
(1)该土地的土壤呈________________ 性。
活动二:【调查分析】经调查,该土地之前的承包者为使自己种植的农作物生长茂盛,施用了大量化肥硫酸铵,于是推测土壤的酸碱性出现问题的原因是土壤中含有大量的硫酸铵。
【设计实验】
(2)
【实验结论】土壤中含有硫酸铵,猜想成立。
活动一:测定土壤的酸碱性
【实验方案】
1.取少量土壤样品,加蒸馏水充分搅拌,静置澄清后过滤;
2.用玻璃棒蘸取少量滤液滴在 pH 试纸上,等试纸显色后与标准比色卡对比,读出 pH,进一步确定土壤酸碱性。
【实验记录】同学们分别进行了四次实验测定土壤滤液的酸碱度,实验数据记录如下:
| 滤液1 | 滤液2 | 滤液3 | 滤液4 | |
| 测得的pH | 5 | 6 | 6 | 5 |
(1)该土地的土壤呈
活动二:【调查分析】经调查,该土地之前的承包者为使自己种植的农作物生长茂盛,施用了大量化肥硫酸铵,于是推测土壤的酸碱性出现问题的原因是土壤中含有大量的硫酸铵。
【设计实验】
(2)
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤①:取“活动一”中的滤液于试管中,滴加 | 产生白色沉淀 | 土壤中含有硫酸根离子 |
| 步骤②:另取适量土壤样品,加 | 有刺激性气味的气体产生 | 土壤中含有 |
更新时间:2024-05-10 21:10:25
|
相似题推荐
科学探究题
|
适中
(0.65)
解题方法
【推荐1】耕地盐碱化影响粮食安全,盐碱地综合治理与利用可促进农业高质量发展。兴趣小组开展了与土壤盐碱化相关的探究活动。
成因:由农业灌溉或化肥施用引起的土壤盐碱化。当进入土壤中盐的量超出植物的吸收能力时,随水分蒸发,盐残留聚集导致土壤盐碱化。
(1)检测:配置土壤样品浸出液,用pH试纸测定,若 ,则土壤浸出液显
,则土壤浸出液显______ 性。
(2)探究:某地土壤盐碱化可能由 、
、 中的一种或两种引起。
中的一种或两种引起。
【查阅资料】 易溶于水;
易溶于水; 为白色固体,难溶于水;
为白色固体,难溶于水;
 为白色固体,难溶于水和稀硝酸。
为白色固体,难溶于水和稀硝酸。
【提出问题】样品中的钠盐是什么?
【作出猜想】猜想1: ;猜想2:
;猜想2: ;猜想3:
;猜想3:______ 。
【实验探究】取出少量样品分别加入试管A、B中。
【分析评价】有同学认为实验1不够严谨,理由是______ 。
【补充实验】
(3)交流:应对土壤盐碱化的合理措施有______ (填字母)。
a.合理施肥 b.引海水灌溉 c.用熟石灰改良 d.种植耐盐碱作物
成因:由农业灌溉或化肥施用引起的土壤盐碱化。当进入土壤中盐的量超出植物的吸收能力时,随水分蒸发,盐残留聚集导致土壤盐碱化。
(1)检测:配置土壤样品浸出液,用pH试纸测定,若
 ,则土壤浸出液显
,则土壤浸出液显(2)探究:某地土壤盐碱化可能由
 、
、 中的一种或两种引起。
中的一种或两种引起。【查阅资料】
 易溶于水;
易溶于水; 为白色固体,难溶于水;
为白色固体,难溶于水; 为白色固体,难溶于水和稀硝酸。
为白色固体,难溶于水和稀硝酸。【提出问题】样品中的钠盐是什么?
【作出猜想】猜想1:
 ;猜想2:
;猜想2: ;猜想3:
;猜想3:【实验探究】取出少量样品分别加入试管A、B中。
| 实验序号 | 操作 | 现象 | 结论 |
| 1 | 向A中滴加少量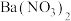 溶液 溶液 | 产生白色沉淀 | 含 |
| 2 | 向B中滴加过量稀硝酸 | 产生大量气泡 | 含 |
【补充实验】
| 实验序号 | 操作 | 现象 | 结论 |
| 3 | 向实验2反应后的溶液中滴加少量 溶液 溶液 | 猜想3成立 |
a.合理施肥 b.引海水灌溉 c.用熟石灰改良 d.种植耐盐碱作物
您最近一年使用:0次
科学探究题
|
适中
(0.65)
【推荐2】某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象。
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量。
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告
【评价反思】 你认为实验设计方案不合理的同学是 ______ ,理由是 ______ 。
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量。
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告
| 同学 | 实验操作 | 现象 | 结论 |
| 甲 |  | 溶液由红色变成 | 氢氧化钠与盐酸发生了化学反应 |
| 乙 |  | U形玻璃管中 | 氢氧化钠与盐酸发生了化学反应 |
| 丙 | 用 | 最后溶液的pH | 氢氧化钠与盐酸发生了化学反应 |
您最近一年使用:0次
【推荐3】酸碱中和反应在生活和生产中有广泛的应用。
【实验发现】在盛有15mL稀氢氧化钠溶液的烧杯中,滴入几滴酚酞溶液。再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,当观察到溶液颜色由红色恰好变为无色时,停止滴加稀盐酸。取一定量反应后的无色溶液加热蒸发,“意外”发现溶液由无色又变成红色。同学们对这个“意外”进行再探究。
【查阅资料】酚酞在PH<8.2的溶液中呈无色,在8.2<pH<10.0的溶液中呈红色。
【原因分析】反应后无色溶液中仍存在少量氢氧化钠,加热蒸发,溶液的体积减小浓度变大,当溶液pH值在8.2-10.0之间时,溶液的颜色变红。
【总结反思】
(1)向某碱性溶液中滴加2-3滴无色酚酞试液,振荡后溶液的颜色______ (填“一定”或“不一定”)变红。
【实验探究1】向盛有15mL氢氧化钠溶液的烧杯中,逐滴匀速加入稀盐酸,并用温度传感器测量反应过程中溶液的温度变化情况,发现温度升高,变化如图1。
【提出问题】氢氧化钠溶液和盐酸混合时,溶液温度升高是否能得出该反应放热的结论?为此,需补做下列两个实验。
【实验探究2】
(2)①向15mL上述浓度的氢氧化钠溶液中逐滴加入______ ,边加边搅拌,并用温度传感器测定实验过程中温度的变化如图2——实验①。
②将实验①中的氢氧化钠溶液替换为同浓度、同温度的盐酸,并再次进行实验,温度变化如图2——实验②。

由图可知,盐酸、氢氧化钠溶液稀释时均放热,但它们稀释时温度的变化量远______ (填“大于”或“小于”)两溶液混合时温度的变化量。
【实验结论】氢氧化钠溶液和盐酸的反应是放热反应。
【实验探究3】用电导率传感器测氢氧化钠溶液中滴加稀盐酸的电导率变化(如图)。
【查阅资料】
①电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。
②相同温度下同种溶液电导率越大离子浓度越大。
【分析与讨论】

(3)B点的pH______ 7(填“大于”“等于”或“小于”)。
(4)AB段曲线下降的原因是______ 。
(5)如图表示该反应过程中烧杯中不同时间点的微观粒子示意图,按时间先后排列的顺序为______ (填字母)。

【实验发现】在盛有15mL稀氢氧化钠溶液的烧杯中,滴入几滴酚酞溶液。再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,当观察到溶液颜色由红色恰好变为无色时,停止滴加稀盐酸。取一定量反应后的无色溶液加热蒸发,“意外”发现溶液由无色又变成红色。同学们对这个“意外”进行再探究。
【查阅资料】酚酞在PH<8.2的溶液中呈无色,在8.2<pH<10.0的溶液中呈红色。
【原因分析】反应后无色溶液中仍存在少量氢氧化钠,加热蒸发,溶液的体积减小浓度变大,当溶液pH值在8.2-10.0之间时,溶液的颜色变红。
【总结反思】
(1)向某碱性溶液中滴加2-3滴无色酚酞试液,振荡后溶液的颜色
【实验探究1】向盛有15mL氢氧化钠溶液的烧杯中,逐滴匀速加入稀盐酸,并用温度传感器测量反应过程中溶液的温度变化情况,发现温度升高,变化如图1。
【提出问题】氢氧化钠溶液和盐酸混合时,溶液温度升高是否能得出该反应放热的结论?为此,需补做下列两个实验。
【实验探究2】
(2)①向15mL上述浓度的氢氧化钠溶液中逐滴加入
②将实验①中的氢氧化钠溶液替换为同浓度、同温度的盐酸,并再次进行实验,温度变化如图2——实验②。

由图可知,盐酸、氢氧化钠溶液稀释时均放热,但它们稀释时温度的变化量远
【实验结论】氢氧化钠溶液和盐酸的反应是放热反应。
【实验探究3】用电导率传感器测氢氧化钠溶液中滴加稀盐酸的电导率变化(如图)。
【查阅资料】
①电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。
②相同温度下同种溶液电导率越大离子浓度越大。
【分析与讨论】

(3)B点的pH
(4)AB段曲线下降的原因是
(5)如图表示该反应过程中烧杯中不同时间点的微观粒子示意图,按时间先后排列的顺序为

您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐1】2024年2月29日,国家自然科学基金委员会发布2023年度“中国科学十大进展”,中国科学院遗传发育所“农作物耐盐碱机制解析及应用”成果入选。某盐碱地的土壤中含有的可溶性盐是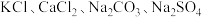 中的一种或多种,某项目化研究小组的同学利用该地土壤的浸出液进行了以下探究。(提示:把土壤样品用水充分浸泡后过滤,所得滤液即为“浸出液”)
中的一种或多种,某项目化研究小组的同学利用该地土壤的浸出液进行了以下探究。(提示:把土壤样品用水充分浸泡后过滤,所得滤液即为“浸出液”)
【实验验证】
(1)请完善下面表格。
【反思评价】
(2)同学们讨论后发现,如果实验②是直接往土壤的浸出液中滴加足量硝酸钡溶液,则无法确定浸出液中含有 ,理由是:
,理由是:_________ 。(请用化学方程式解释)
【拓展应用】
(3)经测定,该地土壤的浸出液的 为8,同学们对当地农民施肥给出了建议,在施用氮肥中,不宜选择含铵根的氮肥,其原因是
为8,同学们对当地农民施肥给出了建议,在施用氮肥中,不宜选择含铵根的氮肥,其原因是_________ 。
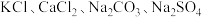 中的一种或多种,某项目化研究小组的同学利用该地土壤的浸出液进行了以下探究。(提示:把土壤样品用水充分浸泡后过滤,所得滤液即为“浸出液”)
中的一种或多种,某项目化研究小组的同学利用该地土壤的浸出液进行了以下探究。(提示:把土壤样品用水充分浸泡后过滤,所得滤液即为“浸出液”)【实验验证】
(1)请完善下面表格。
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量浸出液于试管中,滴加足量 | 产生气泡 | 浸出液中含有 ,没有 ,没有 |
| ②在上述反应后的溶液中继续滴加足量硝酸钡溶液,充分反应后过滤 | 产生 | 浸出液中含有 |
| ③取上述实验过滤后的滤液于另一支试管中,滴加适量硝酸银溶液 | 产生白色沉淀 | 浸出液中含有 |
【反思评价】
(2)同学们讨论后发现,如果实验②是直接往土壤的浸出液中滴加足量硝酸钡溶液,则无法确定浸出液中含有
 ,理由是:
,理由是:【拓展应用】
(3)经测定,该地土壤的浸出液的
 为8,同学们对当地农民施肥给出了建议,在施用氮肥中,不宜选择含铵根的氮肥,其原因是
为8,同学们对当地农民施肥给出了建议,在施用氮肥中,不宜选择含铵根的氮肥,其原因是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
真题
解题方法
【推荐2】小明同学将一定量的氢化钙(CaH2)加入到足量的Na2CO3溶液中,充分反应后过滤,分离出滤渣和滤液.
【提出问题】滤液中溶质的成份是什么?
【查阅资料】CaH2遇水迅速反应生成Ca(OH)2和H2.反应的化学方程式为__________ .
【结论推理】滤液中溶质一定有NaOH,可能有Na2CO3或__________ .
【实验验证】请结合题意,在下列表格的空白中填写恰当的内容.
【反思与拓展】
(1)如果要从上述滤液中以最小生产成本获得大量NaOH,你建议向滤液中加入适量的__________ 溶液.
(2)小明同学认为CaH2与水的反应是复分解反应.请谈谈你的看法并说明理由__________ 。
【提出问题】滤液中溶质的成份是什么?
【查阅资料】CaH2遇水迅速反应生成Ca(OH)2和H2.反应的化学方程式为
【结论推理】滤液中溶质一定有NaOH,可能有Na2CO3或
【实验验证】请结合题意,在下列表格的空白中填写恰当的内容.
| 实验方法 | 实验现象 | 实验结论 |
| 取滤液少许,向其中滴加 Na2CO3溶液. | 无明显显现 | (1) |
| (2) | 有气体放出 | 滤液中有Na2CO3存在 |
【反思与拓展】
(1)如果要从上述滤液中以最小生产成本获得大量NaOH,你建议向滤液中加入适量的
(2)小明同学认为CaH2与水的反应是复分解反应.请谈谈你的看法并说明理由
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】化学小组对某盐碱地土壤进行了项目式探究。
任务一:探究土壤的酸碱度
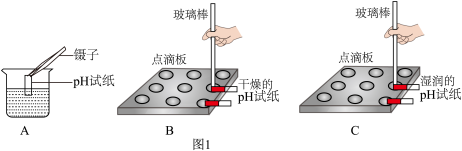
(1)将土壤样品用水充分浸泡后,过滤,得到浸出液,测定浸出液的pH值,正确操作是图1中_____ (填字母)。
任务二:探究土壤所含成分
【查阅资料】该片盐碱地的土壤中含有的可溶性物质是Na2CO3、NaCl、Na2SO4、CaCl2中的一种或多种。
【实验探究】
(2)
【讨论评价】
(3)讨论后,同学们一致认为通过实验②无法确定浸出液中含有Na2SO4,原因是_____ (用化学方程式表示)。
【继续实验】
(4)为进一步探究浸出液的成分,同学们又进行了图2实验:_____ (填离子符号),步骤③中发生反应的化学方程式为_____ 。
【实验结论】
该地块的土壤中含有
【反思拓展】
(5)上述土壤样品中含有的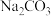 对农作物危害较大,为此,你认为可以向该地块中施加_____(填字母),以减轻Na2CO3对农作物的危害。
对农作物危害较大,为此,你认为可以向该地块中施加_____(填字母),以减轻Na2CO3对农作物的危害。
(6)小组同学认为该碱性土壤中不适合施用氮肥NH4Cl,原因是_____ 。
任务一:探究土壤的酸碱度
(1)将土壤样品用水充分浸泡后,过滤,得到浸出液,测定浸出液的pH值,正确操作是图1中
任务二:探究土壤所含成分
【查阅资料】该片盐碱地的土壤中含有的可溶性物质是Na2CO3、NaCl、Na2SO4、CaCl2中的一种或多种。
【实验探究】
(2)
| 实验 | 实验操作 | 实验现象 | 实验结论 |
| ① | 取少量浸出液于试管中,加过量稀盐酸 | 含有Na₂CO3,没有 | |
| ② | 取少量浸出液于试管中 滴加适量Ba(OH)2溶液 | 产生白色沉淀 | 含有Na2SO4 |
【讨论评价】
(3)讨论后,同学们一致认为通过实验②无法确定浸出液中含有Na2SO4,原因是
【继续实验】
(4)为进一步探究浸出液的成分,同学们又进行了图2实验:

【实验结论】
该地块的土壤中含有

【反思拓展】
(5)上述土壤样品中含有的
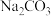 对农作物危害较大,为此,你认为可以向该地块中施加_____(填字母),以减轻Na2CO3对农作物的危害。
对农作物危害较大,为此,你认为可以向该地块中施加_____(填字母),以减轻Na2CO3对农作物的危害。| A.熟石灰 | B.浓硫酸 | C.氯化钙 |
(6)小组同学认为该碱性土壤中不适合施用氮肥NH4Cl,原因是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐1】小娟同学发现,上次做化学实验用的氢氧化钠溶液忘记了盖瓶塞。为确定该溶液是否变质,小娟和同学进行了如下探究活动。
提出问题:该瓶氢氧化钠溶液是否变质及变质的程度?
查阅资料:氯化钡溶液呈中性。
猜 想:①该溶液没有变质;②该溶液全部变质;③该溶液部分变质。
进行实验:小娟和同学按如图G5-7所示方案进行了实验。

问题讨论:
(1)操作Ⅰ的名称是_____ 。
(2)写出产生白色沉淀的反应的化学方程式:_____ ,由此现象可得出:猜想_____ (填序号)错误。
(3)结合操作Ⅰ和Ⅱ,若“现象X”是溶液不变色,则猜想_____ (填序号)正确;若“现象X”是_____ ,则猜想③正确。
提出问题:该瓶氢氧化钠溶液是否变质及变质的程度?
查阅资料:氯化钡溶液呈中性。
猜 想:①该溶液没有变质;②该溶液全部变质;③该溶液部分变质。
进行实验:小娟和同学按如图G5-7所示方案进行了实验。

问题讨论:
(1)操作Ⅰ的名称是
(2)写出产生白色沉淀的反应的化学方程式:
(3)结合操作Ⅰ和Ⅱ,若“现象X”是溶液不变色,则猜想
您最近一年使用:0次
科学探究题
|
适中
(0.65)
【推荐2】某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会儿后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ.写出该中和反应的化学方程式:__________________________ 。
Ⅱ.探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:_______________ 。
【查阅资料】氯化钙溶液呈中性。
【进行实验】
【反思与拓展】根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?_____________ (填字母)。
a.pH试纸 b.紫色石蕊溶液 c.硝酸银溶液
Ⅰ.写出该中和反应的化学方程式:
Ⅱ.探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:
【查阅资料】氯化钙溶液呈中性。
【进行实验】
| 实验步骤 | 实验现象 | 结论 |
| 取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡 | 猜想一不正确 | |
| 取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量 | 猜想二不正确,猜想三正确 |
【反思与拓展】根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?
a.pH试纸 b.紫色石蕊溶液 c.硝酸银溶液
您最近一年使用:0次
科学探究题
|
适中
(0.65)
【推荐3】有一实验事实:铁粉与硫酸铜溶液反应,不但有铜生成,而且有较多的气体产生。为确定气体的成分,进行下列实验探究。
(一)探究:从物质组成元素角度分析,气体可能是SO2、O2、H2中的一种或几种。
(二)实验:
(1)甲同学为确定是否含有SO2,他通过查阅资料得知:SO2能使酸性高锰酸钾溶液褪色,于是将气体通入酸性高锰酸钾溶液中,溶液颜色未发生变化,则该气体中_____ SO2(填“有”或“无”)。
(2)乙同学认为只有O2,则可用是_____ 来检验。实验证明乙同学的观点不正确
(3)丙同学为判断是否含有O2,同时确定气体成分,通过查阅资料得知:淀粉遇碘单质会变蓝色; O2+4KI+4HCl=2I2+4KCl+2H2O;I2为碘单质。于是他设计了如下的实验装置:
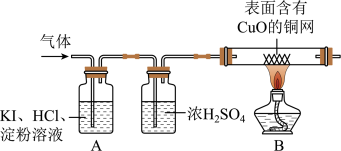
(三)实验现象与结论:A中观察到_____ ,证明无O2;B中观察到 _____ ,证明该气体是H2。
(四)实验反思:
(4)大家认为丙同学在加热之前,应对气体先_____ 以确保安全。
(5)由上述实验可知,硫酸铜溶液显_____ 性(填“酸”或“碱”)。
(一)探究:从物质组成元素角度分析,气体可能是SO2、O2、H2中的一种或几种。
(二)实验:
(1)甲同学为确定是否含有SO2,他通过查阅资料得知:SO2能使酸性高锰酸钾溶液褪色,于是将气体通入酸性高锰酸钾溶液中,溶液颜色未发生变化,则该气体中
(2)乙同学认为只有O2,则可用是
(3)丙同学为判断是否含有O2,同时确定气体成分,通过查阅资料得知:淀粉遇碘单质会变蓝色; O2+4KI+4HCl=2I2+4KCl+2H2O;I2为碘单质。于是他设计了如下的实验装置:

(三)实验现象与结论:A中观察到
(四)实验反思:
(4)大家认为丙同学在加热之前,应对气体先
(5)由上述实验可知,硫酸铜溶液显
您最近一年使用:0次
科学探究题
|
适中
(0.65)
【推荐1】刘星的家乡在北方农村,寒假的一天早晨,他看到在屋外的水缸被冻裂了,而与水缸同在屋外的咸菜缸却没有被冻裂,甚至其中的咸菜汤连冰都没有结.他把这一现象告诉了几个同学.对于结冰和不结冰的原因,几个人的看法不一,归纳有下列几种猜测: ①可能是咸菜缸内的液体中放有萝卜的缘故;②咸菜缸中有咸菜的缘故;③咸菜缸有盖子盖住保温,而水缸没有盖子;④咸菜缸中的水加了食盐,氯化钠溶液不结冰;⑤咸菜缸内液体多,水缸内水少而容易结冰;⑥水缸距房屋远,咸菜缸距房屋近,受屋内温度影响,咸菜缸没有被冻裂.
(1)根据当时的环境条件,你认为这六种猜测中可能性不大,不需要继续进行研究的是________ ;(填序号)
(2)他们找来4只铁制旧罐头桶、萝卜,并从咸菜缸中捞出咸菜,并取来食盐,针对最有可能的几种情况开始了实验,然后,把4只桶放在院中过夜.第二天一早,他们惊奇地发现: ①放萝卜的罐头桶结了冰,且萝卜也被冻得坚硬如铁;②放入咸菜的罐头桶也结了冰,但冰不结实,特别是咸菜没有被冻硬;③食盐水溶液没有结冰;④只放水的桶结了冰.
请根据第二天他们观察的现象,你推测他们进行的实验分别是①________ ;②________ ;③________ ;④在桶中单独放水.
(3)他们又配制了一些浓稀不同的溶液,也把它们放在院中过夜,其记录结果如下:
从该实验可以得出的初步结论可能是________ ;(写一条)
(4)在两次探究实验中他们都安排了纯水与其他液体一同放在院中过夜,其目的是________
(1)根据当时的环境条件,你认为这六种猜测中可能性不大,不需要继续进行研究的是
(2)他们找来4只铁制旧罐头桶、萝卜,并从咸菜缸中捞出咸菜,并取来食盐,针对最有可能的几种情况开始了实验,然后,把4只桶放在院中过夜.第二天一早,他们惊奇地发现: ①放萝卜的罐头桶结了冰,且萝卜也被冻得坚硬如铁;②放入咸菜的罐头桶也结了冰,但冰不结实,特别是咸菜没有被冻硬;③食盐水溶液没有结冰;④只放水的桶结了冰.
请根据第二天他们观察的现象,你推测他们进行的实验分别是①
(3)他们又配制了一些浓稀不同的溶液,也把它们放在院中过夜,其记录结果如下:
| 溶液 | 食盐(浓) | 食盐(稀) | 白糖(浓) | 石灰水 (饱和) | 高锰酸钾(稀) | 碳酸钠 (浓) | 水 |
| 结冰情况 | 无 | 结 | 无 | 结 | 结 | 无 | 结 |
从该实验可以得出的初步结论可能是
(4)在两次探究实验中他们都安排了纯水与其他液体一同放在院中过夜,其目的是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验桌上有一瓶敞口放置的氢氧化钠溶液,同学们对其是否变质进行实验探究。
【提出问题】敞口放置的氢氧化钠溶液是否变质呢?
(1)氢氧化钠变质的原因______ (用化学方程式表示)。
【猜想与假设】
(2)猜想I:没有变质,溶质是NaOH;
猜想II:部分变质,溶质是______ ;
猜想III:完全变质,溶质是Na2CO3。
【实验探究】同学们分别设计了不同方案进行探究,请你协助完成相关内容。
(3)小朱设计的实验方案:
【反思与评价】
(4)同学们讨论认为,小朱的实验结论不严密,理由是______ 。
(5)小周设计的实验方案:
【拓展实验】
(6)小周实验②中所用的方法替换为下列______(填字母)操作,也可以实现相同的目的。
【提出问题】敞口放置的氢氧化钠溶液是否变质呢?
(1)氢氧化钠变质的原因
【猜想与假设】
(2)猜想I:没有变质,溶质是NaOH;
猜想II:部分变质,溶质是
猜想III:完全变质,溶质是Na2CO3。
【实验探究】同学们分别设计了不同方案进行探究,请你协助完成相关内容。
(3)小朱设计的实验方案:
| 实验步骤 | 实验现象 | 结论 |
| ①取一定量待测液于试管中,滴加无色酚酞溶液 | 溶液变成红色 | 猜想II成立 |
| ②向①的试管中滴加过量的稀盐酸 |
【反思与评价】
(4)同学们讨论认为,小朱的实验结论不严密,理由是
(5)小周设计的实验方案:
| 实验步骤 | 实验现象 | 结论 |
| ①取一定量待测液于试管中,滴加过量 | 有白色沉淀产生 | 猜想II成立 |
| ②静置①的试管,向上层清液滴加无色酚酞溶液 | 溶液变成红色 |
【拓展实验】
(6)小周实验②中所用的方法替换为下列______(填字母)操作,也可以实现相同的目的。
| A.测溶液的pH | B.滴加MgSO4溶液 |
| C.通入CO2 | D.滴加稀盐酸 |
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】为研究铝和铜的金属活动性,某研究小组进行了如下探究。
(1)小明设计的实验方案是:先用砂纸打磨铝片和铜片,“打磨"的目的是______ ,然后再将打磨干净的铝片和铜片分别放入稀盐酸中,观察反应的现象。写出铝与稀盐酸反应的化学方程式______ 。
(2)小芳将打磨干净的铝片放入浓氯化铜溶液中,看到有大量气泡逸出,还有“白色沉淀"这一现象出现。
【提出问题】铝片与浓氯化铜溶液反应出现的白色沉淀的组成是什么?
【查阅资料】①AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
②CuCl为白色固体,不溶于水、乙醇;溶于浓盐酸且溶液变褐色;溶于浓氨水且溶液变蓝色。
【提出假设】假设a:该白色沉淀可能含有CuCl;
假设b:该白色沉淀可能含有AlCl3;
假设c:该白色沉淀可能含有Al。
【设计实验】取白色沉淀分别进行如下实验。
【得出结论】由实验①可判断假设c不成立,再结合实验②③的现象可得出该白色沉淀的成分是______ 。
【反思评价】为探究铝与氯化铜溶液反应生成CuCl的条件,小组同学查阅相关资料发现:铝和氯化铜溶液反应分两步:Cu2+ Cu+
Cu+ Cu。当反应恰好生成 CuCl时,铝与铜离子的个数比为
Cu。当反应恰好生成 CuCl时,铝与铜离子的个数比为______ 。
(1)小明设计的实验方案是:先用砂纸打磨铝片和铜片,“打磨"的目的是
(2)小芳将打磨干净的铝片放入浓氯化铜溶液中,看到有大量气泡逸出,还有“白色沉淀"这一现象出现。
【提出问题】铝片与浓氯化铜溶液反应出现的白色沉淀的组成是什么?
【查阅资料】①AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
②CuCl为白色固体,不溶于水、乙醇;溶于浓盐酸且溶液变褐色;溶于浓氨水且溶液变蓝色。
【提出假设】假设a:该白色沉淀可能含有CuCl;
假设b:该白色沉淀可能含有AlCl3;
假设c:该白色沉淀可能含有Al。
【设计实验】取白色沉淀分别进行如下实验。
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量浓盐酸 | |
| ② | 加入适量无水乙醇 | 固体部分溶解 |
| ③ | 加入适量 | 固体溶解,得到蓝色溶液 |
【反思评价】为探究铝与氯化铜溶液反应生成CuCl的条件,小组同学查阅相关资料发现:铝和氯化铜溶液反应分两步:Cu2+
 Cu+
Cu+ Cu。当反应恰好生成 CuCl时,铝与铜离子的个数比为
Cu。当反应恰好生成 CuCl时,铝与铜离子的个数比为
您最近一年使用:0次



