硅钢是变压器、充电器中的核心材料,其主要成份是Fe和Si。某学生用硅钢样品做了如下实验:取4.2g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其它杂质不反应),充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
(1)从以上数据可知,稀硫酸加入第______次后,铁恰好完全反应。
(2)表格中M=__________。
(3)计算所用稀硫酸中溶质的质量分数_________。
| 实验次数 | 一 | 二 | 三 | 四 | 五 | 六 |
| 稀硫酸的用量/g | 10 | 10 | 10 | 10 | 10 | 10 |
| 剩余固体的质量/g | M | 2.8 | 2.1 | 1.4 | 0.7 | 0.7 |
(1)从以上数据可知,稀硫酸加入第______次后,铁恰好完全反应。
(2)表格中M=__________。
(3)计算所用稀硫酸中溶质的质量分数_________。
更新时间:2015-03-20 16:32:42
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】化学兴趣小组的同学对某铁的合金(杂质全部为碳)进行组成分析。取该合金样品17.5g于烧杯中,向烧杯中加入某浓度的稀硫酸200g,恰好完全反应,反应的化学方程式为Fe+H2SO4=FeSO4+H2↑,测得烧杯中剩余物质的质量为216.9g。请计算该铁的合金样品中铁的质量分数。
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】实验室用锌跟足量的稀硫酸反应制取氢气。若要制得0.4g的氢气,需要锌的质量是多少?
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
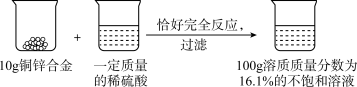
【推荐1】某小组同学进行了如图所示的实验,恰好完全反应请计算:

(1)生成氢气的质量是______ g。
(2)所用稀盐酸溶质的质量分数是多少。(写出计算过程)

(1)生成氢气的质量是
(2)所用稀盐酸溶质的质量分数是多少。(写出计算过程)
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】铁铜金属粉末常用于生产机械零件。为测定某铁铜金属粉末中铁粉的含量,取20g样品于烧杯中,逐滴加入稀硫酸充分反应后,测得固体质量随加入稀硫酸的质量关系如图所示。计算:
(2)生成氢气的质量。
(3)恰好完全反应时,所得溶液中溶质的质量分数。

(2)生成氢气的质量。
(3)恰好完全反应时,所得溶液中溶质的质量分数。
您最近一年使用:0次