某化学兴趣小组在实验室做了如下两个探究实验:
(1)实验一;探究学生分组实验废弃液中溶质的成分,并回收处理。
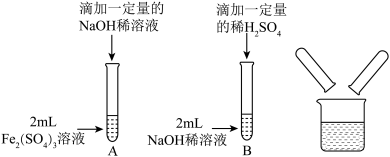
将学生分组实验A、B两支试管中的废弃液同时倒入一洁净的烧杯中,混合,观察到有红褐色沉淀生成,过滤后,对所得滤液中溶质的成分进行探究。
【资料】硫酸钠晶体( ),用于化学和医药工业,水溶液呈中性。
),用于化学和医药工业,水溶液呈中性。
【假设】假设1:滤液中的溶质是 ;
;
假设2:滤液中的溶质是 、
、 ;
;
假设3:滤液中的溶质是 、
、 、
、
假设4:滤液中的溶质还可能是_____________ 。
【讨论】你认为上述假设中____________ 一定不合理,理由是____________ ;如果滤液为无色,还可排除的假设是____________ 。
【实验】某同学通过以下实验方案及现象证明假设4成立,请补充完成下表实验。
【处理】请你设计一个从上述滤液中回收硫酸钠晶体的方案:____________ .
(2)实验二:探究植物营养液中溶质的成分及其含量。
某植物营养液中可能含有 、
、 、
、 、
、 中的两种或两种以上的氮、钾化肥。为确认溶质的组成及其质量分数进行如下实验:①取100g上述溶液,加入足量
中的两种或两种以上的氮、钾化肥。为确认溶质的组成及其质量分数进行如下实验:①取100g上述溶液,加入足量 溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.66g,向沉淀中加入过量的稀硝酸,沉淀不溶解;②将①的滤液加热,产生能使湿润红色石蕊试纸变蓝的气体,气体经生石灰干燥后全部被稀硫酸吸收,稀硫酸增重0.85g;③待②的滤液冷却后加入稀硝酸酸化,再加入足量的
溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.66g,向沉淀中加入过量的稀硝酸,沉淀不溶解;②将①的滤液加热,产生能使湿润红色石蕊试纸变蓝的气体,气体经生石灰干燥后全部被稀硫酸吸收,稀硫酸增重0.85g;③待②的滤液冷却后加入稀硝酸酸化,再加入足量的 溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀2.87g。由此判断:该植物营养液中溶质成分及其质量分数是
溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀2.87g。由此判断:该植物营养液中溶质成分及其质量分数是_______ ,含氮量为__________ %,含钾量为__________ %。
(1)实验一;探究学生分组实验废弃液中溶质的成分,并回收处理。
将学生分组实验A、B两支试管中的废弃液同时倒入一洁净的烧杯中,混合,观察到有红褐色沉淀生成,过滤后,对所得滤液中溶质的成分进行探究。

【资料】硫酸钠晶体(
 ),用于化学和医药工业,水溶液呈中性。
),用于化学和医药工业,水溶液呈中性。【假设】假设1:滤液中的溶质是
 ;
;假设2:滤液中的溶质是
 、
、 ;
;假设3:滤液中的溶质是
 、
、 、
、
假设4:滤液中的溶质还可能是
【讨论】你认为上述假设中
【实验】某同学通过以下实验方案及现象证明假设4成立,请补充完成下表实验。
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,滴入 | 假设4正确 |
(2)实验二:探究植物营养液中溶质的成分及其含量。
某植物营养液中可能含有
 、
、 、
、 、
、 中的两种或两种以上的氮、钾化肥。为确认溶质的组成及其质量分数进行如下实验:①取100g上述溶液,加入足量
中的两种或两种以上的氮、钾化肥。为确认溶质的组成及其质量分数进行如下实验:①取100g上述溶液,加入足量 溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.66g,向沉淀中加入过量的稀硝酸,沉淀不溶解;②将①的滤液加热,产生能使湿润红色石蕊试纸变蓝的气体,气体经生石灰干燥后全部被稀硫酸吸收,稀硫酸增重0.85g;③待②的滤液冷却后加入稀硝酸酸化,再加入足量的
溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.66g,向沉淀中加入过量的稀硝酸,沉淀不溶解;②将①的滤液加热,产生能使湿润红色石蕊试纸变蓝的气体,气体经生石灰干燥后全部被稀硫酸吸收,稀硫酸增重0.85g;③待②的滤液冷却后加入稀硝酸酸化,再加入足量的 溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀2.87g。由此判断:该植物营养液中溶质成分及其质量分数是
溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀2.87g。由此判断:该植物营养液中溶质成分及其质量分数是
更新时间:2019/08/26 10:46:51
|
相似题推荐
科学探究题
|
困难
(0.15)
解题方法
【推荐1】果蔬杀虫剂含有有机磷,一种“果蔬洗盐”可有效去除有机磷并杀死细菌。同学们对果蔬洗盐的组成进行了探究。
【查阅资料】
①果蔬洗盐中至少含NaCl,Na2CO3或NaHCO3中的一种;
②Na2CO3和NaHCO3溶液均呈碱性;
③碳酸银和碳酸氢银在水中均会产生沉淀。
④Na2CO3热稳定性好,NaHCO3受热易分解,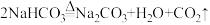
任务一:定性探究果蔬洗盐组成
(1)将果蔬洗盐加水搅拌至充分溶解后,溶液中一定含有的阳离子是_______ 。
(2)为了确定其成分,小组同学用配制好的溶液进行实验,请补充实验内容:
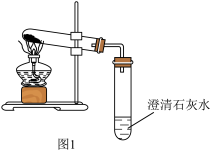
(3)甲同学利用性质差异设计实验(如图1)确定组成,取5 g果蔬洗盐于试管中进行加热,将生成的气体通入澄清石灰水,观察到澄清石灰水变浑浊,该实验说明果蔬洗盐中含有_______ 。
(4)为进一步确定果蔬洗盐的组成及含量,同学们运用定量思想补充了下列实验:_______ ;
操作二:将操作一生成的气体依次通入图2的装置除去所含杂质,测得C装置增重1.10 g,可通过定量计算得出5 g果蔬洗盐中含有的成分和质量为_______ 。
任务三:认识果蔬洗盐的洗涤原理及使用方法
(5)洗涤原理:有机磷在碱性环境中易分解,同时利用浓度合适的盐水使细菌失水失去活性。若不按照说明书上水和果蔬洗盐的比例进行使用,可能导致的后果为_______ 。
【查阅资料】
①果蔬洗盐中至少含NaCl,Na2CO3或NaHCO3中的一种;
②Na2CO3和NaHCO3溶液均呈碱性;
③碳酸银和碳酸氢银在水中均会产生沉淀。
④Na2CO3热稳定性好,NaHCO3受热易分解,
任务一:定性探究果蔬洗盐组成
(1)将果蔬洗盐加水搅拌至充分溶解后,溶液中一定含有的阳离子是
(2)为了确定其成分,小组同学用配制好的溶液进行实验,请补充实验内容:
| 操作 | 现象 | 结论 |
| 取少许溶液于试管中,滴加2滴酚酞试液。 | 果蔬洗盐中含有Na2CO3或NaHCO3中至少一种 | |
| 取少许溶液于试管中,先加入足量稀硝酸,再 | 果蔬洗盐中含有NaCl |
(3)甲同学利用性质差异设计实验(如图1)确定组成,取5 g果蔬洗盐于试管中进行加热,将生成的气体通入澄清石灰水,观察到澄清石灰水变浑浊,该实验说明果蔬洗盐中含有
(4)为进一步确定果蔬洗盐的组成及含量,同学们运用定量思想补充了下列实验:
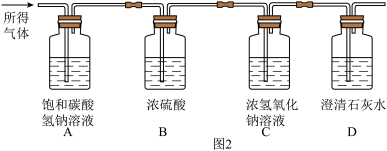
操作二:将操作一生成的气体依次通入图2的装置除去所含杂质,测得C装置增重1.10 g,可通过定量计算得出5 g果蔬洗盐中含有的成分和质量为
任务三:认识果蔬洗盐的洗涤原理及使用方法
(5)洗涤原理:有机磷在碱性环境中易分解,同时利用浓度合适的盐水使细菌失水失去活性。若不按照说明书上水和果蔬洗盐的比例进行使用,可能导致的后果为
您最近一年使用:0次
科学探究题
|
困难
(0.15)
真题
解题方法
【推荐2】碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质.
【查阅资料】
①Na2CO3+CaCl2═CaCO3↓+2NaCl
②2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
③Ca(HCO3)2 易溶于水.
④CaCl2 溶液分别与 NaHCO3、Na2CO3 溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数):
【进行实验】
【解释与结论】
(1)实验1中,NaHCO3与盐酸反应的化学方程式为_____ .
(2)实验2中,试剂a为_____ .
(3)实验3中,NaHCO3 与 CaCl2 反应的化学方程式为:2NaHCO3+CaCl2═_____ +_____ +_____ +H2O
【反思与评价】
(1)实验 2 中,加热 NaHCO3后,试管Ⅰ中残留固体成分可能为_____ (写出所有可能).
(2)资料④中,NaHCO3溶液与 CaCl2 溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是_____ .
(3)用2种不同的方法鉴别Na2CO3和NaHCO3 固体,实验方案分别为:
①_____ .
②_____ .
【查阅资料】
①Na2CO3+CaCl2═CaCO3↓+2NaCl
②2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O③Ca(HCO3)2 易溶于水.
④CaCl2 溶液分别与 NaHCO3、Na2CO3 溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数):
| NaHCO3 | Na2CO3 | ||||
| 0.1% | 1% | 5% | 0.1% | ||
| CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
| 1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
| 5% | 无明显现象 | 有浑浊 | 有沉淀,有大量气泡 | 有沉淀 | |
【进行实验】
| 序号 | 实验装置 | 主要实验步骤 | 实验现象 |
| 实验 1 |  | 向2支试管中分别加入少 量Na2CO3 和 NaHCO3 溶液,再分别滴加盐酸 | 2 支试管中均有气泡产生 |
| 实验 2 | 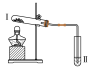 | 向Ⅱ中加入试剂a,向Ⅰ中 加入少量Na2CO3或 NaHCO3 固体,分别加热一段时间 | Na2CO3 受热时Ⅱ中无明 显现象 NaHCO3 受热时Ⅱ中出现浑浊 |
| 实验 3 | 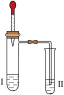 | 向Ⅱ中加入试剂 a,向Ⅰ中 加入少量 5%的 NaHCO3 溶 液,再滴加 5%的 CaCl2 溶 液 | Ⅰ中出现浑浊,有气泡产 生Ⅱ中出现浑浊 |
【解释与结论】
(1)实验1中,NaHCO3与盐酸反应的化学方程式为
(2)实验2中,试剂a为
(3)实验3中,NaHCO3 与 CaCl2 反应的化学方程式为:2NaHCO3+CaCl2═
【反思与评价】
(1)实验 2 中,加热 NaHCO3后,试管Ⅰ中残留固体成分可能为
(2)资料④中,NaHCO3溶液与 CaCl2 溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是
(3)用2种不同的方法鉴别Na2CO3和NaHCO3 固体,实验方案分别为:
①
②
您最近一年使用:0次
科学探究题
|
困难
(0.15)
解题方法
【推荐3】碱式碳酸镁高温能分解,可用于镁盐制备,制药工业等。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
Ⅰ.研究其分解产物
(1)取样高温灼烧,检测到有二氧化碳和水生成,充分反应后,得到白色固体,由此推断生成物中肯定不含金属镁及单质碳,理由是___ 。
(2)检验生成物中是否含有碳酸镁、氢氧化镁。
(3)用酚酞试液检验是否存在氢氧化镁不能用冷水代替热水是因为 ___ 。综合上述实验推断碱式碳酸镁的分解产物为二氧化碳、水和 _________ 。
Ⅱ.测定碱式碳酸镁中碳元素的质量分数
按下图一进行实验。
①量气管中装有饱和碳酸氢钠溶液,不能用水代替是因为___ ,若用稀盐酸代替稀硫酸,则测出碳元素的质量分数将 ___ (填“偏大”、“偏小”或“无影响”)。
②实验中共消耗稀硫酸20mL,根据所测数据求得生成气体的质量为1.32g,则进入量气管的气体体积为___ ,碳元素的质量分数为 ___ 。(实验条件下CO2密度为1.97g/L)

Ⅲ.确定碱式碳酸镁的组成
设计如上图二装置,并按下述步骤操作。
步骤1:检查装置的气密性,将36.4g样品置于试管中,称量装置B的质量为192g。
步骤2:加热装置A直至样品完全反应。
步骤3:用止水夹夹紧装置A和装置B间胶皮管,停止加热,冷却至室温。
步骤4:称量装置B的质量为199.2g。
(1)装置B中物质为___ ,装置C的作用为 ___ 。判断样品完全反应的方法:当观察到装置B中 ___ ,则样品已完全反应。
(2)根据上述实验数据求出碱式碳酸镁的化学式,写出计算过程。____
Ⅵ.有人说“加热碱式碳酸镁最后阶段固体质量减少是因为生成二氧化碳”是真的吗?
另取一定量碱式碳酸镁样品在空气中加热,测出样品的固体残留率(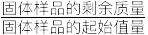 ×100%)随温度的变化如图所示,请回答下列问题。
×100%)随温度的变化如图所示,请回答下列问题。

①0至t1℃过程中固体质量保持不变的原因是___ 。
②分析图像数据判定该说法是___ (填“真的”或“假的”),判定理由是 ___ 。
Ⅰ.研究其分解产物
(1)取样高温灼烧,检测到有二氧化碳和水生成,充分反应后,得到白色固体,由此推断生成物中肯定不含金属镁及单质碳,理由是
(2)检验生成物中是否含有碳酸镁、氢氧化镁。
| 操作现象 | 结论 | |
| ① | 取适量生成物置于试管中, | 生成物中不含碳酸镁。 |
| ② | 取适量生成物置于试管中,加入热水,滴入酚酞试液,观察到 | 生成物中不含氢氧化镁。 |
Ⅱ.测定碱式碳酸镁中碳元素的质量分数
按下图一进行实验。
①量气管中装有饱和碳酸氢钠溶液,不能用水代替是因为
②实验中共消耗稀硫酸20mL,根据所测数据求得生成气体的质量为1.32g,则进入量气管的气体体积为

Ⅲ.确定碱式碳酸镁的组成
设计如上图二装置,并按下述步骤操作。
步骤1:检查装置的气密性,将36.4g样品置于试管中,称量装置B的质量为192g。
步骤2:加热装置A直至样品完全反应。
步骤3:用止水夹夹紧装置A和装置B间胶皮管,停止加热,冷却至室温。
步骤4:称量装置B的质量为199.2g。
(1)装置B中物质为
(2)根据上述实验数据求出碱式碳酸镁的化学式,写出计算过程。
Ⅵ.有人说“加热碱式碳酸镁最后阶段固体质量减少是因为生成二氧化碳”是真的吗?
另取一定量碱式碳酸镁样品在空气中加热,测出样品的固体残留率(
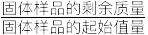 ×100%)随温度的变化如图所示,请回答下列问题。
×100%)随温度的变化如图所示,请回答下列问题。
①0至t1℃过程中固体质量保持不变的原因是
②分析图像数据判定该说法是
您最近一年使用:0次
科学探究题
|
困难
(0.15)
解题方法
【推荐1】化学实验室里有两瓶失去标签的无色溶液,分别是氢氧化钠溶液和碳酸钠溶液,老师组织同学们展开下列实验探究活动。
【课前讨论】
可用酚酞试液鉴别氢氧化钠溶液和碳酸钠溶液。这种说法___________ (填“正确”或“不正确”),理由是___________________ 。
【鉴别实验】将两瓶无色溶液分别编号为A、B,分成三组进行鉴别。鉴别方案如下表,每次鉴别实验都取少量的A、B分别加入两支试管中,再加入相应的鉴别试剂。
【得出结论】
A溶液为______________________________ 。
【成分分析】
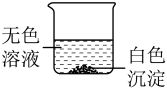
鉴别实验结束后,同学们将六支试管中的剩余物全部倒入一个洁净的大烧杯中(如图),充分搅拌、静置。观察到杯内上层是无色溶液,下层有白色沉淀。由此可以确定:在上层无色溶液中,一定含有氯化钠,一定不含有的溶质是_______________ (填化学式)。
【实验探究】
同学们分组设计如下实验方案,探究烧杯中的无色溶液中可能含有的溶质。
【反思与评价】小姗同学认为实验还不能结束,无色溶液中还有一种成分不能确定。于是带领大家设计了如图所示的实验方案:
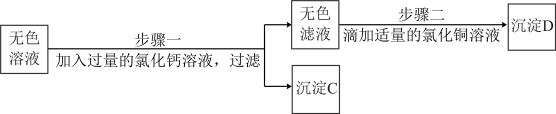
(1)步骤一中加入过量氯化钙溶液的目的是_______________ 。
(2)写出生成沉淀D的化学方程式_________________ 。
【废液处理】
在老师的指导下,同学们将废液转化处理,并获得氯化钠固体。他们的实验操作是:先向无色溶液中滴加______________ ,边滴加边不断搅拌直到pH=_____________ 。再经过蒸发结晶得到氯化钠固体。
【课前讨论】
可用酚酞试液鉴别氢氧化钠溶液和碳酸钠溶液。这种说法
【鉴别实验】将两瓶无色溶液分别编号为A、B,分成三组进行鉴别。鉴别方案如下表,每次鉴别实验都取少量的A、B分别加入两支试管中,再加入相应的鉴别试剂。
| 鉴别试剂 | 实验现象 |
| ①稀盐酸 | A中现象明显,B中无明显现象 |
| ②氢氧化钙溶液 | |
| ③氯化钙溶液 |
A溶液为
【成分分析】
鉴别实验结束后,同学们将六支试管中的剩余物全部倒入一个洁净的大烧杯中(如图),充分搅拌、静置。观察到杯内上层是无色溶液,下层有白色沉淀。由此可以确定:在上层无色溶液中,一定含有氯化钠,一定不含有的溶质是

【实验探究】
同学们分组设计如下实验方案,探究烧杯中的无色溶液中可能含有的溶质。
| 实验步骤 | 实验现象 | 实验结论 | |
| 小雅组 | 取少量无色溶液于试管中, 滴加1~2滴无色酚酞溶液 | 在无色溶液中,一定含有碳酸钠,一定没有的溶质是 | |
| 小浩组 | 取少量无色溶液于试管中,滴加足量稀盐酸 | ||
| 小非组 | 取少量无色溶液于试管中,滴加少量碳酸钠溶液” | 无明显现象 |
【反思与评价】小姗同学认为实验还不能结束,无色溶液中还有一种成分不能确定。于是带领大家设计了如图所示的实验方案:

(1)步骤一中加入过量氯化钙溶液的目的是
(2)写出生成沉淀D的化学方程式
【废液处理】
在老师的指导下,同学们将废液转化处理,并获得氯化钠固体。他们的实验操作是:先向无色溶液中滴加
您最近一年使用:0次
科学探究题
|
困难
(0.15)
真题
解题方法
【推荐2】科学探究是认识和解决化学问题的重要实践活动。
近年来,自热食品种类繁多。只需将撕去塑料膜的发热包放入凉水中,就能享用美食,很受年轻人的追捧。实验小组同学买来一份自热食品进行以下探究。
【资料】Ⅰ、发热包中物质的主要成分是生石灰、碳酸钠、铝粒。
Ⅱ、铝能和NaOH溶液反应生成偏铝酸钠(NaAlO2)和氢气,偏铝酸钠溶于水。
探究一:发热包的发热原理。
(1)小组同学取出发热包,撕去塑料膜,放入适量凉水中,可观察到的现象是______ ,固体迅速膨胀,同时还可观察到发热包内固体变硬结块,其可能的原因是______ (用化学方程式表示)。
(2)在使用发热包过程中,禁止明火的理由是______ 。
探究二:反应后混合物中部分成分的探究。
(3)操作Ⅰ的名称是______ 。
(4)根据现象①得出:滤液A中一定不含的物质是______ 。根据现象②③分析得出:固体B中一定含有的物质是______ 。综合分析得出:现象③中产生的气体,其成分的组成可能为______ 。
(5)通过以上探究,同学们进行反思总结,你认为其中正确的是______ 。
A.能与水混合放出热量的物质均可做发热包的发热材料
B.发热包应密封防潮保存
C.禁止用湿手接触发热包
D.使用过程中应保持通风
近年来,自热食品种类繁多。只需将撕去塑料膜的发热包放入凉水中,就能享用美食,很受年轻人的追捧。实验小组同学买来一份自热食品进行以下探究。
【资料】Ⅰ、发热包中物质的主要成分是生石灰、碳酸钠、铝粒。
Ⅱ、铝能和NaOH溶液反应生成偏铝酸钠(NaAlO2)和氢气,偏铝酸钠溶于水。
探究一:发热包的发热原理。
(1)小组同学取出发热包,撕去塑料膜,放入适量凉水中,可观察到的现象是
(2)在使用发热包过程中,禁止明火的理由是
探究二:反应后混合物中部分成分的探究。
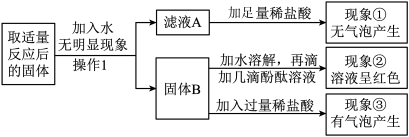
(3)操作Ⅰ的名称是
(4)根据现象①得出:滤液A中一定不含的物质是
(5)通过以上探究,同学们进行反思总结,你认为其中正确的是
A.能与水混合放出热量的物质均可做发热包的发热材料
B.发热包应密封防潮保存
C.禁止用湿手接触发热包
D.使用过程中应保持通风
您最近一年使用:0次
科学探究题
|
困难
(0.15)
名校
解题方法
【推荐3】小乐完成了图示甲、乙实验后,依次将反应后的溶液缓慢倒入同一洁净的废液缸中,观察到废液缸中先有气泡产生,然后又出现白色沉淀。
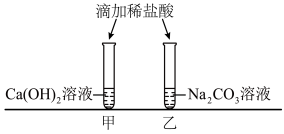
(1)甲实验结束后,试管中的废液含______ 。
(2)乙实验结束后,试管中的废液含________ 。
(3)废液缸中产生气泡的化学反应方程式是______ 。
同学们对废液缸中溶质成分进行探究。
【提出问题】废液缸中所含溶质是什么?
【作出猜想】
猜想一:废液中的溶质可能是NaCl;
猜想二:废液中的溶质可能是NaCl、HCl;
猜想三:废液中的溶质可能是NaCl、Na2CO3;猜想四:废液中的溶质可能是NaCl、CaCl2。
有人提出,只用分析就能得出猜想______ 错误,因为__________ 。
【设计实验】同学们为验证其他猜想,设计了如下实验:
【定量实验】
现有一份质量为38.3g的固体混合物,由NaCl、Na2CO3和NaOH组成。
小乐将其溶于215.1g水中,配成溶液,然后往其中加入10%的盐酸溶液。产生气体的质量与所加盐酸溶液的质量关系如图所示。据图计算(要求写出计算过程):
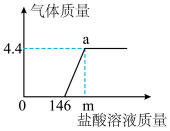
(1)原混合物中Na2CO3的质量______ 。
(2)m的值______ 。
(3)a点所示溶液中溶质的质量分数______ 。

(1)甲实验结束后,试管中的废液含
(2)乙实验结束后,试管中的废液含
(3)废液缸中产生气泡的化学反应方程式是
同学们对废液缸中溶质成分进行探究。
【提出问题】废液缸中所含溶质是什么?
【作出猜想】
猜想一:废液中的溶质可能是NaCl;
猜想二:废液中的溶质可能是NaCl、HCl;
猜想三:废液中的溶质可能是NaCl、Na2CO3;猜想四:废液中的溶质可能是NaCl、CaCl2。
有人提出,只用分析就能得出猜想
【设计实验】同学们为验证其他猜想,设计了如下实验:
| 实验操作与现象 | 反应方程式 | 实验结论 |
| 小芳取少量废液缸中的废液于试管中,滴加澄清石灰水,有白色沉淀产生 | 猜想三正确 |
现有一份质量为38.3g的固体混合物,由NaCl、Na2CO3和NaOH组成。
小乐将其溶于215.1g水中,配成溶液,然后往其中加入10%的盐酸溶液。产生气体的质量与所加盐酸溶液的质量关系如图所示。据图计算(要求写出计算过程):

(1)原混合物中Na2CO3的质量
(2)m的值
(3)a点所示溶液中溶质的质量分数
您最近一年使用:0次



