解题方法
1 . 富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
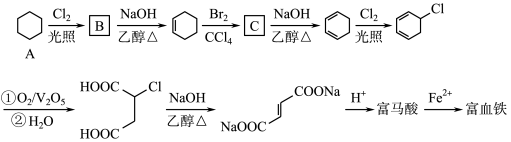
回答下列问题:
(1)A的化学名称为:_________________ ,由A生成B的反应类型为:___________
(2)C的结构简式为:______________ ,加热时,C与NaOH的乙醇溶液反应的化学方程式为:___________
(3)富马酸的结构简式为:___________
(4)检验富血铁中是否含有Fe3+的实验操作步骤是:___________
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出_______ L CO2(标况);富马酸的同分异构体中,同为二元羧酸的还有(写出结构简式):___________ 、___________ 。

回答下列问题:
(1)A的化学名称为:
(2)C的结构简式为:
(3)富马酸的结构简式为:
(4)检验富血铁中是否含有Fe3+的实验操作步骤是:
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出
您最近一年使用:0次
2 . 某实验小组对KSCN的性质进行探究,设计如下实验:
(1)SCN-存在两种结构式,分别为N≡C—S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C—S-的电子式__________ 。
(2)用离子方程式表示FeSO4溶液显酸性的原因__________ 。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因____________________________ 。
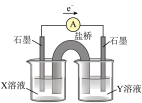
②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如如图实验装置证实了猜想是成立的。其中X溶液是_______ ,Y溶液是_______ ,检验产物SO42-的操作及现象是_____________ 。
(4)针对实验Ⅱ“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN- [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
乙同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-⇌[Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:
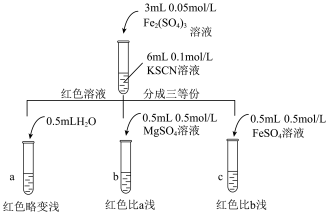
由此推测,实验Ⅱ“红色明显变浅”的原因是___________________ 。
(5)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是______ 。
| 试管中试剂 | 实验 | 滴加试剂 | 现象 |
 | Ⅰ | ⅰ.先加1mL 0.1 mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
| Ⅱ | ⅲ.先加1mL 0.05 mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C—S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C—S-的电子式
(2)用离子方程式表示FeSO4溶液显酸性的原因
(3)①用离子方程式表示实验Ⅰ溶液变红的原因

②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如如图实验装置证实了猜想是成立的。其中X溶液是
(4)针对实验Ⅱ“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-
 [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。乙同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-⇌[Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:

由此推测,实验Ⅱ“红色明显变浅”的原因是
(5)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是
您最近一年使用:0次
2019-04-03更新
|
647次组卷
|
2卷引用:【区级联考】北京市石景山区2019届高三一模考试化学试题



