23-24高一下·全国·单元测试
解题方法
1 . 化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
(2)为了探究化学反应中的能量变化,某兴趣小组设计了如下两个实验(如图所示)。试回答下列问题:
①有关反应一段时间后的实验现象,下列说法正确的是___________ 。
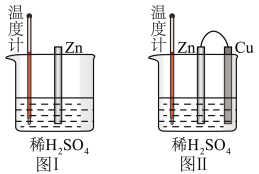
A.图I中温度计的示数高于图II的示数
B.图I中锌片是负极,图II中铜片是正极
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速率比I慢
E.图I和图II中溶液酸性均增强
F.图II的外电路中电流方向Zn→Cu。
②在图II实验中,兴趣小组观察到的实验现象是___________ ,写出图II实验中铜上电极反应式___________ 。
③在图II实验中,如果把硫酸换成硫酸铜溶液,请写出电池总反应的离子方程式:___________ ;当电路中转移0.25mol电子时,消耗负极材料的质量为___________ g[M(Zn)=65g/mol]。
(3)根据原电池原理可以制造化学电池。如:电动汽车上用的铅蓄电池是由一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板做为两电极,用H2SO4作电解质溶液构成。放电时,电池总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。试写出放电时正极的电极反应式:___________ 。
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以C为电极,CH3OH为燃料,采用氢氧化钠溶液为电解液,电池工作时消耗1molCH3OH,则电路中通过___________ mol电子。
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
| A.KOH+HCl=KCl+H2O | B.Cu+Fe3+=Fe2++Cu2+ |
| C.Na2O+H2O=2NaOH | D.Fe+H2SO4=FeSO4+H2↑ |
(2)为了探究化学反应中的能量变化,某兴趣小组设计了如下两个实验(如图所示)。试回答下列问题:
①有关反应一段时间后的实验现象,下列说法正确的是

A.图I中温度计的示数高于图II的示数
B.图I中锌片是负极,图II中铜片是正极
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速率比I慢
E.图I和图II中溶液酸性均增强
F.图II的外电路中电流方向Zn→Cu。
②在图II实验中,兴趣小组观察到的实验现象是
③在图II实验中,如果把硫酸换成硫酸铜溶液,请写出电池总反应的离子方程式:
(3)根据原电池原理可以制造化学电池。如:电动汽车上用的铅蓄电池是由一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板做为两电极,用H2SO4作电解质溶液构成。放电时,电池总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。试写出放电时正极的电极反应式:
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以C为电极,CH3OH为燃料,采用氢氧化钠溶液为电解液,电池工作时消耗1molCH3OH,则电路中通过
您最近一年使用:0次



