名校
1 . 某小组为了探究硫酸的性质,设计如下实验:
回答下列问题:
(1)实验①没有明显现象的原因是___________ ;改变一个条件,为使实验①中的反应持续发生,改变条件是___________ 。
(2)为了引发实验②中的反应,宜采取的措施是___________ ;实验后,观察产物水溶液的颜色,其操作方法是___________ 。
(3)实验④产生的气体是___________ (填化学式),比较实验③和④可知,从氧化还原角度分析,H+的作用是___________ ;写出该反应的离子方程式:___________ 。
(4)向实验④所得溶液中加入过量NaOH溶液得到沉淀M,用元素分析仪分析,M为铜的氧化物,提纯干燥后的M在惰性气体氛围下加热,12 g M完全分解为10 g CuO。M的化学式为___________ ;M能与稀硫酸酸化的KI溶液反应生成白色沉淀CuI(碘化亚铜),在滤液中加入淀粉溶液,溶液变蓝色。写出M和稀硫酸酸化的KI溶液反应的离子方程式:___________ 。
| 序号 | 操作 | 现象 |
| ① | 常温下,在铁片中加入过量的浓硫酸 | 没有明显现象 |
| ② | 常温下,在铜片上加入过量的浓硫酸 | 没有明显现象 |
| ③ | 在铜和过量30%H2O2的混合溶液中加入Na2SO4溶液 | 没有明显现象 |
| ④ | 在铜和过量30%H2O2的混合溶液中加入稀硫酸 | 溶液变蓝色,并产生气泡 |
(1)实验①没有明显现象的原因是
(2)为了引发实验②中的反应,宜采取的措施是
(3)实验④产生的气体是
(4)向实验④所得溶液中加入过量NaOH溶液得到沉淀M,用元素分析仪分析,M为铜的氧化物,提纯干燥后的M在惰性气体氛围下加热,12 g M完全分解为10 g CuO。M的化学式为
您最近一年使用:0次
2023-10-22更新
|
134次组卷
|
6卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期11月月考化学试题
名校
解题方法
2 . 金属Na、Mg、Al有广泛的应用。
(1)Al在元素周期表中的位置是______ 。
(2)金属镁可以用来生产金属铀(元素符号是U): ,该反应中,作为还原剂的物质是
,该反应中,作为还原剂的物质是______ (填化学式,下同),被还原的物质是______ 。
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
由实验1和实验2得出的结论是:金属性,______ >______ >______ (填元素符号),用原子结构理论解释:同周期元素从左到右,______ 。
(4)写出Na和Al最高价氧化物的水化物相互反应的离子反应方程式______ 。
(1)Al在元素周期表中的位置是
(2)金属镁可以用来生产金属铀(元素符号是U):
 ,该反应中,作为还原剂的物质是
,该反应中,作为还原剂的物质是(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
| 实验1 | 实验2 |
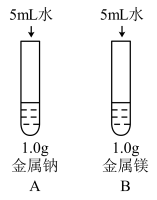 |  |
| 钠与水反应剧烈,镁与水反应缓慢 | 镁与盐酸反应剧烈,铝与盐酸反应缓慢 |
由实验1和实验2得出的结论是:金属性,
(4)写出Na和Al最高价氧化物的水化物相互反应的离子反应方程式
您最近一年使用:0次
2022-12-14更新
|
99次组卷
|
2卷引用:新疆伊宁市第八中学2021-2022学年高一上学期期末考试化学试题



