2014-2015江苏省扬州市高一上学期期末化学试卷
江苏
高一
期末
2017-07-26
1458次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、常见无机物及其应用、化学反应原理、化学实验基础
一、单选题 添加题型下试题
| A.推广和鼓励多使用公共交通工具出行 |
| B.大量使用化肥农药,提高农作物产量 |
| C.大力发展太阳能和风力发电 |
| D.对燃煤进行脱硫,减少空气的污染 |
【知识点】 能源开发利用新理念
| A.Na2SO4电离:Na2SO4=Na2++SO42- |
B.Cl-的结构示意图: |
C.质子数为6,中子数为8的微粒: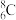 |
| D.医用“钡餐”的化学式:BaSO4 |
| A.钠在氯气中燃烧制氯化钠 | B.二氧化锰和浓盐酸共热制氯气 |
| C.氯气与消石灰反应制漂白粉 | D.电解NaCl溶液制金属钠 |
| A.CO2 | B.Al | C.Na2CO3 | D.蔗糖 |
【知识点】 电解质与非电解质
| A.氧化铝常用于制造耐火材料 | B.浓硫酸用于干燥氨气 |
| C.生产水泥的主要原料是黏土、纯碱 | D.Na2O用作呼吸面具的供氧剂 |
| A.用NaOH溶液鉴别SO2和CO2两种气体 |
| B.用淀粉溶液检验溶液中是否存在碘单质 |
| C.用BaCl2溶液鉴别Na2SO4和Na2CO3两种溶液 |
| D.用FeCl2溶液检验新制氯水中含有HClO |
【知识点】 化学实验基础
| A.500 mL 1 mol/L的KNO3溶液 | B.500 mL1 mol/L的Ba(NO3)2溶液 |
| C.1000 mL 0.5 mol/L的Mg(NO3)2溶液 | D.1 L 0.5 mol/L的Fe(NO3)3溶液 |
【知识点】 物质的量浓度计算-与溶质成分有关的计算解读
| A.Na+、Al3+、NO3-、H+ | B.Ba2+、Na+、Cl-、SO42- |
| C.Mg2+、H+、SO42-、OH- | D.H+、Na+、CO32-、Cl- |
【知识点】 离子共存
A. 灼烧固体 灼烧固体 | B.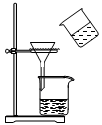 过滤 过滤 | C.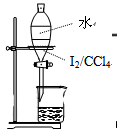 分液 分液 | D.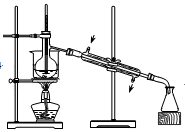 蒸馏 蒸馏 |

| A.流程中涉及的反应均为非氧化还原反应 |
| B.反应②产生的阴离子主要为CO32- |
| C.反应③在实验室中应在蒸发皿中进行 |
| D.反应④的条件是对熔融状态下的反应物进行电解 |
【知识点】 铝三角转化解读 铝土矿提取铝的综合考查解读
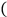

| A.常温下溶解度:Na2CO3<NaHCO3 |
| B.热稳定性:Na2CO3<NaHCO3 |
| C.与同浓度盐酸反应的剧烈程度:Na2CO3>NaHCO3 |
| D.与澄清石灰水反应,均有白色沉淀生成 |
【知识点】 碳酸钠与碳酸氢钠性质的比较解读
| A.1 mol Cl2 与足量的铁反应转移的电子数是 2NA |
| B.常温常压下 22.4 L HCl 气体含有的分子数是NA |
| C.0.1 mol • L-1 CuCl2 溶液中 Cl-数目是 0.2 NA |
| D.32 gO2 中含有的原子数是NA |
【知识点】 阿伏加德罗常数的求算解读
| 物 质 | 除杂试剂 | 分离方法 | |
| A | I2(CCl4) | —— | 过滤 |
| B | Cl2(HCl) | NaOH溶液 | 洗气 |
| C | KNO3(KCl) | —— | 降温结晶 |
| D | Al(Fe) | NaOH溶液 | 过滤 |
| A.A | B.B | C.C | D.D |
【知识点】 物质的分离、提纯
二、多选题 添加题型下试题
| A.Si→SiO2→H2SiO3→Na2SiO3 | B.S→SO3→H2SO4→Na2SO4 |
| C.Na→NaOH→Na2CO3→NaCl | D.Al→AlCl3→Al(OH)3→NaAlO2 |
【知识点】 含硫化合物之间的转化解读 二氧化硅 铝三角转化解读
三、单选题 添加题型下试题
| A.Na2CO3溶液中滴加醋酸:CO32-+2H+=H2O+CO2↑ |
| B.Fe和FeCl3溶液:Fe+Fe3+=2 Fe2+ |
| C.AlCl3溶液中加入氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
| D.H2SO4溶液和Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓ |
【知识点】 离子反应的发生及书写
| A.用装置甲制取二氧化硫 |
| B.用装置乙收集二氧化硫 |
| C.用装置丙验证二氧化硫的漂白性 |
| D.用装置丁吸收二氧化硫 |
| A.AlCl3是氧化产物 | B.Cl2是氧化剂 |
| C.每生成1molCO2,转移4个电子 | D.C发生还原反应 |
【知识点】 氧化还原反应基本概念
四、多选题 添加题型下试题
| A.0.15 mol | B.0.30 mol | C.0.35 mol | D.0.4 mol |
【知识点】 化学方程式计算中物质的量的运用解读 铝盐与强碱溶液反应解读
五、填空题 添加题型下试题
(1)漂白粉有效成分的化学式为
(2)KAl(SO4)2•12H2O的俗名为
(3)酸雨的pH小于
(4)小苏打可用于治疗胃酸过多,其反应的离子方程式为
六、计算题 添加题型下试题
(1)标准状况下3.36 L某气体的质量为8.1 g,则该气体的摩尔质量为 g/mol。
(2)某块光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl-,则该光卤石的物质的量为 mol。
(3)11.2 g 铁粉与足量的稀硫酸反应生成的氢气在标准状况下的体积为 L。
【知识点】 化学计量
七、解答题 添加题型下试题

回答下列问题:
(1)B的化学式是
(2)反应①的离子方程式是
(3)反应②的化学反应方程式是
(1)实验室里欲用KMnO4固体来配制250mL0.100mol/L的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、胶头滴管、
②配制过程中玻璃棒所起的作用有
③下列操作导致所配溶液浓度偏小的是
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。
① 已知:酸性KMnO4溶液与FeSO4溶液反应生成Fe2(SO4)3、MnSO4的混合溶液。写出该反应的离子方程式:
②实验时应测定的数据有:量取FeSO4溶液的体积和
【知识点】 酸碱中和滴定原理的应用解读 一定物质的量浓度的溶液的配制

(1)SO2与过量NaOH溶液反应的离子方程式为
(2)滤渣的主要成分为
(3)反应1中加双氧水的目的是
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920 g 样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300 g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400 g。
根据以上实验数据计算碱式硫酸铁样品中的n(OH-): n(SO42-)(写出计算过程)
八、填空题 添加题型下试题
(1)实验室可用硫化亚铁固体与稀硫酸反应来制备H2S气体。
①该反应的化学方程式为
②多余的H2S气体可用
(2)用30% FeCl3溶液作吸收液也能吸收H2S气体,反应方程式为:2FeCl3+H2S = S↓+2FeCl2+2HCl,废吸收液经电解可循环使用。
①该反应中H2S显
a、不稳定性 b、弱酸性 c、氧化性 d、还原性
②检验废吸收液中是否含有Fe3+的适宜试剂是
③强酸性的废吸收液电解可生成FeCl3和一种分子量最小的气体,则化学方程式为
(3)已知:H2S在高温下分解生成硫蒸气和H2。现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如图所示。

①表示H2的曲线是
②生成硫蒸气的分子式为
试卷分析
试卷题型(共 26题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 能源开发利用新理念 | |
| 2 | 0.85 | 有关粒子结构的化学用语 原子结构示意图、离子结构示意图 电离方程式 | |
| 3 | 0.94 | 碳族元素及其化合物 | |
| 4 | 0.94 | 分散系 | |
| 5 | 0.85 | 漂白粉和漂粉精的制备原理 电冶金 氯碱工业 化学在工业中的应用 | |
| 6 | 0.85 | 电解质与非电解质 | |
| 7 | 0.94 | 氨的碱性 硅酸盐工业 过氧化钠的物理性质、组成、结构及用途 氧化铝的物理性质与用途 | |
| 8 | 0.64 | 化学实验基础 | |
| 9 | 0.65 | 物质的量浓度计算-与溶质成分有关的计算 | |
| 10 | 0.64 | 离子共存 | |
| 11 | 0.85 | 仪器使用与实验安全 物质的分离、提纯 物质分离、提纯的常见物理方法 蒸馏与分馏 | |
| 12 | 0.65 | 铝三角转化 铝土矿提取铝的综合考查 | |
| 13 | 0.65 | 碳酸钠与碳酸氢钠性质的比较 | |
| 14 | 0.65 | 阿伏加德罗常数的求算 | |
| 15 | 0.65 | 物质的分离、提纯 | |
| 17 | 0.64 | 离子反应的发生及书写 | |
| 18 | 0.65 | 二氧化硫的物理性质 二氧化硫的化学性质 二氧化硫的制备 常见气体的制备与收集 | |
| 19 | 0.65 | 氧化还原反应基本概念 | |
| 二、多选题 | |||
| 16 | 0.65 | 含硫化合物之间的转化 二氧化硅 铝三角转化 | |
| 20 | 0.4 | 化学方程式计算中物质的量的运用 铝盐与强碱溶液反应 | |
| 三、填空题 | |||
| 21 | 0.65 | 漂白粉和漂粉精 硫、氮氧化物对人体、环境的危害 酸雨 碳酸氢钠 明矾的净水作用及原理 | |
| 26 | 0.65 | 物质的量有关计算 氧化还原反应方程式的配平 硫化氢 铁盐的检验 | |
| 四、计算题 | |||
| 22 | 0.64 | 化学计量 | |
| 五、解答题 | |||
| 23 | 0.85 | 离子方程式的书写 无机综合推断 铝三角转化 铁的其他化合物 | 无机推断题 |
| 24 | 0.65 | 酸碱中和滴定原理的应用 一定物质的量浓度的溶液的配制 | 实验探究题 |
| 25 | 0.4 | 离子反应的发生及书写 有关铁及其化合物转化的流程题型 物质分离、提纯综合应用 探究物质组成或测量物质的含量 | 工业流程题 |



