2016届山西省榆社中学高三上学期10月月考化学试卷
山西
高三
阶段练习
2017-07-27
452次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础、化学反应原理、物质结构与性质
2016届山西省榆社中学高三上学期10月月考化学试卷
山西
高三
阶段练习
2017-07-27
452次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础、化学反应原理、物质结构与性质
一、单选题 添加题型下试题
单选题
|
容易(0.94)
1. 化学与生活、生产密切相关,下列说法正确的是
| A.碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用 |
| B.人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 |
| C.工业生产玻璃和水泥,均需要用纯碱为原料 |
| D.“地沟油”的主要成分是油脂,其组成与汽油、煤油不相同 |
【知识点】 化学与STSE
您最近一年使用:0次
单选题
|
较易(0.85)
2. 下列说法正确的是
①经分析某物质只含有一种元素,则该物质一定是单质;
②根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
③NO2和水反应能生成硝酸,但NO2不是酸性氧化物
④溶液是电中性的,胶体是带电的
⑤不能发生丁达尔效应的分散系有氯化钠溶液、水等.
①经分析某物质只含有一种元素,则该物质一定是单质;
②根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
③NO2和水反应能生成硝酸,但NO2不是酸性氧化物
④溶液是电中性的,胶体是带电的
⑤不能发生丁达尔效应的分散系有氯化钠溶液、水等.
| A.①③④ | B.仅③ | C.仅⑤ | D.②③④⑤ |
【知识点】 物质的分类
您最近一年使用:0次
单选题
|
较难(0.4)
3. NA代表阿伏加德罗常数,下列叙述正确的是
| A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B.1molFe与过量的稀HNO3反应,转移的电子数为2 NA |
| C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D.一定温度下,l L 0.50 mol•L﹣1NH4C1溶液与2 L0.25mol•L﹣1NH4C1溶液NH4+的离子数均为0.5NA |
【知识点】 化学计量
您最近一年使用:0次
2016-12-09更新
|
444次组卷
|
3卷引用:2015界山东省实验中学高三第一次9月诊断性考试化学试卷
单选题
|
适中(0.65)
4. 等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
| A.FeO | B.Fe2O3 | C.FeSO4 | D.Fe3O4 |
您最近一年使用:0次
2019-01-30更新
|
3437次组卷
|
43卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷)(已下线)2015届河南省中原名校高三上学期第一次摸底考试化学试卷2015届上海市五校高三上学期联合教学质量调研化学试卷2014-2015湖南省娄底市湘中名校高一上学期期末化学试卷2016届山西省榆社中学高三上学期10月月考化学试卷2015-2016学年山东省牟平一中高一上12月月考化学试卷2015-2016学年湖南省邵阳市邵东三中高一上学期第三次月考化学试卷2016届湖北省荆州市公安一中高三上学期12月月考化学试卷2015-2016学年黑龙江省实验中学高二下期末化学试卷2017届河北省武邑中学高三上学期9.18周考化学试卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷广西钦州市钦州港经济技术开发区中学2018届高三上学期开学考试化学试题甘肃省临夏中学2018届高三上学期期中考试化学试题吉林省吉化一中2017-2018学年高一上学期期末考试化学试题2018-2019学年人教版高中化学必修一:非金属及其化合物章末综合测评(四)2018-2019学年高中化学鲁科版必修1 模块综合测评(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【教学案】【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第一次调研考试化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【教学案】河北省隆化县存瑞中学2019届高三上学期第一次质检化学试题【全国百强校】山东省济南市外国语学校2019届高三上学期第一次月考化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第4讲 氮及其化合物 (教学案)江西省上饶市“山江湖”协作体2018-2019学年高一(自主班)上学期第三次月考化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)江西省南昌市八一中学、洪都中学、十七中、实验中学四校2018-2019学年高一下学期3月联考化学试题福建省泉州市泉港区第一中学2018-2019学年高一下学期期中考试化学试题甘肃省甘谷第一中学2018-2019学年高一下学期子才班选拔考试化学试题云南省兰坪县第一中学2019-2020学年高二上学期期末考试化学试题2020年春季鲁教版高中化学必修1第3章《自然界中的元素》测试卷2020届高三化学无机化学二轮专题复习——铁及其化合物的相关计算【精编20题】新疆昌吉回族自治州玛纳斯县第一中学2018-2019学年高一下学期第一次月考化学试题江西省安福中学2019-2020学年高一(普通班)下学期3月线上考试化学试题(已下线)上海市七宝中学2014-2015学年高二上学期期中考试化学试题(已下线)专题3.5 氮及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》(已下线)【南昌新东方】2019 八一、洪都 高一下 第一次月考黑龙江省哈尔滨市第一中学2019-2020 学年高二下学期期末考试化学试题云南省楚雄彝族自治州民族中学2021-2022学年高一下学期3月月考化学试题(已下线)题型27 铁及其化合物的性质、用途及相关计算(已下线)第5章 金属及其化合物 5.2 重要的金属化合物
单选题
|
较易(0.85)
5. 下列有关化学概念或原理的论述中,正确的是
| A.SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B.电解饱和食盐水的过程中,水的电离平衡逆向移动 |
| C.任何一个化学反应都可以设计为电池,输出电能 |
| D.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
【知识点】 电解质
您最近一年使用:0次
单选题
|
适中(0.65)
6. 下列陈述I、II均正确且有因果关系的是
| 陈述I | 陈述II | |
| 1 | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| 2 | NaHCO3溶于水完全电离 | NaHCO3是强电解质 |
| 3 | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| 4 | H2O2、SO2能使酸性KMnO4溶液褪色 | H2O2表现还原性,SO2表现漂白性 |
| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2014-03-26更新
|
791次组卷
|
3卷引用:2014届山东省潍坊市高三3月模拟考试(一模)化学试卷
单选题
|
适中(0.64)
7. 下列有关溶液组成的描述合理的是( )
A.由水电离出的c(H+)=10-13mol/L的溶液中可能存在:HCO3-、K+、Na+、C |
B.酸性溶液中可能大量存在Na+、ClO 、SO42-、I 、SO42-、I |
| C.含有0.1mol/LFe3+的溶液中可以大量存在:K+、Mg2+、I-、NO3- |
| D.室温下,PH=l的溶液中一定可以存在:Na+、Fe3+、NO3-、SO42- |
【知识点】 离子共存
您最近一年使用:0次
2016-12-09更新
|
106次组卷
|
3卷引用:2016届山西省榆社中学高三上学期10月月考化学试卷
单选题
|
适中(0.65)
名校
8. 下列离子方程式正确的是
| A.钠与水反应:Na+2H2O=Na++2OH﹣+H2↑ |
| B.稀硝酸中加入过量铁粉:Fe+4H++NO3﹣=Fe3++NO↑+2H2O |
| C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++A13++2SO42﹣+2Ba2++4OH-=2BaSO4↓+A1(OH)3↓+NH3•H2O |
| D.向次氯酸钙溶液通入SO2:Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
【知识点】 离子反应的发生及书写
您最近一年使用:0次
2016-12-09更新
|
278次组卷
|
3卷引用:2016届山西省榆社中学高三上学期10月月考化学试卷
单选题
|
适中(0.64)
9. 3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g) 2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
 2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是| A.B的平均消耗速率为0.3mol/(L·min) |
| B.C的平衡浓度为2mol/L |
| C.平衡后,增大压强,平衡将向正方向移动 |
| D.若反应容器内气体的密度不再发生变化,说明反应已经达到平衡 |
【知识点】 化学平衡
您最近一年使用:0次
2016-12-09更新
|
73次组卷
|
2卷引用:2015-2016学年河北省成安一中高二上学期10月月考化学试卷
单选题
|
较易(0.85)
名校
10. 在 恒容密闭容器中充入
恒容密闭容器中充入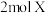 和
和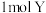 发生反应:
发生反应: ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
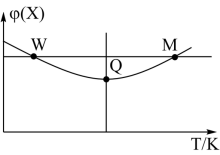
 恒容密闭容器中充入
恒容密闭容器中充入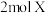 和
和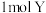 发生反应:
发生反应: ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
| A.升高温度,平衡常数增大 |
| B.W点X的正反应速率等于M点X的正反应速率 |
| C.Q点时,Y的转化率最大 |
| D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
您最近一年使用:0次
2022-11-12更新
|
729次组卷
|
56卷引用:2014届北京市石景山区高三一模理综化学试卷
(已下线)2014届北京市石景山区高三一模理综化学试卷(已下线)2014届山东省潍坊高密市高三4月月考理综化学试卷(已下线)2013-2014山东省日照市高三5月二模理综化学试卷(已下线)2013-2014天津市红桥区高三第二次模拟考试理综化学试卷2014-2015河南省扶沟县高中高二上学期第三次考试化学试卷2016届四川省成都市第七中学高三上学期期中考试理综化学试卷2016届山西省榆社中学高三上学期10月月考化学试卷2016届四川省成都市第七中学高三上学期期中考试化学试卷2015-2016学年山东省菏泽市高二上学期期末考试化学试卷2015-2016学年云南省云天化中学高二下期中理综化学试卷2015-2016学年辽宁省葫芦岛中学高二下期初摸底化学卷2016-2017学年河南省郑州一中高二上期中化学卷广东省中山市第一中学2017-2018学年高二上学期第二次统测化学试题广西陆川县中学2017-2018学年高二上学期期中考试化学试题湖南省岳阳市第一中学2018届高三12月月考化学试题(已下线)黄金30题系列++高二化学(选修4)++++小题好拿分【基础版】(已下线)2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(A卷)福建省三明市第一中学2017-2018学年高二下学期开学考试化学试题(已下线)解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密四川省成都外国语学校2018-2019学年高二上学期半期考试化学试题【全国百强校】四川省成都市石室中学2018-2019学年高二上学期期中考试化学试题江西省赣州市南康中学2019-2020学年高二上学期第一次月考化学试题2019年秋高三化学复习强化练习—— 等效平衡2019年秋高三化学复习强化练习—— 等效平衡江西省赣州市寻乌中学2019-2020学年高二上学期第二次段考化学试题吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题四川省达州市大竹中学2020-2021学年高二下学期3月月考化学试题福建省莆田第二中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高一下学期期末考试化学(理)试题(已下线)课时38 化学平衡常规图像-2022年高考化学一轮复习小题多维练(全国通用)江西省靖安中学2020-2021学年高二上学期第二次月考化学试题(已下线)专题22 化学平衡 化学平衡常数(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练吉林省长春市十一高中2021-2022学年高二上学期第一学程考试化学试题湖南省临澧县第一中学2021-2022学年高二上学期第一次阶段性考试化学试题江西省宜春中学2021-2022学年高二上学期第一次月考化学试题河南省中原名校2021-2022学年高二上学期12月联考化学试题河北省唐山市第二中学2021-2022学年高二上学期期中考试化学试题天津市第二南开学校2021-2022学年高二上学期第三次月考化学试题宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题河北省邯郸市魏县旭日中学2021-2022学年高二上学期期中考试化学试题吉林省延吉市第一高级中学2021-2022年学年高二上学期期中考试化学试题湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题内蒙古包钢第一中学2022-2023学年高二上学期月考化学试题(已下线)北京市第四中学2022-2023学年高三上学期期中考试化学试题北京市顺义区顺义第一中学2022-2023学年高二上学期期中考试化学试题湖南省常德市西洞庭管理区第一中学2022-2023学年高二上学期第二次月考化学试题四川省广安市第二中学校2022-2023学年高二上学期期末考试化学试题四川省宜宾市第四中学校2022-2023学年高二下学期开学考试化学试题天津市部分区2022-2023 学年高三上学期1月期末考试化学试题微专题(四)——化学平衡状态的判定福建省南平市浦城县2022-2023学年高二上学期11月期中化学试题江西省吉安市第一中学2022-2023学年高三上学期11月期中考试化学试题江西省宜春市上高二中2023-2024学年高二上学期第二次月考化学试题天津市南仓中学2023-2024学年高二上学期12月月考化学试题
单选题
|
较难(0.4)
11. 常温下,向l00mL 0.01mol•L﹣1HA溶液中逐滴加入0.02mol•L﹣1MOH溶液,如图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是


| A.HA为一元强酸,MOH为一元强碱 |
| B.K点所示溶液中c(A﹣)>c(M+) |
| C.N点水的电离程度小于K点水的电离程度 |
| D.K点溶液的pH=10,则有c(MOH)+c(OH﹣)﹣c(H+)=0.005mol•L﹣1 |
【知识点】 水的电离及溶液的酸碱性
您最近一年使用:0次
2016-07-13更新
|
230次组卷
|
3卷引用:2015界山东省实验中学高三第一次9月诊断性考试化学试卷
单选题
|
较难(0.4)
12. 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br﹣、2Fe3++2I﹣═2Fe2++I2,则下列有关说法中不正确的是


| A.还原性:I﹣>Fe2+>Br﹣ |
| B.线段AB表示Fe2+被氯气氧化 |
| C.线段BC表示生成4 mol Fe3+ |
| D.原溶液中n(Br﹣)="6" mol |
您最近一年使用:0次
2016-12-09更新
|
228次组卷
|
3卷引用:2016届山西省榆社中学高三上学期10月月考化学试卷
单选题
|
适中(0.64)
名校
13. 下列实验操作正确的是
| A.中和滴定实验时,用待测液润洗锥形瓶 |
| B.盛放Na2SiO3溶液时,使用带玻璃塞的磨口瓶 |
| C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
| D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
【知识点】 仪器使用与实验安全
您最近一年使用:0次
2016-12-09更新
|
105次组卷
|
3卷引用:2016届山西省榆社中学高三上学期10月月考化学试卷
单选题
|
适中(0.65)
14. 下列实验现象预测或装置的选用正确的是 ( )


| A.用装置(Ⅰ)加热草酸晶体的方法获取某些气体(草酸晶体的熔点101.5℃,分解温度约为150℃) |
| B.用装置(Ⅱ)进行实验时,酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C.用装置(Ⅲ)进行实验时,广口瓶内先有浅红棕色气体出现后又变为无色,且不会产空气污染 |
| D.用装置(Ⅳ)分离溴苯和苯的混合物 |
【知识点】 硫酸 铜与强氧化性酸的反应 蒸馏与分馏解读 化学实验方案的设计与评价
您最近一年使用:0次
2016-12-09更新
|
1284次组卷
|
7卷引用:2014届吉林省长春市高中毕业班第一次调研测试化学试卷
(已下线)2014届吉林省长春市高中毕业班第一次调研测试化学试卷2016届山西省榆社中学高三上学期10月月考化学试卷2015-2016学年山西省榆社中学高二下学期期末化学试卷2018届高三一轮复习化学:微考点70-常见化学仪器的使用百所名校联考-化学实验综合题型(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
单选题
|
适中(0.65)
名校
15. 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
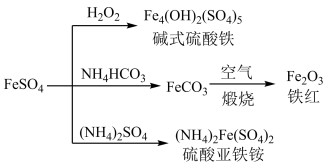

| A.碱式硫酸铁水解能产生 Fe(OH)3胶体,可用作净水剂 |
| B.为防止 NH4HCO3分解,生产 FeCO3需在较低温度下进行 |
| C.常温下,(NH4)2Fe(SO4)2在水中的溶解度比 FeSO4的大 |
| D.可用 KSCN 溶液检验(NH4)2Fe(SO4)2是否被氧化 |
您最近一年使用:0次
2020-05-22更新
|
405次组卷
|
27卷引用:2013届江苏省南通市高三第三次模拟化学试卷
(已下线)2013届江苏省南通市高三第三次模拟化学试卷(已下线)2014年高考化学 题型七 网络构建型专题练习卷(已下线)2014高考名师推荐化学铁及其化合物主要性质(已下线)2013-2014浙江省五校高三第二次联考理综化学试卷(已下线)2015届河北省衡水市冀州中学高三上学期第一次月考化学试卷2016届山西省榆社中学高三上学期10月月考化学试卷2016届山东省潍坊市高三上学期期末考试化学试卷山东省济宁市2016届高三上学期期末阶段性检测化学试题2015-2016学年湖北省枣阳一中高一下学期3月月考化学试卷2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷【全国百强校】江苏省南菁高级中学2017-2018学年高一(1、2班)上学期期末考试化学试题甘肃省酒泉市敦煌中学2019届高三二诊化学试题【全国百强校】辽宁省实验中学2018-2019学年高一(实验班)上学期期中考试化学试题【校级联考】湖北省宜昌市示范高中协作体2019届高三第一学期期中考试化学试题【市级联考】江苏省南京市六校联合体2019届高三上学期12月联考化学试题山东省微山县一中2019届高三上学期12月月考化学试题【全国百强校】江苏省南通市如东高级中学2018-2019学年高二(普通班)上学期第二次月考化学试题吉林省辽源一中2018-2019学年高一上学期期末考试化学试题(已下线)考点22 工业流程综合——《备战2020年高考精选考点专项突破题集》(已下线)考点05 典型金属元素及其化合物——《备战2020年高考精选考点专项突破题集》山东省菏泽市巨野县第一中学2020届高三上学期12月月考化学试题山东省淄博市2020届高三上学期10月摸底考试化学试题山东省济宁市汶上圣泽中学2019-2020学年高二下学期第二次检测化学试题天津市和平区2020届高三第二次质量调查化学试题(已下线)第5单元 常见的金属元素(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷江苏省扬州市扬州中学2021届高三开学检测化学试题江苏省徐州市沛县2022-2023学年高二下学期5月月考化学试题
单选题
|
适中(0.64)
16. 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是


| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品还有H2SO4 |
【知识点】 电解池
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-无机推断题
|
较难(0.4)
解题方法
17. A、B、C、D均为中学化学所学的常见物质,它们之间的转化关系如下列各图所示(部分反应条件或产物已略去)。请按要求回答下列问题:


(1)若A、B、C、D均含有同一种短周期元素X,它们的转化关系如图l所示:
①常温下,若A为化合物,C为红棕色气体,D为强电解质,则X所在周期表中的位置是_______ ;用方程式表示A溶于水,使酚酞变红的原因:_______ 。
②常温下,若A为固体单质,D为强电解质,则D可能的化学式为_______ 、_______ 。符合上述条件且含有离子键的C的电子式:_______ 。
(2)若A、B、C均含有同一种短周期元素Y,它们的转化关系如图2所示:
若Y的周期数等于主族序数;盐A溶液显酸性:盐B溶液显碱性,且焰色反应为黄色;C为两性氢氧化物。请用离子方程表示B溶液显碱性的原因:_______ ;在实验室里,欲使A溶液中的阳离子全部沉淀出来转化为C,所发生化学反应的离子方程式为_______ 。


(1)若A、B、C、D均含有同一种短周期元素X,它们的转化关系如图l所示:
①常温下,若A为化合物,C为红棕色气体,D为强电解质,则X所在周期表中的位置是
②常温下,若A为固体单质,D为强电解质,则D可能的化学式为
(2)若A、B、C均含有同一种短周期元素Y,它们的转化关系如图2所示:
若Y的周期数等于主族序数;盐A溶液显酸性:盐B溶液显碱性,且焰色反应为黄色;C为两性氢氧化物。请用离子方程表示B溶液显碱性的原因:
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
较难(0.4)
18. 铁及其化合物在生产、生活中有广泛应用,请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:

 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)  Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
温度/℃ 1000 1115 1300
平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K=______________ ;△H______________ 0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是_________________ .
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正______ υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=___________ .
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是__________ ;生成0.5mol K2FeO4转移电子的物质的量是______________ mol.
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为________________ .

(一)高炉炼铁过程中发生的主要反应为:

 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)  Fe(s)+CO2(g)
Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数 如下:
温度/℃ 1000 1115 1300
平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K=
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是
| A.提高反应温度 | B.移出部分CO2 |
| C.加入合适的催化剂 | D.减小容器的容积 |
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为

您最近一年使用:0次
四、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
19. 盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:
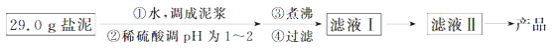
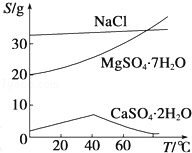
已知:①室温下Ksp[Mg(OH)2]=6.0×10﹣12.②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如图所示.
(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是___________________ ;
(2)若室温下的溶液中Mg2+的浓度为6.0mol•L﹣1,则溶液pH≥___________ 才可能产生Mg(OH)2沉淀;
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是_______________ ,滤渣的主要成分是_________________ ;
(4)从滤液Ⅱ中获得MgSO4•7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入_________ ;②过滤,得沉淀;③_____________ ;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品;
(5)若获得的MgSO4•7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为_______ (MgSO4•7H2O的相对分子质量为246);
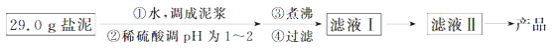
已知:①室温下Ksp[Mg(OH)2]=6.0×10﹣12.②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如图所示.

(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是
(2)若室温下的溶液中Mg2+的浓度为6.0mol•L﹣1,则溶液pH≥
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是
(4)从滤液Ⅱ中获得MgSO4•7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入
(5)若获得的MgSO4•7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为
您最近一年使用:0次
2016-12-09更新
|
523次组卷
|
9卷引用:2013届江苏省苏北三市高三第二次调研测试化学试卷
(已下线)2013届江苏省苏北三市高三第二次调研测试化学试卷(已下线)2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷2016届山西省榆社中学高三上学期10月月考化学试卷2016届江苏省南通市天星湖中学高三上学期第一次阶段测化学试卷四川省资阳市2016-2017学年高二下学期期末考试化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练选择性必修1 专题3 第四单元综合训练2019年秋高三化学复习强化练习——化学计量
五、填空题 添加题型下试题
填空题
|
较难(0.4)
20. 过渡金属元素铁能形成多种配合物,如:Fe(CO)x等。
1.①基态Fe3+的M层电子排布式为_________________________ .
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是____________ 、______________ ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x=_________ . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________ (填晶体类型).
2.O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_____________ .已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=___________ cm.(用含ρ、NA的计算式表示)

3.下列说法正确的是___________
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
1.①基态Fe3+的M层电子排布式为
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x=
2.O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为

3.下列说法正确的是
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
【知识点】 物质结构与性质
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础、化学反应原理、物质结构与性质
试卷题型(共 20题)
题型
数量
单选题
16
解答题
2
填空题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 化学与STSE | |
| 2 | 0.85 | 物质的分类 | |
| 3 | 0.4 | 化学计量 | |
| 4 | 0.65 | 基于氧化还原反应守恒规律的计算 硝酸的强氧化性 铁及铁的氧化物混合物反应的相关计算 | |
| 5 | 0.85 | 电解质 | |
| 6 | 0.65 | 氨的碱性 二氧化硫的化学性质 浓硫酸的强氧化性 化学实验方案的设计与评价 | |
| 7 | 0.64 | 离子共存 | |
| 8 | 0.65 | 离子反应的发生及书写 | |
| 9 | 0.64 | 化学平衡 | |
| 10 | 0.85 | 影响化学反应速率的因素 化学平衡的移动及其影响因素 化学平衡的有关计算 化学平衡常数的影响因素及应用 | |
| 11 | 0.4 | 水的电离及溶液的酸碱性 | |
| 12 | 0.4 | 离子反应 氧化还原反应 | |
| 13 | 0.64 | 仪器使用与实验安全 | |
| 14 | 0.65 | 硫酸 铜与强氧化性酸的反应 蒸馏与分馏 化学实验方案的设计与评价 | |
| 15 | 0.65 | 铵盐的不稳定性 Fe2+的还原性 铁盐的检验 铁盐的净水作用及原理 | |
| 16 | 0.64 | 电解池 | |
| 二、解答题 | |||
| 17 | 0.4 | 过氧化钠 氢氧化铝 盐类水解规律 | 无机推断题 |
| 19 | 0.65 | 含氧化铝的混合物的提纯 物质分离、提纯综合应用 常见无机物的制备 | 实验探究题 |
| 三、填空题 | |||
| 18 | 0.4 | 化学平衡 原电池 电解池 | |
| 20 | 0.4 | 物质结构与性质 | |



