安徽省合肥市长丰县双墩中学2019-2020学年高一上学期第四次素质检测化学试题
安徽
高一
阶段练习
2020-02-13
276次
整体难度:
适中
考查范围:
化学实验基础、认识化学科学、常见无机物及其应用
安徽省合肥市长丰县双墩中学2019-2020学年高一上学期第四次素质检测化学试题
安徽
高一
阶段练习
2020-02-13
276次
整体难度:
适中
考查范围:
化学实验基础、认识化学科学、常见无机物及其应用
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 实验室需要80mL 1 mol/L的稀硫酸,要用98%的浓硫酸(密度为1.84g·cm-3)来配制。现给出下列仪器(配制过程中可能用到):①100mL量筒②10mL量筒③50mL烧杯④托盘天平⑤100mL容量瓶 ⑥胶头滴管⑦玻璃棒⑧80mL容量瓶。按使用仪器的先后顺序排列正确的是
| A.④③⑦⑧⑥ | B.②⑤⑦⑥ | C.①③⑧⑥⑦ | D.②⑥③⑦⑤⑥ |
您最近一年使用:0次
2021-02-05更新
|
321次组卷
|
12卷引用:黑龙江省大庆市第一中学2017-2018学年高一第一次阶段考试化学试题
黑龙江省大庆市第一中学2017-2018学年高一第一次阶段考试化学试题湖北省宜昌市示范高中协作体2017-2018学年高一上学期期末化学试题黑龙江省哈尔滨市第三中学2017-2018学年高二下学期第一次验收考试化学试题河南省焦作市沁阳一中2018-2019学年高一上学期第一次月考化学试题(已下线)2018年10月19日 《每日一题》人教必修1-一定物质的量浓度溶液的配制湖北省武汉市第六中学2018-2019学年高一上学期第一次阶段调研化学试题(已下线)【走进新高考】(人教版必修一)第一章 从实验学化学 单元练习012019年10月18日《每日一题》2019-2020学年高一化学人教必修1——一定物质的量浓度溶液的配制安徽省合肥市长丰县双墩中学2019-2020学年高一上学期第四次素质检测化学试题广东省广州市外国语学校等三校2020-2021学年高一上学期期末联考化学试题厦门大学附属科技中学2019-2020学年高一上学期第一次月考(10月)化学试题陕西省西安市建筑科技大学附属中学2021-2022学年高一上学期第一次月考化学试题
单选题
|
较易(0.85)
2. 用NA表示阿伏伽德罗常数的值,下列叙述正确的是( S-32 O-16 )
| A.标准状况下,22.4L氦气含有2NA个氦原子 |
| B.在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| C.常温常压下,64g SO2中含有的氧原子数为2NA |
| D.标准状况下,11.2LH2O含有的分子数为0.5NA |
您最近一年使用:0次
2017-02-17更新
|
362次组卷
|
2卷引用:2016-2017学年广东省惠州市高一上学期期末化学试卷
单选题
|
适中(0.65)
名校
3. 下列实验操作与安全事故处理错误的是
| A.使用水银温度计测量烧杯中的水的温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 |
B.试管夹从试管底由下往上夹住试管口约 处,手持试管夹长柄末端进行加热 处,手持试管夹长柄末端进行加热 |
| C.燃着的酒精灯翻倒,酒精洒到桌面并且燃烧,为了人身安全,应立即撤离现场 |
| D.将玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端并缓慢旋进塞孔中 |
您最近一年使用:0次
2017-03-01更新
|
96次组卷
|
2卷引用:2016-2017学年福建省厦门第一中学高一下学期开学考试化学试卷
单选题
|
较易(0.85)
名校
4. 下列说法不正确的是( )
| A.Na2O2是呼吸面具中氧气的来源 |
| B.Na2O和Na2O2投入水中都能生成NaOH,都是氧化还原反应,它们都是碱性氧化物 |
| C.Na2CO3可用于制玻璃、肥皂、造纸、纺织等工业,而NaHCO3可用于治疗胃酸过多,制造发酵粉等 |
| D.NaCl的性质稳定,可用作调味品 |
您最近一年使用:0次
2018-01-16更新
|
478次组卷
|
10卷引用:安徽省淮南市第二中学2017-2018学年高一上学期第二次月考化学试题
安徽省淮南市第二中学2017-2018学年高一上学期第二次月考化学试题湖北省宜昌市示范高中协作体2017-2018学年高一上学期期末化学试题甘肃省镇原县第二中学2018-2019学年高一上学期期末考试化学试题黑龙江省大庆市第十中学2018-2019学年高一上学期期末考试化学试题(已下线)【走进新高考】(人教版必修一)3.2.1几种重要金属化合物——钠的重要化合物 同步练习01黑龙江省牡丹江市第三高级中学2019-2020学年高一上学期期中考试化学试题安徽省合肥市长丰县双墩中学2019-2020学年高一上学期第四次素质检测化学试题广东省佛山市第一中学2020-2021学年高一上学期第一次段考化学试题(已下线)衔接点14 钠的化合物-2021年初升高化学无忧衔接(已下线)衔接点15 钠的化合物-2022年初升高化学无忧衔接?
单选题
|
较易(0.85)
名校
解题方法
5. 已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+=Fe3++Ce3+
Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序
Ce4++Fe2+=Fe3++Ce3+
Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ce3+ |
【知识点】 氧化性、还原性强弱的比较解读
您最近一年使用:0次
2022-01-07更新
|
584次组卷
|
91卷引用:2010年湖南师大附中高一上学期期中考试化学试卷
(已下线)2010年湖南师大附中高一上学期期中考试化学试卷(已下线)2013-2014学年山东省日照一中高一上学期期中考试化学试卷(已下线)2014高考名师推荐化学氧化还原概念(已下线)2013-2014吉林省白城市高一上学期期末考试化学(B卷)试卷(已下线)2014-2015学年福建省厦门市第六中学高一上学期期中考试化学试卷2014-2015湖南省益阳六中高一上学期期中考试化学试卷2014-2015学年湖南省益阳市第六中学高一上学期期中考试化学卷2015-2016学年吉林省吉林第一中学高一9月检测化学试卷2016届江苏省东海县石榴高级中学高三上学期第一次月考化学试卷2016届湖南省益阳市箴言中学高三上学期第二次模拟测试化学试卷2015-2016学年山西大学附属中学高一上期中化学试卷2016届内蒙古鄂尔多斯市西部四校高三上学期期中联考化学试卷2016-2017学年河北省武邑中学高一上期中化学卷2016-2017学年黑龙江大庆实验中学高一12月月考化学卷江苏省南京市金陵中学2016-2017学年高一下学期期中考试化学试题湖北省宜昌市示范高中协作体2017-2018学年高一上学期期末化学试题云南省玉溪市红塔区2017-2018学年高一上学期期末普通高中联考化学试题(已下线)二轮复习 专题3 氧化还原反应 押题专练(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】北京市首都师范大学附属中学2018-2019学年高一上学期期中考试化学试题云南省双柏县第一中学2018-2019学年高一上学期期中考试化学试题吉林省白城市通榆县第一中学2018-2019学年高一上学期第三次月考化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高一上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(押题专练)甘肃省镇原县第二中学2018-2019学年高一上学期期末考试化学试题内蒙古自治区正镶白旗察汗淖中学2018-2019学年高一上学期期末考试化学试题【校级联考】甘肃省兰州市第二片区丙组2018-2019学年高一上学期期末联考化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高一(理)上学期期末考试化学试题湖北省荆州中学、宜昌一中等三校2018-2019学年高一下学期3月联考化学试题山东省济南市历城区第二中学2017-2018学年高一上学期期中考试化学试题云南省凤庆县一中2019-2020学年高二上学期开学考试化学试题云南省临沧市凤庆县第二中学2019-2020学年高二第一学期开学考试化学试题吉林省白城市第一中学2019-2020学年高一上学期期中考试化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高一上学期期中考试化学试题湖南省邵东县创新实验学校2019-2020学年高一上学期期中考试化学试题海南省海南枫叶国际学校2019-2020学年高一上学期期中考试化学试题河南省三门峡市灵宝实验高级中学2019-2020学年高一上学期12月月考化学试题江西省宜春九中(外国语学校)2019-2020学年高一上学期第二次月考化学试题云南省昆明市农业大学附属中学2019-2020学年高一上学期第二次月考化学试题重庆市第三十中学2019-2020学年高一10月月考化学试题云南省迪庆州维西县第二中学2019-2020学年高一上学期期末考试化学试题四川省三台县芦溪中学2017—2018学年高一上学期第三次月考化学试题四川省绵阳市三台县芦溪中学2017-2018学年高一上学期第三次月考化学试题湖北省宜昌市葛洲坝中学2019-2020学年高一上学期期末考试化学试题安徽省合肥市长丰县双墩中学2019-2020学年高一上学期第四次素质检测化学试题吉林省公主岭市范家屯镇第一中学2019-2020学年高一上学期期末考试化学试题辽宁省营口市第二高级中学2019-2020学年高一上学期第一次月考化学试题陕西省榆林市第十二中学2021届高三上学期第一次月考化学试题河北省石家庄市辛集市第二中学2020-2021学年高一上学期10月月考化学试题河北省元氏县第四中学2020-2021学年高一10月月考化学试题广东省东莞市粤华学校2019-2020学年高一上学期期中考试化学试题广东省东莞市麻涌中学2020-2021学年高一上学期第一次月考化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高一上学期期中考试化学试题河北省张家口市涿鹿中学2020-2021学年高一10月调研考试化学试题浙江省之江教育评价2020-2021学年高一上学期期中联考化学试题宁夏回族自治区中卫市海原县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)【浙江新东方】85.(已下线)【浙江新东方】在线化学14甘肃省平凉市泾川县第一中学2020-2021学年高一上学期期末考试化学试题青海省西宁市2020-2021学年高一上学期期末调研测试化学试题江西省赣州市信丰中学2020-2021学年高一上学期第三次月考化学(B卷) 试题山西省太原市行知宏实验中学校2020-2021学年高一上学期期末考试化学试题山西省陵川县平城中学2021-2022学年高一上学期第一次月考化学试题黑龙江省鸡西实验中学2020-2021学年高一上学期第一次月考化学试题吉林省长春外国语学校2019-2020学年高二下学期期末考试化学(理)试题河南省信阳市多校2021-2022学年高一上学期期中联考化学试题河北省石家庄市第二十二中学2021-2022学年高一上学期期中考试化学试题新疆乌苏市第一中学2021-2022学年高一上学期期中考试化学试题宁夏青铜峡市高级中学2021-2022学年高一上学期期中考试化学试题黑龙江省大庆中学2021-2022学年高一上学期期末考试化学试题(已下线)第03练 氧化还原反应-2022年【寒假分层作业】高一化学(人教版2019)新疆石河子第一中学2020-2021学年高三上学期8月月考(B卷)化学试题(已下线)第10讲 氧化还原反应的基本概念-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)河北省石家庄市元氏县第四中学2021-2022学年高一上学期期中考试化学试题(已下线)2.2.2 氧化剂和还原剂-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)陕西省黄陵中学2021-2022学年高一上学期期末考试化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高一上学期第一次月考化学试题湖南省长沙市明德中学2022-2023学年高一上学期期中考试化学试题湖南省株洲市五雅中学2022-2023学年高一上学期第一次月考化学试题吉林省榆树市第一高级中学校2021-2022学年高一上学期期中考试化学试题河南省巩义市第二高级中学2022-2023学年高一上期期末达标卷化学试题上海理工大学附属中学2022-2023学年高一上学期期末考试化学试题福建省三明市永安第九中学2022-2023学年高一下学期返校考化学试题浙江省温岭中学2023-2024学年高一上学期学生学科素养开学测试化学试题北京师范大学附属中学2023-2024学年高一上学期10月月考化学试题黑龙江省牡丹江市第三高级中学2023-2024学年高一上学期第一次月考化学试题四川省德阳市什邡中学2023-2024学年高一上学期10月月考(平行实验班)化学试题云南省曲靖市罗平县第一中学2023-2024学年高一上学期9月月考化学试题海南省海口市第一中学2023-2024学年高一上学期期末考试化学试题(重点班)重庆十八中两江实验中学校2023-2024学年高一上学期半期质量监测化学试卷
单选题
|
适中(0.65)
解题方法
6. 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装了盛有Na2O2(或K2O2)颗粒的装置,它的用途是产生氧气。下列有关Na2O2的叙述正确的是
| A.Na2O2中阴、阳离子的个数比是1∶1 |
| B.Na2O2分别与水及CO2反应产生相同量氧气时,需水和CO2的质量相等 |
| C.Na2O2的漂白原理与SO2的漂白原理相同 |
| D.与CO2、H2O反应产生等量氧气,转移电子数相同,耗Na2O2的质量相同 |
【知识点】 过氧化钠与水的反应解读 过氧化钠和二氧化碳反应解读
您最近一年使用:0次
2017-02-23更新
|
249次组卷
|
2卷引用:2016-2017学年天津市第一中学高一上期末化学卷
单选题
|
较易(0.85)
名校
解题方法
7. 对下列事实的解释错误的是
| A.氨溶于水的喷泉实验,说明氨气极易溶于水 |
| B.常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 |
| C.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性 |
| D.氯气可使湿润的红色布条褪色,而不能使干燥的有色布条褪色,说明次氯酸具有漂白性 |
您最近一年使用:0次
2016-07-14更新
|
178次组卷
|
6卷引用:2015-2016学年江西省抚州市临川十中高一下5月月考化学试卷
单选题
|
适中(0.65)
名校
8. 现有下列几个离子反应:
① Cr2O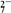 +14H++6Cl-===2Cr3++3Cl2↑+7H2O
+14H++6Cl-===2Cr3++3Cl2↑+7H2O
② 2Fe2++Br2===2Fe3++2Br- ③ 2Br-+Cl2=== Br2+2Cl-
④ 2Fe3++SO2+2H2O===2Fe2++SO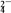 +4H+
+4H+
下列有关性质的比较中正确的是( )。
① Cr2O
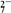 +14H++6Cl-===2Cr3++3Cl2↑+7H2O
+14H++6Cl-===2Cr3++3Cl2↑+7H2O② 2Fe2++Br2===2Fe3++2Br- ③ 2Br-+Cl2=== Br2+2Cl-
④ 2Fe3++SO2+2H2O===2Fe2++SO
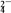 +4H+
+4H+下列有关性质的比较中正确的是( )。
A.氧化性:Cr2O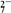 >Cl2>Fe3+ >Cl2>Fe3+ | B.氧化性:Cl2>Br2>Cr2O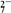 |
| C.还原性:SO2<Fe2+<Br- | D.还原性:Cl->Cr3+>Fe2+ |
【知识点】 氧化性、还原性强弱的比较解读
您最近一年使用:0次
2018-01-08更新
|
322次组卷
|
6卷引用:辽宁省辽阳2017-2018学年高一化学期末考试题
单选题
|
较难(0.4)
名校
9. 下列实验操作对应的实验现象及解释或结论都正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 用某无色溶液进行焰色反应 | 透过钴玻璃,火焰呈紫色 | 原溶液一定是钾盐溶液 |
| B | 向NaOH溶液中滴加足量的MgCl2溶液,然后再滴加足量的CuCl2溶液 | 先产生白色沉淀,然后沉淀变成蓝色 | Ksp[Cu(OH)2]sp[Mg(OH)2] |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水蒸气在高温下发生反应 |
| D | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| A.A | B.B | C.C | D.D |
【知识点】 离子的检验 无机物的检验 化学实验方案的设计与评价 物质性质的探究解读
您最近一年使用:0次
2017-04-26更新
|
341次组卷
|
5卷引用:贵州省贵阳市第一中学、凯里市第一中学2017届高三下学期高考适应性月考卷(七)理综化学试题
单选题
|
适中(0.65)
名校
10. 某实验小组通过下图所示实验探究Na2O2与水的反应:
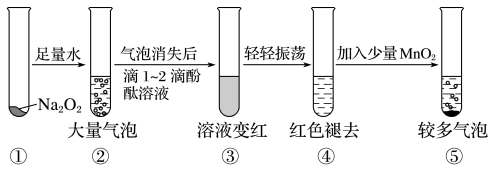
下列说法不正确的是

下列说法不正确的是
| A.②中的大量气泡主要成分是氧气 |
| B.③中溶液变红,说明有碱性物质生成 |
| C.④中现象可能是由于溶液中含有强氧化性物质造成的 |
| D.⑤中MnO2的主要作用是降低了水中氧气的溶解度 |
您最近一年使用:0次
2017-11-10更新
|
2183次组卷
|
32卷引用:北京市海淀区2018届高三上学期期中考试化学试题
北京市海淀区2018届高三上学期期中考试化学试题甘肃省天水市第一中学2018届高三上学期第二次考试(期中)化学试题山东省滨州市2018届高三期末考试化学试题四川省攀枝花市2017-2018学年高一上学期调研检测化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第1讲 钠及化合物 (题型专练)【全国百强校】北京市师范大学附属中学2019届高三上学期期中考试化学试题1【全国百强校】北京市师范大学附属中学2019届高三上学期期中考试化学试题2【校级联考】安徽省皖江名校联盟2019届高三下学期开年摸底大联考理科综合化学试题云南省玉溪一中2018-2019学年高一上学期期末考试化学试题(已下线)【新东方】高中化学-5018安徽省合肥市长丰县双墩中学2019-2020学年高一上学期第四次素质检测化学试题专题5.1 化学实验基础(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升河北省衡水中学2019-2020学年高三上学期二调考试化学试题(已下线)专题3.1 金属钠及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》云南省曲靖市会泽县第一中学2019-2020高一第二次月考化学试题湖南省长沙市第一中学2020-2021学年高一上学期期中考试化学试题厦门大学附属科技中学2019-2020学年高一上学期第一次月考(10月)化学试题北京市中国农业大学附属中学2021-2022学年高三上学期开学考试化学试题河北省实验中学2021届高三上学期第一次月考化学试题黑龙江省佳木斯市第一中学2021-2022学年高一上学期期中考试化学试题湖南省长沙市第一中学2021-2022学年高一上学期期中考试化学试题河北省邢台市第一中学2021-2022学年高一上学期第二次月考化学试题(已下线)5.2.1 重要的金属化合物(第1课时)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)河北青龙满族自治县2021-2022学年高一下开学考试化学试题云南省罗平县第二中学2021-2022学年高一上学期期中考试化学试题北京市海淀实验中学2022-2023学年高三上学期10月学科展示化学试题湖南省株洲市攸县第三中学2022-2023学年高一上学期期中考试化学试题云南省广南县第二中学校2021-2022学年高一下学期开学考试化学试题湖南省湘潭市湘乡市第一中学2022-2023学年高一下学期6月期中化学试题作业(八) 氧化钠和过氧化钠辽宁省辽东教学共同体2023-2024学年高一上学期10月联考化学试题广东省珠海市斗门区第一中学2022-2023学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
11. NaNO2像食盐一样有咸味,有很强的毒性,误食亚硝酸钠(NaNO2)会使人中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O。下列说法正确的是( )
| A.该反应的氧化剂为HI |
| B.反应产物中能使淀粉变蓝的物质有I2、NaI |
| C.该反应中氧化剂与还原剂物质的量之比为1:1 |
| D.人误食亚硝酸钠中毒时,可以服用HI溶液解毒 |
【知识点】 氧化还原反应基本概念 氧化还原反应有关计算
您最近一年使用:0次
2016-12-09更新
|
562次组卷
|
12卷引用:2014届山东省日照一中高三下学期开学考试理综化学试卷
(已下线)2014届山东省日照一中高三下学期开学考试理综化学试卷 山东省昌邑市第一中学2017-2018学年高一上学期期末模拟化学试题河南省三门峡市2017-2018学年高一上学期期末考试化学试题山东师范大学附属中学2017-2018学年高一上学期第二次学分认定(期末)考试化学试题【全国百强校】山东省泰安市新泰市第一中学2018-2019学年高一上学期第二次质量检测化学试题安徽省合肥市长丰县双墩中学2019-2020学年高一上学期第四次素质检测化学试题河北省鸡泽县第一中学2019-2020学年高二下学期开学考试化学试题河北省曲周县第五中学2019-2020学年高二下学期5月考试化学试题四川绵阳南山中学2019-2020学年高一12月化学考试题(已下线)小题必刷07 氧化还原反应概念及应用——2021年高考化学一轮复习小题必刷(通用版)第四章 非金属及其化合物 热点强化9 亚硝酸及亚硝酸钠的性质山东省枣庄市第三中学2022-2023学年高一上学期1月月考化学试题
单选题
|
较易(0.85)
12. 下列关于分散系的叙述不正确的是( )


A.分散系的分类: |
| B.用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 |
| C.把FeCl3饱和溶液滴入到氢氧化钠溶液中,以制取Fe(OH)3胶体 |
| D.如图显示的是树林的晨曦,该现象与丁达尔效应有关 |
您最近一年使用:0次
2018-02-02更新
|
103次组卷
|
2卷引用:湖北省宜昌市示范高中协作体2017-2018学年高一上学期期末化学试题
单选题
|
较易(0.85)
名校
13. 右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是


| A.该硫酸试剂的物质的量浓度为18.4 mol/L |
| B.稀释该硫酸时应把水倒入硫酸中,边倒边搅拌 |
| C.50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol |
| D.标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L |
【知识点】 化学计量
您最近一年使用:0次
2016-12-09更新
|
158次组卷
|
4卷引用:2015-2016学年广东省广州市执信中学高一上期末化学试卷
单选题
|
适中(0.65)
名校
解题方法
14. 某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3 的混合液,经测定ClO-与ClO 的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为
的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为
 的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为
的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为| A.21∶5 | B.11∶3 | C.3∶1 | D.4∶1 |
您最近一年使用:0次
2021-07-29更新
|
1481次组卷
|
60卷引用:2013-2014学年江西省九江一中高一上学期期中考试化学试卷
(已下线)2013-2014学年江西省九江一中高一上学期期中考试化学试卷2015-2016学年吉林省吉林第一中学高一9月检测化学试卷2015-2016学年河北沧州一中高一上第二次月考化学试卷2015-2016学年安徽师大附中高一下期末化学试卷2016-2017学年安徽省六安一中高二上开学测化学试卷2017届新疆生产建设兵团二中高三上第一次月考化学试卷2017届辽宁省铁岭市高三上学期第一次联考化学试卷2016-2017学年河北省冀州中学高一上11月月考化学卷2016-2017学年湖南省株洲长鸿实验学校等三校高一12月联考化学卷2016-2017学年吉林长春十一高中等两校高一上期末化学卷2016-2017学年江西省南昌市第十中学高一下学期第一次月考化学试卷2017-2018学年高一人教版必修一:21 活泼的黄绿色气体课时训练化学试题河北省石家庄市第一中学2017-2018学年高一上学期期中考试化学试题河北省衡水市安平中学2017-2018学年高一上学期第三次月考化学试题2陕西省西安市第一中学2017-2018学年高一上学期期末考试化学试题【全国百强校】河北省辛集中学2017-2018学年高二6月月考化学试题2019届高三化学一轮复习针对训练:卤族元素及其化合物天津市蓟州区马伸桥中学2018-2019学年高一上学期12月联考化学试题云南省绿春县第一中学2018-2019学年高二开学考试化学试题江西省宜春市宜丰中学2020届高三上学期第一次月考化学试题海南省儋州市第一中学2020届高三上学期第二次月考化学试卷新疆昌吉州行知学校2020届高三上学期第二次月考化学试题天津市耀华中学2019-2020学年高一上学期期中考试化学试题四川省成都市成都外国语学校2019-2020学年高一上学期期中考试化学试题2020届高考化学小题狂练(全国通用版)专练7 非金属及其化合物甘肃省武威市第六中学2020届高三上学期第四次阶段性复习过关考试化学试题云南省广南县二中2019-2020学年高一上学期期末考试化学试题安徽省合肥市长丰县双墩中学2019-2020学年高一上学期第四次素质检测化学试题贵州省惠水县第一高级中学2019-2020学年高一上学期期末考试化学试题四川省成都三中2019-2020学年高一11月月考化学试题江西省上饶市2019-2020学年高一上学期期末考试 化学(自招班)试题湖南省娄底市第一中学2019-2020学年高一上学期期末考试化学试题天津市耀华中学2019-2020学年高一下学期第一次月考化学试题河北省石家庄市第二中学2018-2019学年高一上学期期末考试化学试题(已下线)【南昌新东方】2020 新建二中 高一(下) 第一次月考 005(已下线)【南昌新东方】2019-2020 莲塘一中 高一(上)期末 004(已下线)【南昌新东方】江西省九江一中2013-2014学年高一上学期期中考试化学试题苏教版(2020)高一必修第一册专题4 突破3 氧化还原反应与离子反应的综合应用鲁科版(2019)高一必修第一册第2章 元素与物质世界 第3节 氧化还原反应 专题4 氧化还原反应的计算及方程式的配平湖南省娄底市2020-2021学年高一上学期期中考试化学试题天津市耀华中学2019-2020学年高一下学期期末化学试题(已下线)【浙江新东方】双师(27)江西省贵溪市实验中学高中部2020-2021学年高一下学期第二次月考化学试题(已下线)课时10 氧化还原反应规律及应用-2022年高考化学一轮复习小题多维练(全国通用)河北省石家庄市第九中学2020-2021学年高一上学期11月月考化学试题吉林省延边第二中学2020-2021学年高一上学期第一次考试月考化学试题黑龙江省哈尔滨市德强高级中学2021-2022学年高一上学期10月月考化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题新疆乌鲁木齐市第101中学2021-2022学年高一上学期期中考试化学试题吉林省梅河口市第五中学2021-2022学年高一上学期期中考试化学试题新疆师范大学附属中学2021-2022学年高三9月月考化学试题(已下线)专题02 海水中的重要元素——钠和氯-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期开学考试化学试题辽宁省实验中学2023届高三上学期第一次阶段测试化学试题广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题辽宁省沈阳市皇姑屯区实验中学2022-2023学年高三上学期第一阶段检测化学试题江苏省张家港沙洲中学2022-2023学年高一上学期12月月考化学试题上海市奉贤区致远高级中学2022-2023学年高一上学期期末教学评估化学试题福建省福州第一中学2022-2023学年高一上学期期末考试化学试题黑龙江省哈尔滨市第三中学校2023-2024学年高一下学期寒假验收考试 化学试卷
单选题
|
较易(0.85)
名校
解题方法
15. 下列有关氢氧化铁胶体说法正确的是
| A.将外加直流电源通过该胶体,阴极处颜色变深,则说明该胶体带正电荷 |
| B.鉴别FeCl3溶液和Fe(OH)3胶体,可用利用丁达尔效应 |
| C.采用过滤,可将Fe(OH)3胶体中的FeCl3杂质除去 |
| D.向Fe(OH)3胶体中加入大量盐酸,则最终可引起胶体聚沉 |
您最近一年使用:0次
2017-11-17更新
|
220次组卷
|
3卷引用:河北省石家庄市第一中学2017-2018学年高一上学期期中考试化学试题
单选题
|
较易(0.85)
16. 表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )
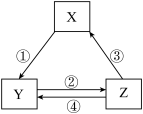
| 序号 | X | Y | Z | 箭头上所标数字的反应条件 |
| ① | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
| ② | Na | Na2O2 | NaCl | ②加H2O |
| ③ | NO | NO2 | HNO3 | ③与C加热 |
| ④ | Al2O3 | NaAlO2 | Al(OH)3 | ④与NaOH |

| A.①④ | B.①② | C.③④ | D.②③ |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
17. 下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol· L-1的稀硫酸。可供选用的仪器有:① 胶头滴管② 烧瓶③ 烧杯④ 玻璃棒⑤ 药匙⑥ 量筒⑦ 托盘天平。请回答下列问题:

(1)在容量瓶的使用方法中,下列操作不正确的是________
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,配制溶液不需要干燥
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用滴管加蒸馏水到标线
D.定容后盖好瓶塞用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶颠倒摇匀多次
(2)该浓硫酸的物质的量浓度为_________ mol· L-1。
(3)配制稀硫酸时,还缺少的仪器有________________ 。
(4)配制480mL 1mol· L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_______ mL。所需量筒的规格为________ 。(可供选择的量筒有5mL、10mL、20mL、50mL、100mL)
(5)过程中的部分步骤,其中有错误的是(填写序号)____________ 。
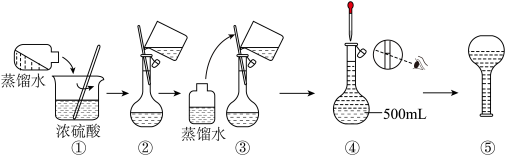
(6)对所配制的稀硫酸进行测定,发现其浓度大于1 mol· L-1,配制过程中下列各项操作可能引起该浓度偏高的原因有___________ 。
A.定容时,仰视容量瓶刻度线进行定容。
B.将稀释后的硫酸立即转入容量瓶后,紧接着就进行以后的实验操作。
C.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水。
D.转移溶液时,不慎有少量溶液洒到容量瓶外面。
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处。

(1)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,配制溶液不需要干燥
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用滴管加蒸馏水到标线
D.定容后盖好瓶塞用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶颠倒摇匀多次
(2)该浓硫酸的物质的量浓度为
(3)配制稀硫酸时,还缺少的仪器有
(4)配制480mL 1mol· L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为
(5)过程中的部分步骤,其中有错误的是(填写序号)

(6)对所配制的稀硫酸进行测定,发现其浓度大于1 mol· L-1,配制过程中下列各项操作可能引起该浓度偏高的原因有
A.定容时,仰视容量瓶刻度线进行定容。
B.将稀释后的硫酸立即转入容量瓶后,紧接着就进行以后的实验操作。
C.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水。
D.转移溶液时,不慎有少量溶液洒到容量瓶外面。
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处。
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
解题方法
18. 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅。
②粗硅与干燥 HCl气体反应制得 SiHCl3:Si + 3HCl SiHCl3+ H2
SiHCl3+ H2
③SiHCl3与过量 H2在 1000 ~1100℃反应制得纯硅
已知 ①SiHCl3能与 H2O强烈反应,在空气中易自燃②普通玻璃在6000C左右融化。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为__________________ 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点 33.0℃)中含有少量 SiCl4(沸点57.6℃)
和 HCl(沸点-84.7℃),提纯 SiHCl3采用的方法为_________________________ 。
(3)用 SiHCl3与过量 H2反应制备纯硅的装置如下(热源及夹持装置略去):
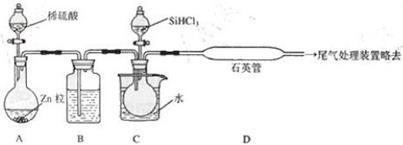
①装置 B中的试剂是___________ 。 装置 C中的烧瓶需要加热,其目的是__________________ 。
②反应一段时间后,装置 D中观察到的现象是_________________ ,装置 D不能采用普通玻璃管的原因是__________________ ,装置D中发生反应的化学方程式为_______________ 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及____________________ 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________ 。
A 碘水 B 氯水 C NaOH溶液 D KSCN溶液 E Na2SO3 溶液
①高温下用碳还原二氧化硅制得粗硅。
②粗硅与干燥 HCl气体反应制得 SiHCl3:Si + 3HCl
 SiHCl3+ H2
SiHCl3+ H2 ③SiHCl3与过量 H2在 1000 ~1100℃反应制得纯硅
已知 ①SiHCl3能与 H2O强烈反应,在空气中易自燃②普通玻璃在6000C左右融化。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点 33.0℃)中含有少量 SiCl4(沸点57.6℃)
和 HCl(沸点-84.7℃),提纯 SiHCl3采用的方法为
(3)用 SiHCl3与过量 H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置 B中的试剂是
②反应一段时间后,装置 D中观察到的现象是
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
A 碘水 B 氯水 C NaOH溶液 D KSCN溶液 E Na2SO3 溶液
您最近一年使用:0次
2016-12-09更新
|
489次组卷
|
4卷引用:2011-2012学年重庆市杨家坪中学高二上学期期中考试化学试卷
(已下线)2011-2012学年重庆市杨家坪中学高二上学期期中考试化学试卷2015届辽宁省丹东市高三总复习质量测试(一)理综化学试卷2015-2016学年广西桂林十八中高一下开学测化学试卷安徽省合肥市长丰县双墩中学2019-2020学年高一上学期第四次素质检测化学试题
解答题-实验探究题
|
适中(0.65)
解题方法
19. 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究。查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐。
该小组同学利用下图装置进行实验(部分夹持仪器略)。
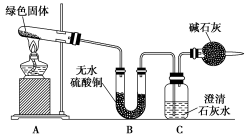
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)绿色固体中含有的元素是________________________________________________ 。
(2)加热后试管中剩余的黑色物质是_________________________________________________ 。
(3)假设该绿色物质是一种纯净物,则其化学式可能是______________ ,加热分解的化学方程式为_______________________________________________________________________________________ 。
(4)上述实验步骤③中的反应的离子方程式为________________________________________ 。
(5)实验装置最后的干燥管的作用是___________________________________________________ 。
(6)如果将B、C两装置对调,能否达到实验目的______ (填“能”或“不能”),为什么?_____________________________________________________________________________________________________________ 。
该小组同学利用下图装置进行实验(部分夹持仪器略)。

①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)绿色固体中含有的元素是
(2)加热后试管中剩余的黑色物质是
(3)假设该绿色物质是一种纯净物,则其化学式可能是
(4)上述实验步骤③中的反应的离子方程式为
(5)实验装置最后的干燥管的作用是
(6)如果将B、C两装置对调,能否达到实验目的
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学实验基础、认识化学科学、常见无机物及其应用
试卷题型(共 19题)
题型
数量
单选题
16
解答题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 一定物质的量浓度的溶液的配制 配制一定物质的量浓度的溶液的步骤、操作 | |
| 2 | 0.85 | 阿伏加德罗常数的求算 结合气体物质与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 3 | 0.65 | 实验安全 | |
| 4 | 0.85 | 氧化钠的化学性质 过氧化钠的物理性质、组成、结构及用途 过氧化钠与水的反应 碳酸氢钠的俗称、物理性质及用途 | |
| 5 | 0.85 | 氧化性、还原性强弱的比较 | |
| 6 | 0.65 | 过氧化钠与水的反应 过氧化钠和二氧化碳反应 | |
| 7 | 0.85 | 氯气与水的反应 氨的物理性质 浓硫酸的脱水性 铝的钝化 | |
| 8 | 0.65 | 氧化性、还原性强弱的比较 | |
| 9 | 0.4 | 离子的检验 无机物的检验 化学实验方案的设计与评价 物质性质的探究 | |
| 10 | 0.65 | 过氧化钠与水的反应 化学实验探究 | |
| 11 | 0.65 | 氧化还原反应基本概念 氧化还原反应有关计算 | |
| 12 | 0.85 | 胶体的性质和应用 胶体的制备 | |
| 13 | 0.85 | 化学计量 | |
| 14 | 0.65 | 氧化还原反应有关计算 与氧化剂、还原剂有关的计算 基于氧化还原反应守恒规律的计算 | |
| 15 | 0.85 | 胶体的性质和应用 | |
| 16 | 0.85 | 物质的转化 硝酸的强氧化性 过氧化钠与水的反应 铝三角转化 | |
| 二、解答题 | |||
| 17 | 0.65 | 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 配制一定物质的量浓度溶液的综合考查 | 实验探究题 |
| 18 | 0.65 | 硅的制备 Fe2+的鉴别及其应用 化学实验基础操作 常见无机物的制备 | 实验探究题 |
| 19 | 0.65 | 铜的其他化合物 化学实验探究 | 实验探究题 |



