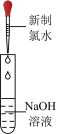
人教版(2019)高一必修第一册第二章 海水中的重要元素 素养拓展区
全国
高一
课后作业
2020-09-05
1040次
整体难度:
适中
考查范围:
常见无机物及其应用、认识化学科学、有机化学基础、化学实验基础
一、单选题 添加题型下试题
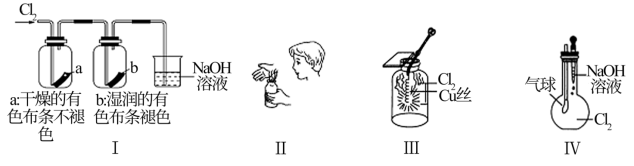
| A.Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用 |
| B.Ⅱ图中:闻Cl2的气味 |
| C.Ⅲ图中:生成棕黄色的烟 |
| D.Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应 |
| A.标准状况下,28g N2和CO的混合气体所含原子数为NA |
B.1.8g 中含有的电子数为1.1NA 中含有的电子数为1.1NA |
| C.标准状况下,18g H2O含有的原子数为3NA |
| D.1L 1mol/L的盐酸中含有NA个HCl分子 |
【知识点】 阿伏加德罗常数的应用解读 阿伏加德罗定律的应用解读
| A.同温同压下甲烷和氧气的密度之比为2∶1 |
| B.1g甲烷和1g氧气的原子数之比为5∶1 |
| C.等物质的量的甲烷和氧气的质量之比为2∶1 |
| D.在标准状况下等质量的甲烷和氧气的体积之比为1∶2 |
【知识点】 阿伏加德罗定律及其推论解读 阿伏加德罗定律的应用解读
| A.29 | B.32 | C.36 | D.40 |
| A.A、B两种单质的摩尔质量之比为1:4 |
| B.生成物C中A元素的质量分数为75% |
| C.生成物C中A、B的原子个数之比为3:1 |
| D.反应前后气体分子数之比为1:4 |
【知识点】 阿伏加德罗定律的应用解读
| A.1:3 | B.3:1 | C.13:3 | D.31:13 |
| A.需用托盘天平称量NaOH固体的质量为144g |
| B.容量瓶用蒸馏水洗净后,不必烘干就能用于配制溶液 |
| C.定容时俯视容量瓶的刻度线,会造成所配溶液的物质的量浓度偏高 |
| D.该溶液的物质的量的浓度为7.5mol/L |
| A.NaOH | B.Na2O2 | C.Na2O和Na2O2 | D.Na2O2和NaO2 |
二、解答题 添加题型下试题
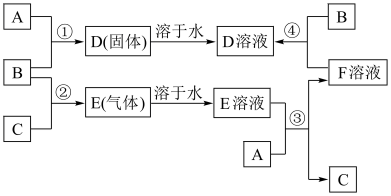
(1)A是
(2)反应①的化学方程式为
(3)反应③的化学方程式为
(4)反应④的化学方程式为
【知识点】 无机综合推断 氯气的化学性质 与“铁三角”有关的推断解读
三、填空题 添加题型下试题
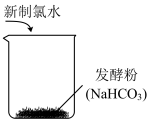
(1)下列关于纯碱的认识正确的是
A.受热易分解 B.水溶液显碱性 C.属于碱 D.可与酸反应
(2)小鲁探究用Na2CO3调节面团酸度,而不用NaHCO3的原因。质量均为1g的Na2CO3与NaHCO3分别与足量酸反应生成CO2时,消耗H+的物质的量更多的是
(3)小鲁实际操作时,发现面团发得不好,面团内的气孔少,略有酸味。妈妈指导小鲁将Na2CO3改用NaHCO3,继续揉面,上锅蒸后果然蒸出了松软的馒头。该过程中NaHCO3的作用为
(4)某品牌复合膨松剂的说明书如图所示。

其中葡萄糖酸-δ-内酯和淀粉是助剂,其作用是防止膨松剂吸潮结块而失效。焦磷酸二氢二钠的作用是
四、解答题 添加题型下试题
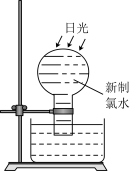
Ⅰ.(1)NaClO中Cl的化合价为
(2)黄色气体
 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。①
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 、
、 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为②
 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下反应制取氯气,写出该反应的化学方程式
(2)C装置的作用是
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成
 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是②另一个副反应
 ,为避免此副反应的发生,装置的改进措施为
,为避免此副反应的发生,装置的改进措施为【知识点】 氧化还原反应在生活、生产中的应用解读 氯气的实验室制法解读
五、单选题 添加题型下试题
①钠、氢气都能在氯气中燃烧生成白色的烟
②铜丝在氯气中燃烧,生成蓝色的氯化铜
③液氯就是氯气的水溶液,它能使干燥的有色布条褪色
④久置的氯水,因氯气几乎完全挥发掉,剩下的只有水
| A.仅① | B.仅①和② | C.仅①和④ | D.①②③④ |
| A.氯气可使湿润的红色布条褪色,所以氯气具有漂白性 |
| B.氯气没有漂白性,但通入品红溶液中,品红溶液褪色 |
| C.干燥的氯气无漂白性,液氯具有极强的漂白性 |
| D.可用湿润的蓝色石蕊试纸来检验氯气中是否混有氯化氢 |
| A.工业上用氯气与澄清石灰水反应制取漂白粉 |
| B.氯气能与铁反应,所以液氯不宜贮存在钢瓶中 |
| C.漂白粉露置于空气中会变质 |
| D.氯气有强氧化性,可用氯气漂白干燥的有色布条 |
A. | B. | C. | D. |
【知识点】 阿伏加德罗定律 阿伏加德罗定律及其推论解读 阿伏加德罗定律的应用解读
| A.分子个数比为1:1 | B.质量比为17:16 |
| C.原子个数比为5:4 | D.氢原子个数比为4:3 |
【知识点】 阿伏加德罗定律
| A.125mL | B.12.5mL | C.50mL | D.75mL |
【知识点】 物质的量浓度与溶液稀释的计算解读
| A.实验室配制480mL 1mol/L的NaOH溶液,需称量19.2g固体NaOH |
| B.Na2O2中阴、阳离子个数比为1:2 |
| C.用托盘天平称取25.30g NaCl固体 |
| D.用50mL量筒量取4.8mL硫酸 |
| A.混合物中定不含Na2CO3、NaCl | B.混合物中一定含有Na2O2、NaHCO3 |
| C.无法确定混合物中是否含有NaHCO3 | D.混合物中一定不含NaHCO3、NaCl |
| A.32g SO2含有氧原子数为0.5NA |
| B.物质的量浓度为0.5mol/L CaCl2溶液,含有Cl﹣离子数为1NA |
| C.标准状况下,22.4L H2O的分子数为1NA |
| D.常温常压下,14g N2含有分子数为0.5NA |

| A.导管g的作用是增强装置的气密性 |
| B.试剂X和试剂Y分别为浓硫酸、饱和食盐水 |
| C.直接用E接收产物比用导管连接的优点是可防止堵塞 |
| D.F中浓硫酸的作用是防止空气中的水蒸气进入E |
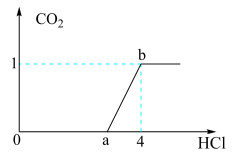
| A.在0~a范围内,只发生中和反应 |
B.ab段发生反应的离子方程式为CO +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| C.a=3 |
| D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2 |
六、解答题 添加题型下试题
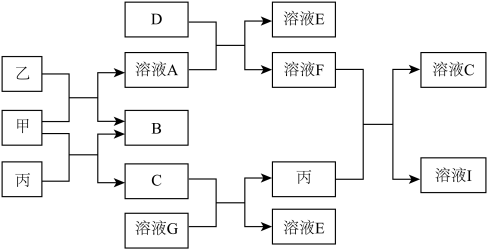
(1)甲物质为
(2)1 mol乙和足量甲反应可生成
(3)D能使湿润的有色布条褪色,其褪色原因是
(4)丙与溶液F反应的化学方程式为
(1)配制稀盐酸时,应选用容量为
(2)计算已知盐酸的物质的量浓度为
(3)经计算需要
A 5mL B 10mL C 25mL D 50mL
(4)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入相应规格的容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是
(5)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是
【知识点】 配制一定物质的量浓度溶液的综合考查解读
试卷分析
试卷题型(共 25题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 氯气 次氯酸及其性质 氯气与金属单质的反应 氯气与碱溶液反应 | |
| 2 | 0.85 | 阿伏加德罗常数的应用 阿伏加德罗定律的应用 | |
| 3 | 0.65 | 阿伏加德罗定律及其推论 阿伏加德罗定律的应用 | |
| 4 | 0.85 | 烃燃烧的通式的相关计算 烃燃烧前后反应物与生成物的分子数关系的有关计算 气态烃完全燃烧前后体积变化规律在计算中的应用 根据混合烃燃烧产物的量推算混合烃组成 | |
| 5 | 0.65 | 阿伏加德罗定律的应用 | |
| 6 | 0.85 | 化学方程式计算中物质的量的运用 氧化钠的化学性质 过氧化钠与水的反应 | |
| 7 | 0.65 | 物质的量浓度的计算 一定物质的量浓度的溶液的配制 配制一定物质的量浓度的溶液实验的误差分析 | |
| 8 | 0.65 | 化学方程式计算中物质的量的运用 基于氧化还原反应守恒规律的计算 过氧化钠的相关计算 | |
| 12 | 0.85 | 次氯酸及其性质 氯水的性质 | |
| 13 | 0.85 | 氯气的化学性质 氯气与非金属单质的反应 氯气与金属单质的反应 新制氯水与久置氯水的区别 | |
| 14 | 0.65 | 氯气的化学性质 氯水的成分及检验 | |
| 15 | 0.85 | 氯气的化学性质 漂白粉和漂粉精的制备原理 漂白粉的变质原因及检验 | |
| 16 | 0.94 | 阿伏加德罗定律 阿伏加德罗定律及其推论 阿伏加德罗定律的应用 | |
| 17 | 0.65 | 阿伏加德罗定律 | |
| 18 | 0.94 | 物质的量浓度与溶液稀释的计算 | |
| 19 | 0.94 | 过氧化钠的物理性质、组成、结构及用途 一定物质的量浓度的溶液的配制 | |
| 20 | 0.4 | 离子反应在化合物组成的分析、鉴定的应用 过氧化钠 碳酸钠 碳酸氢钠的不稳定性 | |
| 21 | 0.85 | 阿伏加德罗常数的应用 22.4L/mol适用条件 以N=m·NA/M为中心的有关基本粒子的推算 物质的量浓度计算-与溶质成分有关的计算 | |
| 22 | 0.65 | 氯气的实验室制法 物质制备的探究 | |
| 23 | 0.65 | 物质的量有关计算 离子反应的实际应用 氢氧化钠、碳酸钠混合溶液与盐酸反应相关考查 碳酸钠、碳酸氢钠混合物的有关求算 | |
| 二、解答题 | |||
| 9 | 0.65 | 无机综合推断 氯气的化学性质 与“铁三角”有关的推断 | 无机推断题 |
| 11 | 0.65 | 氧化还原反应在生活、生产中的应用 氯气的实验室制法 | 实验探究题 |
| 24 | 0.65 | 无机综合推断 氯气与水的反应 过氧化钠 碳酸钠与盐酸的反应 | 无机推断题 |
| 25 | 0.65 | 配制一定物质的量浓度溶液的综合考查 | 实验探究题 |
| 三、填空题 | |||
| 10 | 0.65 | 碳酸钠 碳酸氢钠 | |