河南省南阳市第一中学校2021届高三上期第五次考试化学试题
河南
高三
阶段练习
2020-12-10
746次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、化学反应原理、物质结构与性质、化学实验基础
一、单选题 添加题型下试题
| A.二氧化氯和三氯化铁都常用于自来水的处理,但二者的作用原理不同 |
| B.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| C.C、Si、S都是自然界中含量丰富的非金属元素,三种元素在自然界中既有游离态又有化合态 |
| D.新型材料聚酯纤维、人造纤维都属于有机高分子化合物 |
| A.2.0g H218O与D2O的混合物中所含中子数为NA |
| B.B.3.9g苯与足量的H2反应时,参与反应的碳碳双键数为0.15NA |
| C.常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同 |
| D.将含0.1mol FeCl3的饱和溶液滴入沸水形成的胶体粒子的数目等于0.1NA |
| 选项 | 操作 | 现象 | 结论 |
| A | 将新制氯水滴到淀粉KI试纸上 | 试纸变蓝色 | 氧化性:I2>Cl2 |
| B | 将过量的CO2通入CaCl2溶液中 | 产生白色沉淀 | 酸性:HCl>H2CO3 |
| C | FeSO4溶液中滴入酸性高锰酸钾溶液 | 紫色褪色 | Fe2+有还原性 |
| D | SO2通入溴水中 | 溶液褪色 | SO2有漂白性 |
| A.A | B.B | C.C | D.D |
A.NaCl(aq)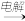 Cl2(g) Cl2(g)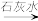 漂白粉(s) 漂白粉(s) |
B.N2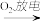 NO NO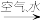 HNO3 HNO3 |
C.制取镁:海水 Mg(OH)2 Mg(OH)2 MgO MgO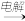 Mg Mg |
D.铝土矿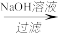 NaAlO2溶液 NaAlO2溶液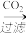 Al(OH)3 Al(OH)3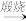 Al2O3 Al2O3 铝 铝 |
| A.用标准的KOH溶液滴定未知浓度的盐酸,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低 |
| B.实验室需要用480mL0.1mol•L-1的硫酸铜溶液,需称取12.0g胆矾,配成500mL溶液 |
| C.金属镁在空气中完全燃烧后,最后剩余两种固体 |
| D.工业上可用铝热反应的方法提取镁 |
②检验Mn2+的存在:5S2O
 +2Mn2++8H2O=10SO
+2Mn2++8H2O=10SO +2MnO
+2MnO +16H+
+16H+下列说法中错误的是
A.S2O 离子中存在一个过氧键(—O—O—),则S2O 离子中存在一个过氧键(—O—O—),则S2O 离子中硫元素的化合价为+6 离子中硫元素的化合价为+6 |
| B.反应②若有0.1mol还原剂被氧化,则转移电子0.5mol |
| C.K2S2O8与浓盐酸混合可得到黄绿色气体 |
| D.反应①配平后还原剂与还原产物之比为8:1 |
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | 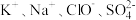 | 少量 | 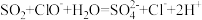 |
| B |  | 过量 |  |
| C | 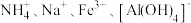 | 过量铜粉 | 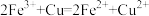 |
| D | 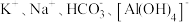 | 少量 | 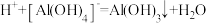 |
| A.A | B.B | C.C | D.D |
(已知:Cu2O+2H+=Cu+Cu2++H2O)
| A.上述体现酸性的硝酸与体现氧化性的硝酸其物质的量之比为5:1 |
| B.若混合物中含0.1molCu,使该混合物与稀硫酸充分反应,消耗硫酸的物质的量为0.1mol |
| C.Cu2O跟稀硝酸反应的离子方程式为:3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O |
| D.若将上述混合物用足量的H2加热还原,所得到固体的质量为32g |
| ① | ② | ③ | II中实验现象 |  | |
| A | 稀盐酸 | MnO2 | 饱和NaCl溶液 | 有细小的白色晶体析出 | |
| B | 浓氨水 | 氧化钙 | 硫酸亚铁溶液 | 产生大量白色沉淀 | |
| C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
| D | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色变为无色 |
| A.A | B.B | C.C | D.D |
二、多选题 添加题型下试题
 COCl2(g),其中容器Ⅰ中5min时到达平衡。
COCl2(g),其中容器Ⅰ中5min时到达平衡。| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
A.容器Ⅰ中前5min的平均反应速率 (CO)=0.32mol·L-1·min-1 (CO)=0.32mol·L-1·min-1 |
| B.该反应正反应为吸热反应 |
| C.容器Ⅱ中起始时Cl2的物质的量为0.55mol |
| D.若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80% |
三、单选题 添加题型下试题
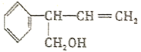
| A.能使酸性高锰酸钾溶液褪色 |
| B.分子中所有碳原子共平面 |
| C.不能与NaHCO3溶液反应 |
| D.在催化剂的作用下,1mol R最多能与4mol H2发生加成反应 |

| A.电池工作时,正极反应式为: O2+2H2O+4e-===4OH- |
| B.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2 |
【知识点】 原电池、电解池综合考查解读
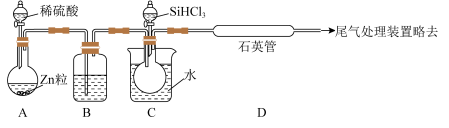
| A.装置 B 中的试剂是浓硫酸 |
| B.实验时先打开装置C中分液漏斗的旋塞 |
| C.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的SiHCl3气化 |
| D.装置D不能采用普通玻璃管的原因是在反应温度下,普通玻璃管会软化 |
| A.Q与W不能形成10电子、14电子、18电子分子 |
| B.Y的最高价氧化物对应水化物的化学式只能表示为 H4YO4 |
| C.Y、Z、Q分别与X化合,只能形成AB2型化合物 |
| D.X、Z、W中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性 |
【知识点】 元素周期律、元素周期表的推断
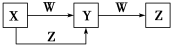
| A.若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2 |
| B.若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3 |
| C.若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2 |
| D.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3 |
【知识点】 无机综合推断 铝三角转化解读 铁三角转化条件分析及判断解读
 、
、 、
、 、Cl﹣中的几种,现进行如下实验:
、Cl﹣中的几种,现进行如下实验:①取少量溶液,逐滴加入氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入 40mL 0.25mol•L﹣1 的盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀 3g(AgCl 的摩尔质量为 143.5g/mol); 下列说法中正确的是( )
| A.该溶液中可能含有 Cl﹣ |
B.该溶液中一定含有 K+、 、 、 、Cl﹣ 、Cl﹣ |
| C.该溶液是否有 K+需做焰色反应实验(透过蓝色钴玻璃片) |
D.该溶液中一定不含有 、Ba2+、Al3+,可能含有 、Ba2+、Al3+,可能含有  |
四、解答题 添加题型下试题
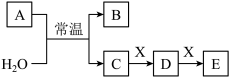
(1)若A为常见的金属单质,焰色试验呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强。该元素在元素周期表中的位置为
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为
【知识点】 无机综合推断 二氧化氮 碳酸钠与碳酸氢钠鉴别的实验解读 亚硫酸及其盐
(1)在课堂教学探究Na2SO3溶液与FeCl3溶液的实际反应时,同学们有以下猜想,请补充完整:
猜想一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生双水解反应,产生了Fe(OH)3胶体;
猜想三:
(2)甲同学认可猜想一,他预测的实验现象是
老师安排甲同学做了如下实验i:
| 装置 | 操作 | 现象 |
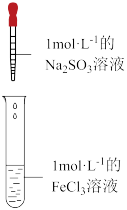 | 向2mL1mol•L-1的FeCl3溶液中,逐滴滴加2mL1mol•L-1的Na2SO3溶液 | 溶液黄色逐渐加深,最终得到红褐色液体(W) |
(4)针对“氧化还原反应有没有发生”,老师组织同学们讨论,同学们思考得出以下检验方案:
方案①:取少量W液体,加铁氰化钾溶液,检验是否有Fe2+
方案②:取少量W液体,加酸性高锰酸钾溶液,检验是否有Fe2+
方案③:取少量W液体,加盐酸酸化,再加氯化钡溶液,检验是否有

你认为方案②
甲同学在老师的指导下迅速完成了实验ii:
| 装置 | 操作 | 现象 |
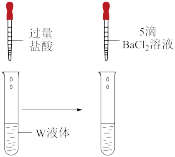 | 取1mLW液体于试管中,滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
通过实验探究,大家认识到Fe3+与
 的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
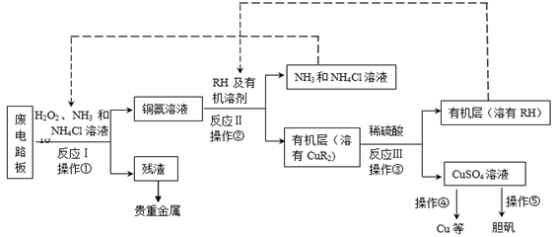
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式:
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是
【知识点】 氧化还原反应的应用 铜 铜的其他化合物 物质分离、提纯综合应用解读
20. 研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1=-49.6kJ/mol
CH3OH(g)+H2O(g)△H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) 2CH3OH(g)△H2=+23.4kJ/mol
2CH3OH(g)△H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H3
CH3OCH3(g)+3H2O(g)△H3
(1)△H3=
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=

(5)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数Kb=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显 +HCO
+HCO +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
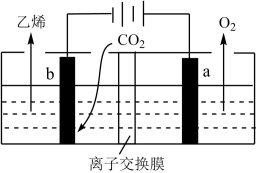
(6)据文献报道,CO2可以在酸性水溶液中用情性电极电解得到乙烯,其原理如图所示。b电极上的电极反应式
试卷分析
试卷题型(共 20题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 自然界中硅元素的存在 铁盐的净水作用及原理 新型有机高分子材料 光导纤维与硅芯片 | |
| 2 | 0.65 | 结合物质结构基础知识与NA相关推算 盐类水解的原理 苯分子结构的特点 元素、核素、同位素 | |
| 3 | 0.65 | 氧化性、还原性强弱的比较 氯水的性质 二氧化硫与其他强氧化剂的反应 Fe2+的还原性 | |
| 4 | 0.65 | 物质的转化 漂白粉和漂粉精的制备原理 铝土矿提取铝的原理 海水提取镁 | |
| 5 | 0.65 | 镁的结构与化学性质 铝热反应 酸碱中和滴定的误差分析 一定物质的量浓度的溶液的配制 | |
| 6 | 0.65 | 氧化还原反应的规律 与氧化剂、还原剂有关的计算 基于氧化还原反应守恒规律的计算 | |
| 7 | 0.4 | 离子方程式的书写 离子方程式的正误判断 离子共存 无附加条件的离子共存 | |
| 8 | 0.65 | 基于氧化还原反应守恒规律的计算 铜与强氧化性酸的反应 氧化亚铜 | |
| 9 | 0.65 | 氯气的实验室制法 氢氧化亚铁 乙酸乙酯制备实验 物质性质实验方案的设计 | |
| 11 | 0.94 | 有机官能团的性质及结构 含碳碳双键物质的性质的推断 有机分子中原子共面的判断 多官能团有机物的结构与性质 | |
| 12 | 0.4 | 原电池、电解池综合考查 | |
| 13 | 0.65 | 硅的制备 物质制备的探究 | |
| 14 | 0.65 | 元素周期律、元素周期表的推断 | |
| 15 | 0.4 | 无机综合推断 铝三角转化 铁三角转化条件分析及判断 | |
| 16 | 0.4 | 限定条件下的离子共存 离子反应在化合物组成的分析、鉴定的应用 偏铝酸钠与盐酸的反应 碳元素及其化合物 | |
| 二、多选题 | |||
| 10 | 0.4 | 化学平衡的移动及其影响因素 等效平衡理论的综合应用 化学平衡题中基于图表数据的相关计算 | |
| 三、解答题 | |||
| 17 | 0.65 | 无机综合推断 二氧化氮 碳酸钠与碳酸氢钠鉴别的实验 亚硫酸及其盐 | 无机推断题 |
| 18 | 0.65 | Fe3+与其他物质氧化性强弱关系 盐类双水解反应 物质性质的探究 亚硫酸及其盐 | 实验探究题 |
| 19 | 0.4 | 氧化还原反应的应用 铜 铜的其他化合物 物质分离、提纯综合应用 | 工业流程题 |
| 20 | 0.65 | 盖斯定律及其有关计算 化学平衡状态的判断方法 化学平衡常数的有关计算 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |



