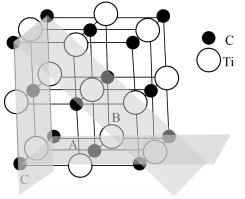
钛铁矿直接碳热还原法可以制得碳化钛。碳化钛在航空航天、机械加工等领域应用广泛。其晶胞结构与氯化钠相似,如图所示,晶胞的边长为anm。_____ 。
2.下列关于碳化钛的说法正确的是_____。
3.已知阿伏加德罗常数为NA,则碳化钛晶体的密度为_____ g·cm-3(列出计算式)。
4.由于晶体的不同晶面其原子排布的不同或者暴露的原子不同,导致所展现出的物理、化学性质会有所不同,这种现象成为晶面效应。若裸露的分别是A面、B面、C面,性能与另外两面不同的是_____ 。
A.A面 B.B面 C.C面
5.当TiC中的C原子被N原子取代时,则产生TiC1-xNx,其性能与x的值有关。随着x的增大,材料的硬度降低、韧性提高;同时x值会影响碳氮化钛的晶胞边长,x越大,则晶胞边长_____ 。
A.增大 B.减小 C.不变
2.下列关于碳化钛的说法正确的是_____。
| A.碳化钛中碳和钛的比例为1∶1 |
| B.C原子位于Ti形成的四面体空隙中 |
| C.离Ti原子最近的且距离相等的C原子的数目为8 |
| D.碳化钛具有高熔点、高硬度的特点 |
4.由于晶体的不同晶面其原子排布的不同或者暴露的原子不同,导致所展现出的物理、化学性质会有所不同,这种现象成为晶面效应。若裸露的分别是A面、B面、C面,性能与另外两面不同的是
A.A面 B.B面 C.C面
5.当TiC中的C原子被N原子取代时,则产生TiC1-xNx,其性能与x的值有关。随着x的增大,材料的硬度降低、韧性提高;同时x值会影响碳氮化钛的晶胞边长,x越大,则晶胞边长
A.增大 B.减小 C.不变
更新时间:2024-04-17 16:17:22
|
相似题推荐
【推荐1】钛和钛的合金已被广泛应用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有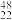 Ti和
Ti和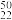 Ti两种原子,它们互称为
Ti两种原子,它们互称为________ 。Ti元素在元素周期表中的位置是第________ 周期,第________ 族;基态原子的电子排布式为________ ,按外围电子排布特征Ti元素在元素周期表分区中属于___________ 区元素。
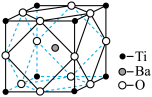
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是_____________ 。
(3)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5]2+中含有的化学键类型是________ ,该配合物的配位体是________ 。
(1)钛有
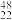 Ti和
Ti和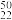 Ti两种原子,它们互称为
Ti两种原子,它们互称为(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是

(3)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5]2+中含有的化学键类型是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】二氯异氰尿酸钠(结构为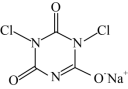 )是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为
)是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为 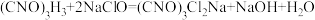 。某同学在实验室用如下装置制取二氯异氰尿酸钠(部分夹持装置已略)。
。某同学在实验室用如下装置制取二氯异氰尿酸钠(部分夹持装置已略)。
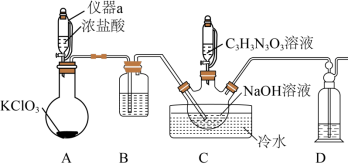
请回答下列问题:
(1)Cl的价电子轨道表达式为_______ 。
(2)仪器a的名称是_______ ;仪器D中的试剂是_______ 。
(3)A中烧瓶内发生反应的化学方程式为_______ 。
(4)装置B的作用是_______ ;如果没有B装置,NaOH溶液会产生的不良结果是_______ 。
(5)待装置C_______ 时(填实验现象),再滴加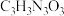 溶液,反应过程中需要不断通入Cl2的目的是
溶液,反应过程中需要不断通入Cl2的目的是_______ 。
(6)实验室测定二氯异氰尿酸钠样品中有效氯的原理如下:
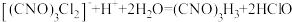
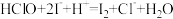

准确称取m g样品,配成100mL溶液,取20.00mL所配溶液于碘量瓶中,加入稀 和过量KI溶液,充分反应后,加入淀粉溶液,用c mol/LNa2S2O3标准溶液滴定,滴到终点时,消耗Na2S2O3标准溶液的体积为V mL,则样品有效氯含量为
和过量KI溶液,充分反应后,加入淀粉溶液,用c mol/LNa2S2O3标准溶液滴定,滴到终点时,消耗Na2S2O3标准溶液的体积为V mL,则样品有效氯含量为_______ %( 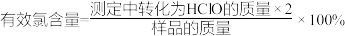 )
)
 )是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为
)是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为 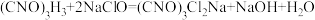 。某同学在实验室用如下装置制取二氯异氰尿酸钠(部分夹持装置已略)。
。某同学在实验室用如下装置制取二氯异氰尿酸钠(部分夹持装置已略)。
请回答下列问题:
(1)Cl的价电子轨道表达式为
(2)仪器a的名称是
(3)A中烧瓶内发生反应的化学方程式为
(4)装置B的作用是
(5)待装置C
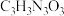 溶液,反应过程中需要不断通入Cl2的目的是
溶液,反应过程中需要不断通入Cl2的目的是(6)实验室测定二氯异氰尿酸钠样品中有效氯的原理如下:
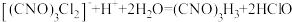
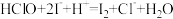

准确称取m g样品,配成100mL溶液,取20.00mL所配溶液于碘量瓶中,加入稀
 和过量KI溶液,充分反应后,加入淀粉溶液,用c mol/LNa2S2O3标准溶液滴定,滴到终点时,消耗Na2S2O3标准溶液的体积为V mL,则样品有效氯含量为
和过量KI溶液,充分反应后,加入淀粉溶液,用c mol/LNa2S2O3标准溶液滴定,滴到终点时,消耗Na2S2O3标准溶液的体积为V mL,则样品有效氯含量为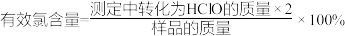 )
)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】现有A、B、C、D、E、F、G、H八种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
(1)C2A4的电子式为_______ 。
(2)B元素的原子核外共有_______ 种不同空间运动状态的电子,电子所处最高能级轨道的形状为_______ 。
(3)G2D分子的VSEPR模型名称为_______ 。
(4)某同学推断E元素基态原子的轨道表示式为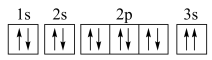 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了_______ ,解释E元素原子的第一电离能大于F元素原子的第一电离能的原因:_______ 。
(5)B2A4分子中含有的σ键、π键数目之比为_______ 。
(6)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:_______ 。
(7)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有_______ 种。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
(1)C2A4的电子式为
(2)B元素的原子核外共有
(3)G2D分子的VSEPR模型名称为
(4)某同学推断E元素基态原子的轨道表示式为
 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了(5)B2A4分子中含有的σ键、π键数目之比为
(6)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:
(7)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】随着环境污染及能源短缺的日益严重,汽车行业掀起了电动车热潮。2020年全球新能源汽车领导者比亚迪推出了“刀片电池”,大幅度提高了续航里程。刀片电池称为超级磷酸铁锂电池,其正极材料为 ,总反应式为:
,总反应式为: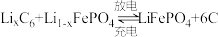 。回答下列问题:
。回答下列问题:
(1)Fe在元素周期表中的位置为___________ 。基态 比
比 结构稳定的原因可解释为
结构稳定的原因可解释为___________ 。
(2) 中Fe的化合价为
中Fe的化合价为___________ ,其离子常用___________ 试剂检验, 的空间构型为
的空间构型为___________ 。
(3)电池负极为嵌入Li的石墨烯层,其晶胞结构如下图。

①石墨烯是由碳原子形成的六元环状二维空间结构,其中C原子的杂化方式为___________ 。
②设 为阿伏加德罗常数的数值,该晶胞密度为
为阿伏加德罗常数的数值,该晶胞密度为___________  (列出计算式即可)。
(列出计算式即可)。
 ,总反应式为:
,总反应式为: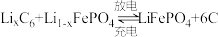 。回答下列问题:
。回答下列问题:(1)Fe在元素周期表中的位置为
 比
比 结构稳定的原因可解释为
结构稳定的原因可解释为(2)
 中Fe的化合价为
中Fe的化合价为 的空间构型为
的空间构型为(3)电池负极为嵌入Li的石墨烯层,其晶胞结构如下图。

①石墨烯是由碳原子形成的六元环状二维空间结构,其中C原子的杂化方式为
②设
 为阿伏加德罗常数的数值,该晶胞密度为
为阿伏加德罗常数的数值,该晶胞密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】金属钼(Mo)在工业和国防建设中有重要的作用。钼的常见化合价为+4、+5、+6。由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图所示∶

回答下列问题∶
(1)根据流程中信息可以判断MoO3是___ 氧化物。(填“酸性”、“碱性”或“两性”)
(2)钼精矿在空气中焙烧时,发生的主要方程式为___ 。若1molMoS2发生该反应,则被Mo元素还原的氧气的物质的量___ 。
(3)操作1,加入碳酸钠溶液碱浸、过滤。25℃时,碱浸液中c(MoO )=0.80mol•L-1、c(SO
)=0.80mol•L-1、c(SO )=0.50mol•L-1,在结晶前需加入氢氧化钡固体除去溶液中的SO
)=0.50mol•L-1,在结晶前需加入氢氧化钡固体除去溶液中的SO ,当BaMoO4开始沉淀时,SO
,当BaMoO4开始沉淀时,SO 的去除率是
的去除率是___ 。[25℃时,Ksp(BaMoO4)=4.0×10-8,Ksp(BaSO4)=1.1×10-10,操作过程中溶液体积温度变化可忽略不计]
(4)操作3为过滤得到钼酸固体,检验钼酸是否洗涤干净的操作___ 。
(5)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO 生成,该反应的离子方程式为
生成,该反应的离子方程式为___ 。
(6)钼单质的晶体为面心立方晶系,晶胞结构如图所示。晶胞中Mo原子周围距离相等且最近的Mo原子有___ 个。


回答下列问题∶
(1)根据流程中信息可以判断MoO3是
(2)钼精矿在空气中焙烧时,发生的主要方程式为
(3)操作1,加入碳酸钠溶液碱浸、过滤。25℃时,碱浸液中c(MoO
 )=0.80mol•L-1、c(SO
)=0.80mol•L-1、c(SO )=0.50mol•L-1,在结晶前需加入氢氧化钡固体除去溶液中的SO
)=0.50mol•L-1,在结晶前需加入氢氧化钡固体除去溶液中的SO ,当BaMoO4开始沉淀时,SO
,当BaMoO4开始沉淀时,SO 的去除率是
的去除率是(4)操作3为过滤得到钼酸固体,检验钼酸是否洗涤干净的操作
(5)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO
 生成,该反应的离子方程式为
生成,该反应的离子方程式为(6)钼单质的晶体为面心立方晶系,晶胞结构如图所示。晶胞中Mo原子周围距离相等且最近的Mo原子有

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】金属晶体、离子晶体、共价晶体、分子晶体等模型都是典型的晶体结构模型,大多数实际晶体结构要复杂得多。
(1)一些氧化物的熔点如下表所示:
解释表中氧化物之间熔点差异的原因_______ 。
(2)LiX(X=F,Cl,Br,D具有NaCl型晶体结构。当阴、阳离子电荷的绝对值相同且它们的半径相近时,生成的盐类一般难溶于水。由上述规则可以判断LiF、LiCl、LiBr、LiI中溶解度最小的是_______ 。
(3)在硼酸盐中,阴离子有链状、环状等多种结构形式。如图是一种链状结构的多硼酸根,则多硼酸根离子符号为_______ 。

(4)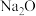 属立方晶体,晶胞结构如图所示。每个晶胞中含有
属立方晶体,晶胞结构如图所示。每个晶胞中含有 的数目为
的数目为_______ , 的配位数是
的配位数是_______ , 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值,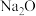 晶体的密度为
晶体的密度为
 ,晶胞中与
,晶胞中与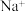 最近的
最近的 间的距离=
间的距离=_______ pm(用代数式表示)。

(1)一些氧化物的熔点如下表所示:
| 氧化物 |  | MgO |  | 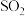 |
| 熔点/℃ | 1570 | 2800 | 23.8 | -75.5 |
(2)LiX(X=F,Cl,Br,D具有NaCl型晶体结构。当阴、阳离子电荷的绝对值相同且它们的半径相近时,生成的盐类一般难溶于水。由上述规则可以判断LiF、LiCl、LiBr、LiI中溶解度最小的是
(3)在硼酸盐中,阴离子有链状、环状等多种结构形式。如图是一种链状结构的多硼酸根,则多硼酸根离子符号为

(4)
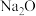 属立方晶体,晶胞结构如图所示。每个晶胞中含有
属立方晶体,晶胞结构如图所示。每个晶胞中含有 的数目为
的数目为 的配位数是
的配位数是 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值,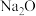 晶体的密度为
晶体的密度为
 ,晶胞中与
,晶胞中与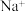 最近的
最近的 间的距离=
间的距离=
您最近一年使用:0次



