名校
解题方法
1 . “建设生态文明是中华民族永续发展的千年大计。”控制和治理 、
、 是解决光化学烟雾、减少酸雨的有效途径,对构建生态文明有着极为重要的意义。回答下列问题:
是解决光化学烟雾、减少酸雨的有效途径,对构建生态文明有着极为重要的意义。回答下列问题:
(1) 的处理。
的处理。 是硝酸生产中氨催化氧化的副产物,用特种催化剂能使
是硝酸生产中氨催化氧化的副产物,用特种催化剂能使 分解。
分解。 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 的化学方程式为
的化学方程式为_______ 。
(2)NO和 的处理。已除去
的处理。已除去 的硝酸尾气可用NaOH溶液吸收,主要反应如下:
的硝酸尾气可用NaOH溶液吸收,主要反应如下:
 、
、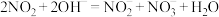
①吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是 ;吸收后排放的尾气中含量较高的氮氧化物是
;吸收后排放的尾气中含量较高的氮氧化物是_______ (填化学式)。
②Cu与适量浓硝酸反应生成0.9mol氮的氧化物(NO、 、
、 ),这些氧化物恰好能被500mL2mol⋅L-1NaOH溶液完全吸收,得到
),这些氧化物恰好能被500mL2mol⋅L-1NaOH溶液完全吸收,得到 和
和 的混合溶液,若参加反应的铜为51.2g,则生成
的混合溶液,若参加反应的铜为51.2g,则生成_______ mol 。
。
③在100mL稀 和稀
和稀 组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol·L-1.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中
组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol·L-1.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中 的物质的量浓度最大值为
的物质的量浓度最大值为_______ (反应前后溶液体积变化忽略不计)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 和
和 ,其离子方程式为
,其离子方程式为_______ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是_______ 。
(4)吸收工厂烟气中的 ,能有效减少
,能有效减少 对空气的污染。
对空气的污染。
①富氧煅烧燃煤产生的低浓度的 可以在炉内添加
可以在炉内添加 通过以下方式脱除:
通过以下方式脱除:_______ 。
②氨水吸收 。当通入
。当通入 至溶液
至溶液 左右时,主要反应的离子方程式为
左右时,主要反应的离子方程式为_______ 。
已知:溶液中 、
、 ,
, 的物质的量分数随pH的分布如图所示。
的物质的量分数随pH的分布如图所示。
 、
、 是解决光化学烟雾、减少酸雨的有效途径,对构建生态文明有着极为重要的意义。回答下列问题:
是解决光化学烟雾、减少酸雨的有效途径,对构建生态文明有着极为重要的意义。回答下列问题:(1)
 的处理。
的处理。 是硝酸生产中氨催化氧化的副产物,用特种催化剂能使
是硝酸生产中氨催化氧化的副产物,用特种催化剂能使 分解。
分解。 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 的化学方程式为
的化学方程式为(2)NO和
 的处理。已除去
的处理。已除去 的硝酸尾气可用NaOH溶液吸收,主要反应如下:
的硝酸尾气可用NaOH溶液吸收,主要反应如下: 、
、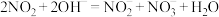
①吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是 ;吸收后排放的尾气中含量较高的氮氧化物是
;吸收后排放的尾气中含量较高的氮氧化物是②Cu与适量浓硝酸反应生成0.9mol氮的氧化物(NO、
 、
、 ),这些氧化物恰好能被500mL2mol⋅L-1NaOH溶液完全吸收,得到
),这些氧化物恰好能被500mL2mol⋅L-1NaOH溶液完全吸收,得到 和
和 的混合溶液,若参加反应的铜为51.2g,则生成
的混合溶液,若参加反应的铜为51.2g,则生成 。
。③在100mL稀
 和稀
和稀 组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol·L-1.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中
组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol·L-1.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中 的物质的量浓度最大值为
的物质的量浓度最大值为(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。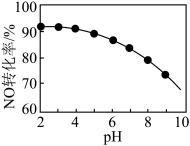
 和
和 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
(4)吸收工厂烟气中的
 ,能有效减少
,能有效减少 对空气的污染。
对空气的污染。①富氧煅烧燃煤产生的低浓度的
 可以在炉内添加
可以在炉内添加 通过以下方式脱除:
通过以下方式脱除: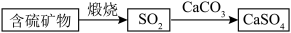
②氨水吸收
 。当通入
。当通入 至溶液
至溶液 左右时,主要反应的离子方程式为
左右时,主要反应的离子方程式为已知:溶液中
 、
、 ,
, 的物质的量分数随pH的分布如图所示。
的物质的量分数随pH的分布如图所示。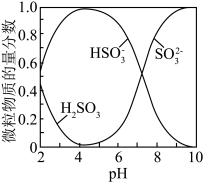
您最近一年使用:0次
名校
解题方法
2 . 水体污染物中氮元素以水溶性硝态氮(以 、
、 形式存在)和水溶性铵态氮(以
形式存在)和水溶性铵态氮(以 的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
(1)研究表明,在反硝化细菌作用下,可用乙酸(CH3COOH)处理酸性废水中的 ,产生两种对大气无污染的气体。该反应的离子方程式为
,产生两种对大气无污染的气体。该反应的离子方程式为___________ 。
(2)有人研究用纳米零价铁去除水体中 。
。
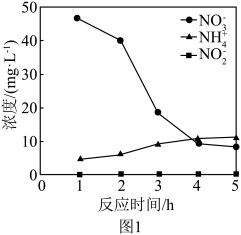
①控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其原因是
)浓度减少,其原因是___________ 。
②将一定量纳米零价铁和少量铜粉附着在生物炭上,可将 转化为
转化为 ,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是___________ ;
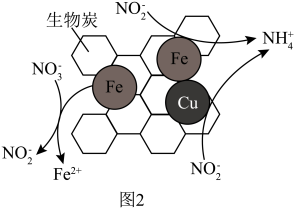
③如图2所示, 转化为
转化为 的反应机理可描述为:
的反应机理可描述为: 得到纳米零价铁失去的电子转化为
得到纳米零价铁失去的电子转化为 ,
,___________ 。
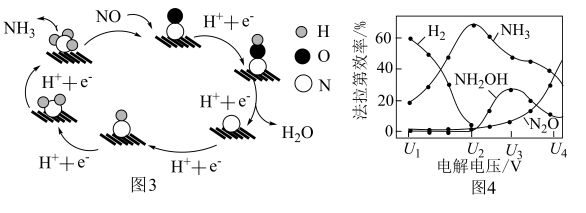
(3)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图4所示。已知 ,
, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数; 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
①当电解电压为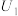 时,电解生成
时,电解生成 和
和 的物质的量之比为
的物质的量之比为___________ 。
②当电解电压为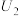 时,催化电解NO生成
时,催化电解NO生成 的电极反应式为
的电极反应式为___________ 。
 、
、 形式存在)和水溶性铵态氮(以
形式存在)和水溶性铵态氮(以 的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。(1)研究表明,在反硝化细菌作用下,可用乙酸(CH3COOH)处理酸性废水中的
 ,产生两种对大气无污染的气体。该反应的离子方程式为
,产生两种对大气无污染的气体。该反应的离子方程式为(2)有人研究用纳米零价铁去除水体中
 。
。①控制其他条件不变,用纳米零价铁还原水体中的
 ,测得溶液中
,测得溶液中 、
、 浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其原因是
)浓度减少,其原因是
②将一定量纳米零价铁和少量铜粉附着在生物炭上,可将
 转化为
转化为 ,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是
③如图2所示,
 转化为
转化为 的反应机理可描述为:
的反应机理可描述为: 得到纳米零价铁失去的电子转化为
得到纳米零价铁失去的电子转化为 ,
,(3)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图4所示。已知
 ,
, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;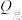 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
①当电解电压为
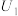 时,电解生成
时,电解生成 和
和 的物质的量之比为
的物质的量之比为②当电解电压为
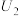 时,催化电解NO生成
时,催化电解NO生成 的电极反应式为
的电极反应式为
您最近一年使用:0次
名校
解题方法
3 . 锡酸钠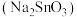 在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为
在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为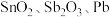 及
及 等)为原料制备锡酸钠晶体
等)为原料制备锡酸钠晶体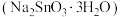 的工艺流程如下:
的工艺流程如下:
②锡酸钠晶体易溶于水,难溶于乙醇。
回答下列问题:
(1) 元素在周期表中的位置为
元素在周期表中的位置为___________ 。
(2)“高温真空蒸发”控制温度在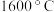 左右,目的是
左右,目的是___________ 。
(3)“高温碱熔”时,单质 与
与 和
和 反应生成
反应生成 的化学方程式为
的化学方程式为___________ 。
(4)已知“溶浸”后溶液中的阴离子主要为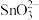 和少量
和少量 ,“沉铅”时发生反应的离子方程式为
,“沉铅”时发生反应的离子方程式为___________ 。
(5)获得锡酸钠晶体的“系列操作”是蒸发浓缩、冷却结晶、过滤、___________ (填试剂名称)洗涤、___________ (填“低温”或“高温”)干燥。
(6)利用焦炭在 高温下还原
高温下还原 可制得单质
可制得单质 。
。 存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为
存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为 ,则最近的两个锡原子间的距离为
,则最近的两个锡原子间的距离为___________  。
。
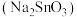 在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为
在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为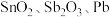 及
及 等)为原料制备锡酸钠晶体
等)为原料制备锡酸钠晶体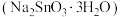 的工艺流程如下:
的工艺流程如下: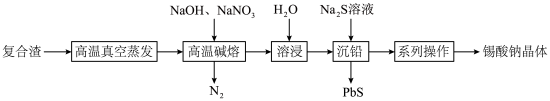
| 物质 | 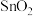 |  |  |  |
沸点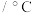 | 1800 | 2260 | 1550 | 1740 |
回答下列问题:
(1)
 元素在周期表中的位置为
元素在周期表中的位置为(2)“高温真空蒸发”控制温度在
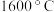 左右,目的是
左右,目的是(3)“高温碱熔”时,单质
 与
与 和
和 反应生成
反应生成 的化学方程式为
的化学方程式为(4)已知“溶浸”后溶液中的阴离子主要为
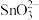 和少量
和少量 ,“沉铅”时发生反应的离子方程式为
,“沉铅”时发生反应的离子方程式为(5)获得锡酸钠晶体的“系列操作”是蒸发浓缩、冷却结晶、过滤、
(6)利用焦炭在
 高温下还原
高温下还原 可制得单质
可制得单质 。
。 存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为
存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为 ,则最近的两个锡原子间的距离为
,则最近的两个锡原子间的距离为 。
。
您最近一年使用:0次
2024-04-07更新
|
240次组卷
|
2卷引用:云南省昆明市2024届高三“三诊一模”教学质量检测(二模)理综-化学试题
4 . 工业废水中的氨氨(以NH3、 形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
(1)微生物法:(酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 作用生成N2。
作用生成N2。
① 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
② 与
与 在转化为N2的反应中消耗
在转化为N2的反应中消耗 与
与 的物质的量之比为
的物质的量之比为___________ 。
(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为N2而除去。NaClO氧化NH3的离子方程式为___________ 。
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比O3更强。

活性炭奥氧氧化氨氮的机理可描述为___________ 。
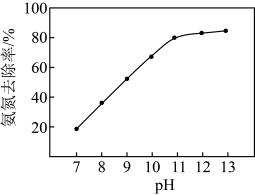
②其它条件不变调节废水的pH,废水中氨氮去除率随pH的变化如题17图-3所示。随pH增大氨氮去除率先明显增大,后变化较小,可能的原因是___________ 。
 形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。(1)微生物法:(酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 作用生成N2。
作用生成N2。①
 转化为
转化为 的离子方程式为
的离子方程式为②
 与
与 在转化为N2的反应中消耗
在转化为N2的反应中消耗 与
与 的物质的量之比为
的物质的量之比为(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为N2而除去。NaClO氧化NH3的离子方程式为
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比O3更强。

活性炭奥氧氧化氨氮的机理可描述为
②其它条件不变调节废水的pH,废水中氨氮去除率随pH的变化如题17图-3所示。随pH增大氨氮去除率先明显增大,后变化较小,可能的原因是

您最近一年使用:0次
解题方法
5 . 硝酸镉晶体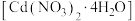 常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含
常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含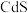 (难溶于水),含少量
(难溶于水),含少量 、
、 、
、 、
、 ]为原料制备硝酸镉晶体,制作流程如图所示。
]为原料制备硝酸镉晶体,制作流程如图所示。
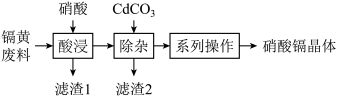
已知:①温度较高时,硝酸镉易分解;
②25℃,部分氢氧化物的 如下表所示:
如下表所示:
回答下列问题:
(1)“酸浸”时,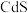 、
、 与一定浓度稀硝酸反应,均生成单质硫和
与一定浓度稀硝酸反应,均生成单质硫和 ,
,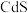 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为___________ ,该反应中参加反应的硝酸中,被还原的硝酸与未被还原的硝酸的物质的量之比为___________ 。“酸浸”所得溶液中,含有的阳离子有 、
、 、
、___________ 。
(2)当溶液中离子浓度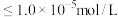 时,认为该离子已完全除去。若“除杂”所得滤液中
时,认为该离子已完全除去。若“除杂”所得滤液中 ,则
,则___________ (填“能”或“不能”)调节溶液 ,以达到除去硝酸镉溶液中的
,以达到除去硝酸镉溶液中的 的目的,原因是
的目的,原因是___________ 。
(3)硝酸镉与硝酸锌的溶解度随温度的变化关系如图。

“系列操作”依次为:
步骤i:将除杂所得滤液加热浓缩至溶液表面生成薄膜为止;
步骤ii:……
步骤iii:……
步骤iv:在低温烘干,制得硝酸镉晶体成品。
①“步骤i”加热浓缩滤液,用到的仪器有蒸发皿、铁架台(带铁圈)、玻璃棒、石棉网,还需要用到的仪器有___________ (填标号)。
a. b.
b.  c.
c. d.
d.
②“步骤ii”、“步骤iii”分别为___________ ,___________ 。
③“步骤iv”中,采用低温烘干的原因是___________ 。
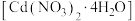 常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含
常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含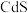 (难溶于水),含少量
(难溶于水),含少量 、
、 、
、 、
、 ]为原料制备硝酸镉晶体,制作流程如图所示。
]为原料制备硝酸镉晶体,制作流程如图所示。
已知:①温度较高时,硝酸镉易分解;
②25℃,部分氢氧化物的
 如下表所示:
如下表所示: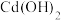 |  |  |  | |
 |  | 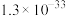 | 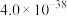 | 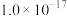 |
(1)“酸浸”时,
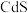 、
、 与一定浓度稀硝酸反应,均生成单质硫和
与一定浓度稀硝酸反应,均生成单质硫和 ,
,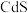 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为 、
、 、
、(2)当溶液中离子浓度
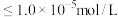 时,认为该离子已完全除去。若“除杂”所得滤液中
时,认为该离子已完全除去。若“除杂”所得滤液中 ,则
,则 ,以达到除去硝酸镉溶液中的
,以达到除去硝酸镉溶液中的 的目的,原因是
的目的,原因是(3)硝酸镉与硝酸锌的溶解度随温度的变化关系如图。

“系列操作”依次为:
步骤i:将除杂所得滤液加热浓缩至溶液表面生成薄膜为止;
步骤ii:……
步骤iii:……
步骤iv:在低温烘干,制得硝酸镉晶体成品。
①“步骤i”加热浓缩滤液,用到的仪器有蒸发皿、铁架台(带铁圈)、玻璃棒、石棉网,还需要用到的仪器有
a.
 b.
b.  c.
c. d.
d.
②“步骤ii”、“步骤iii”分别为
③“步骤iv”中,采用低温烘干的原因是
您最近一年使用:0次
解题方法
6 . 以二氧化铈(CeO2)为原料制备碳酸铈(Ce2(CO3)3)的工业流程如下:
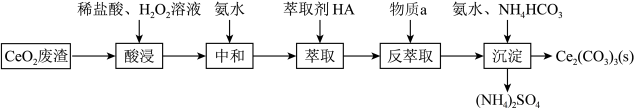
已知水溶液中的Ce3+能被有机萃取剂(HA)萃取,萃取原理可表示为 ;回答下列问题:
;回答下列问题:
(1)写出两条可以提高酸浸效率的措施___________ 、___________ 。
(2)写出酸浸过程中发生反应的离子方程式___________ ,其中H2O2的作用是___________ 。
(3)萃取前加氨水中和的目的是___________ (用平衡移动的原理解释)。
(4)写出物质a的化学式___________ 。
(5)写出沉淀过程的离子方程式___________ 。
(6)该流程中可循环使用的试剂为___________ 。

已知水溶液中的Ce3+能被有机萃取剂(HA)萃取,萃取原理可表示为
 ;回答下列问题:
;回答下列问题:(1)写出两条可以提高酸浸效率的措施
(2)写出酸浸过程中发生反应的离子方程式
(3)萃取前加氨水中和的目的是
(4)写出物质a的化学式
(5)写出沉淀过程的离子方程式
(6)该流程中可循环使用的试剂为
您最近一年使用:0次
解题方法
7 . 铅(Pb)元素的主要化合价有+2价和+4价,溶液中铅为+2价(Pb2+或 ,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
(1)Pb3O4 俗名红丹,在涂料工业中用作防锈颜料,Pb3O4中+2价铅和+4价铅的原子个数之比为
(2)Pb、PbO2可用于制造铅蓄电池,铅蓄电池工作时的反应方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,该反应中还原产物为
(3)工业上利用铅渣(主要成分是PbO、Pb,以及少量不溶于硝酸的杂质)生产PbSO4的流程如图:
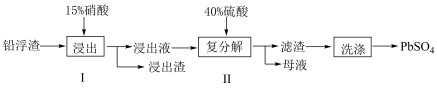
已知步骤1有NO产生,试写出Pb与硝酸反应的化学方程式
(4)血铅是指血液中铅元素的含量。血铅超标会引起机体的神经系统、血液系统、消化系统的一系列异常表现。某人血液中铅的浓度为0.4μg/mL,若转化为物质的量浓度为
您最近一年使用:0次
解题方法
8 . 钴(Co)合金广泛应用于机械制造等领域。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为_____ 。
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。
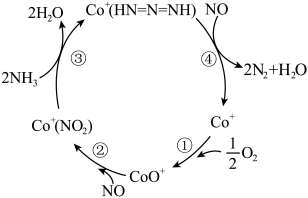
①在反应②中NO作_____ (填“氧化剂”或“还原剂”),与反应④中NO的作用_____ (填“是”或“不是”)一样的。
②写出步骤③对应的离子方程式:_____ 。
③整个历程中氧化剂与还原剂的物质的量之比为_____ 。
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:_____ 。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。

①在反应②中NO作
②写出步骤③对应的离子方程式:
③整个历程中氧化剂与还原剂的物质的量之比为
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:
您最近一年使用:0次
名校
解题方法
9 . 铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
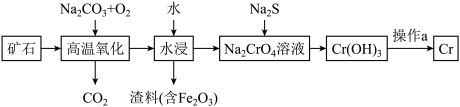
已知:Cr(OH)3是一种难溶于水的沉淀。
①Fe(CrO2)2中各元素化合价均为整数,则铬为______ 价。
②高温氧化时生成产物除 Na2CrO4外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为_____________________ 。
③操作a分两步反应进行,第一步为Cr(OH)3加热分解:第二步将铝加入第一步产物中,高温下生成新的氧化物和金属单质。写出第二步反应的化学方程式:_________________________ 。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与 NaOH、稀硫酸反应的离子方程式:______________ 、____________ 。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:________________ 。
②若处理含1mol (不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为___________ 。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

已知:Cr(OH)3是一种难溶于水的沉淀。
①Fe(CrO2)2中各元素化合价均为整数,则铬为
②高温氧化时生成产物除 Na2CrO4外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为
③操作a分两步反应进行,第一步为Cr(OH)3加热分解:第二步将铝加入第一步产物中,高温下生成新的氧化物和金属单质。写出第二步反应的化学方程式:
(2)Cr(OH)3是两性氢氧化物,请写出其分别与 NaOH、稀硫酸反应的离子方程式:
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含
 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出
 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:②若处理含1mol
 (不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
10 . 实验室以含锌废液(主要成分为ZnSO4,还含有少量的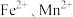 )为原料制备ZnCO3·2Zn(OH)2的实验流程如下:
)为原料制备ZnCO3·2Zn(OH)2的实验流程如下:___________ 。
(2)写出“沉锌”时反应的离子方程式:___________ 。
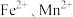 )为原料制备ZnCO3·2Zn(OH)2的实验流程如下:
)为原料制备ZnCO3·2Zn(OH)2的实验流程如下:
(2)写出“沉锌”时反应的离子方程式:
您最近一年使用:0次



