名校
解题方法
1 . 锡酸钠 在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为
在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为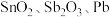 及
及 等)为原料制备锡酸钠晶体
等)为原料制备锡酸钠晶体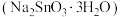 的工艺流程如下:
的工艺流程如下:
②锡酸钠晶体易溶于水,难溶于乙醇。
回答下列问题:
(1) 元素在周期表中的位置为
元素在周期表中的位置为___________ 。
(2)“高温真空蒸发”控制温度在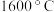 左右,目的是
左右,目的是___________ 。
(3)“高温碱熔”时,单质 与
与 和
和 反应生成
反应生成 的化学方程式为
的化学方程式为___________ 。
(4)已知“溶浸”后溶液中的阴离子主要为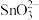 和少量
和少量 ,“沉铅”时发生反应的离子方程式为
,“沉铅”时发生反应的离子方程式为___________ 。
(5)获得锡酸钠晶体的“系列操作”是蒸发浓缩、冷却结晶、过滤、___________ (填试剂名称)洗涤、___________ (填“低温”或“高温”)干燥。
(6)利用焦炭在 高温下还原
高温下还原 可制得单质
可制得单质 。
。 存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为
存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为 ,则最近的两个锡原子间的距离为
,则最近的两个锡原子间的距离为___________  。
。
 在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为
在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为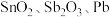 及
及 等)为原料制备锡酸钠晶体
等)为原料制备锡酸钠晶体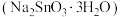 的工艺流程如下:
的工艺流程如下: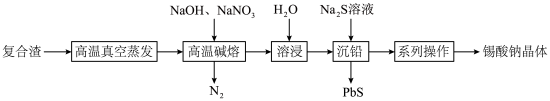
| 物质 |  |  |  |  |
沸点 | 1800 | 2260 | 1550 | 1740 |
回答下列问题:
(1)
 元素在周期表中的位置为
元素在周期表中的位置为(2)“高温真空蒸发”控制温度在
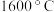 左右,目的是
左右,目的是(3)“高温碱熔”时,单质
 与
与 和
和 反应生成
反应生成 的化学方程式为
的化学方程式为(4)已知“溶浸”后溶液中的阴离子主要为
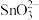 和少量
和少量 ,“沉铅”时发生反应的离子方程式为
,“沉铅”时发生反应的离子方程式为(5)获得锡酸钠晶体的“系列操作”是蒸发浓缩、冷却结晶、过滤、
(6)利用焦炭在
 高温下还原
高温下还原 可制得单质
可制得单质 。
。 存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为
存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为 ,则最近的两个锡原子间的距离为
,则最近的两个锡原子间的距离为 。
。
您最近半年使用:0次
2024-04-19更新
|
218次组卷
|
2卷引用:云南省昆明市2024届高三“三诊一模”教学质量检测(二模)理综-化学试题
解题方法
2 . 三氯化锑( )用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为
)用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、
、 和
和 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图: 具有强氧化性,“浸出液”主要含盐酸和
具有强氧化性,“浸出液”主要含盐酸和 ,还含
,还含 、
、 、
、 和
和 等杂质;
等杂质;
②常温下, 、
、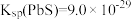 ;
;
③溶液中离子浓度小于或等于 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
回答下列问题:
(1)除将辉锑矿粉碎外,还能加快辉锑矿“酸浸”速率的措施有___________ (填一条即可)。
(2)“滤渣1”的主要成分有___________ (写化学式)。
(3)“浸出液”中加入适量 的目的是
的目的是___________ (填化学方程式)。
(4)当 、
、 共沉淀时,溶液中
共沉淀时,溶液中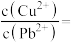
___________ (保留两位有效数字)。
(5)“除砷”时,氧化产物为 ,则
,则 (可溶于水)与
(可溶于水)与 反应的离子方程式为
反应的离子方程式为___________ 。
(6)已知:“电解” 溶液时有
溶液时有 生成。则上述流程中可循环利用的物质有
生成。则上述流程中可循环利用的物质有___________ 。
(7) 晶体中
晶体中 原子沿z轴方向在
原子沿z轴方向在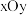 平面的投影图(即俯视图)如图,其中O原子略去,
平面的投影图(即俯视图)如图,其中O原子略去, 原子旁标注的数字表示每个
原子旁标注的数字表示每个 原子位于z轴的高度,则
原子位于z轴的高度,则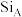 位于晶胞的
位于晶胞的___________ (填“面心”或“棱心”),晶体的密度为___________  。
。
 )用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为
)用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、
、 和
和 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图:
 具有强氧化性,“浸出液”主要含盐酸和
具有强氧化性,“浸出液”主要含盐酸和 ,还含
,还含 、
、 、
、 和
和 等杂质;
等杂质;②常温下,
 、
、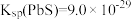 ;
;③溶液中离子浓度小于或等于
 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。回答下列问题:
(1)除将辉锑矿粉碎外,还能加快辉锑矿“酸浸”速率的措施有
(2)“滤渣1”的主要成分有
(3)“浸出液”中加入适量
 的目的是
的目的是(4)当
 、
、 共沉淀时,溶液中
共沉淀时,溶液中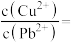
(5)“除砷”时,氧化产物为
 ,则
,则 (可溶于水)与
(可溶于水)与 反应的离子方程式为
反应的离子方程式为(6)已知:“电解”
 溶液时有
溶液时有 生成。则上述流程中可循环利用的物质有
生成。则上述流程中可循环利用的物质有(7)
 晶体中
晶体中 原子沿z轴方向在
原子沿z轴方向在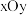 平面的投影图(即俯视图)如图,其中O原子略去,
平面的投影图(即俯视图)如图,其中O原子略去, 原子旁标注的数字表示每个
原子旁标注的数字表示每个 原子位于z轴的高度,则
原子位于z轴的高度,则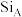 位于晶胞的
位于晶胞的 。
。
您最近半年使用:0次
名校
解题方法
3 . “建设生态文明是中华民族永续发展的千年大计。”控制和治理 、
、 是解决光化学烟雾、减少酸雨的有效途径,对构建生态文明有着极为重要的意义。回答下列问题:
是解决光化学烟雾、减少酸雨的有效途径,对构建生态文明有着极为重要的意义。回答下列问题:
(1) 的处理。
的处理。 是硝酸生产中氨催化氧化的副产物,用特种催化剂能使
是硝酸生产中氨催化氧化的副产物,用特种催化剂能使 分解。
分解。 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 的化学方程式为
的化学方程式为_______ 。
(2)NO和 的处理。已除去
的处理。已除去 的硝酸尾气可用NaOH溶液吸收,主要反应如下:
的硝酸尾气可用NaOH溶液吸收,主要反应如下:
 、
、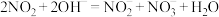
①吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是 ;吸收后排放的尾气中含量较高的氮氧化物是
;吸收后排放的尾气中含量较高的氮氧化物是_______ (填化学式)。
②Cu与适量浓硝酸反应生成0.9mol氮的氧化物(NO、 、
、 ),这些氧化物恰好能被500mL2mol⋅L-1NaOH溶液完全吸收,得到
),这些氧化物恰好能被500mL2mol⋅L-1NaOH溶液完全吸收,得到 和
和 的混合溶液,若参加反应的铜为51.2g,则生成
的混合溶液,若参加反应的铜为51.2g,则生成_______ mol 。
。
③在100mL稀 和稀
和稀 组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol·L-1.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中
组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol·L-1.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中 的物质的量浓度最大值为
的物质的量浓度最大值为_______ (反应前后溶液体积变化忽略不计)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 和
和 ,其离子方程式为
,其离子方程式为_______ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是_______ 。
(4)吸收工厂烟气中的 ,能有效减少
,能有效减少 对空气的污染。
对空气的污染。
①富氧煅烧燃煤产生的低浓度的 可以在炉内添加
可以在炉内添加 通过以下方式脱除:
通过以下方式脱除:_______ 。
②氨水吸收 。当通入
。当通入 至溶液
至溶液 左右时,主要反应的离子方程式为
左右时,主要反应的离子方程式为_______ 。
已知:溶液中 、
、 ,
, 的物质的量分数随pH的分布如图所示。
的物质的量分数随pH的分布如图所示。
 、
、 是解决光化学烟雾、减少酸雨的有效途径,对构建生态文明有着极为重要的意义。回答下列问题:
是解决光化学烟雾、减少酸雨的有效途径,对构建生态文明有着极为重要的意义。回答下列问题:(1)
 的处理。
的处理。 是硝酸生产中氨催化氧化的副产物,用特种催化剂能使
是硝酸生产中氨催化氧化的副产物,用特种催化剂能使 分解。
分解。 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 的化学方程式为
的化学方程式为(2)NO和
 的处理。已除去
的处理。已除去 的硝酸尾气可用NaOH溶液吸收,主要反应如下:
的硝酸尾气可用NaOH溶液吸收,主要反应如下: 、
、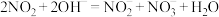
①吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是 ;吸收后排放的尾气中含量较高的氮氧化物是
;吸收后排放的尾气中含量较高的氮氧化物是②Cu与适量浓硝酸反应生成0.9mol氮的氧化物(NO、
 、
、 ),这些氧化物恰好能被500mL2mol⋅L-1NaOH溶液完全吸收,得到
),这些氧化物恰好能被500mL2mol⋅L-1NaOH溶液完全吸收,得到 和
和 的混合溶液,若参加反应的铜为51.2g,则生成
的混合溶液,若参加反应的铜为51.2g,则生成 。
。③在100mL稀
 和稀
和稀 组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol·L-1.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中
组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol·L-1.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中 的物质的量浓度最大值为
的物质的量浓度最大值为(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。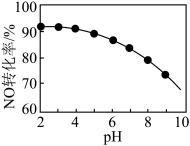
 和
和 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
(4)吸收工厂烟气中的
 ,能有效减少
,能有效减少 对空气的污染。
对空气的污染。①富氧煅烧燃煤产生的低浓度的
 可以在炉内添加
可以在炉内添加 通过以下方式脱除:
通过以下方式脱除:
②氨水吸收
 。当通入
。当通入 至溶液
至溶液 左右时,主要反应的离子方程式为
左右时,主要反应的离子方程式为已知:溶液中
 、
、 ,
, 的物质的量分数随pH的分布如图所示。
的物质的量分数随pH的分布如图所示。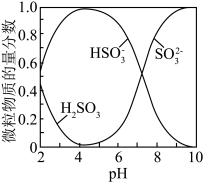
您最近半年使用:0次
名校
解题方法
4 . 水体污染物中氮元素以水溶性硝态氮(以 、
、 形式存在)和水溶性铵态氮(以
形式存在)和水溶性铵态氮(以 的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
(1)研究表明,在反硝化细菌作用下,可用乙酸(CH3COOH)处理酸性废水中的 ,产生两种对大气无污染的气体。该反应的离子方程式为
,产生两种对大气无污染的气体。该反应的离子方程式为___________ 。
(2)有人研究用纳米零价铁去除水体中 。
。
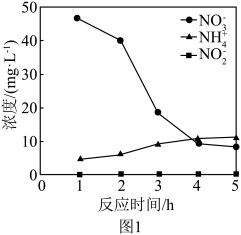
①控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其原因是
)浓度减少,其原因是___________ 。
②将一定量纳米零价铁和少量铜粉附着在生物炭上,可将 转化为
转化为 ,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是___________ ;
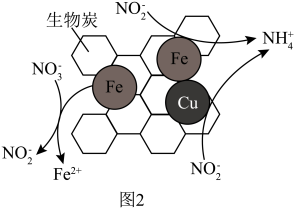
③如图2所示, 转化为
转化为 的反应机理可描述为:
的反应机理可描述为: 得到纳米零价铁失去的电子转化为
得到纳米零价铁失去的电子转化为 ,
,___________ 。
(3)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图4所示。已知 ,
, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数; 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
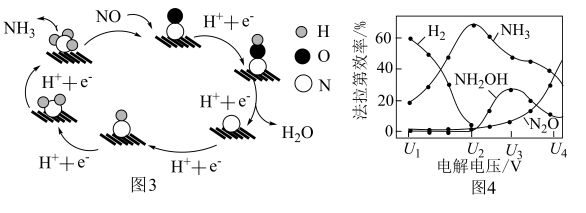
①当电解电压为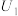 时,电解生成
时,电解生成 和
和 的物质的量之比为
的物质的量之比为___________ 。
②当电解电压为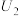 时,催化电解NO生成
时,催化电解NO生成 的电极反应式为
的电极反应式为___________ 。
 、
、 形式存在)和水溶性铵态氮(以
形式存在)和水溶性铵态氮(以 的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。(1)研究表明,在反硝化细菌作用下,可用乙酸(CH3COOH)处理酸性废水中的
 ,产生两种对大气无污染的气体。该反应的离子方程式为
,产生两种对大气无污染的气体。该反应的离子方程式为(2)有人研究用纳米零价铁去除水体中
 。
。①控制其他条件不变,用纳米零价铁还原水体中的
 ,测得溶液中
,测得溶液中 、
、 浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其原因是
)浓度减少,其原因是
②将一定量纳米零价铁和少量铜粉附着在生物炭上,可将
 转化为
转化为 ,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是
③如图2所示,
 转化为
转化为 的反应机理可描述为:
的反应机理可描述为: 得到纳米零价铁失去的电子转化为
得到纳米零价铁失去的电子转化为 ,
,(3)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图4所示。已知
 ,
, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;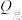 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
①当电解电压为
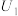 时,电解生成
时,电解生成 和
和 的物质的量之比为
的物质的量之比为②当电解电压为
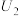 时,催化电解NO生成
时,催化电解NO生成 的电极反应式为
的电极反应式为
您最近半年使用:0次
解题方法
5 . 以下是有关铝的实验探究,请回答相关问题:
(1)用铝粉和 做铝热反应实验,需要的试剂还有___________。
做铝热反应实验,需要的试剂还有___________。
(2)镁能发生和铝类似的“镁热反应”,写出镁在高温下和 反应的化学方程式
反应的化学方程式___________ 。
(3)向集满 的铝制易拉罐中加入过量
的铝制易拉罐中加入过量 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:
浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:___________ 。
(4)用打磨过的铝片进行如下实验,下列分析不合理的是___________
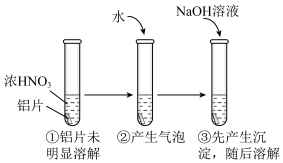
(5)某铝土矿的主要成分为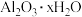 ,还含有
,还含有 和
和 杂质(已知
杂质(已知 难溶于水,且与稀硫酸及其它成分均不反应)。称取
难溶于水,且与稀硫酸及其它成分均不反应)。称取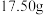 铝土矿样品,加入
铝土矿样品,加入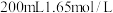 的稀硫酸,恰好完全反应,过滤得沉淀
的稀硫酸,恰好完全反应,过滤得沉淀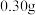 ,然后在滤液中加入足量的
,然后在滤液中加入足量的 溶液,得到沉淀
溶液,得到沉淀 。
。
①该试样中 的物质的量为
的物质的量为___________  。
。
②样品中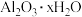 的
的
___________ 。
(1)用铝粉和
 做铝热反应实验,需要的试剂还有___________。
做铝热反应实验,需要的试剂还有___________。A. | B. | C. | D. |
(2)镁能发生和铝类似的“镁热反应”,写出镁在高温下和
 反应的化学方程式
反应的化学方程式(3)向集满
 的铝制易拉罐中加入过量
的铝制易拉罐中加入过量 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:
浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:(4)用打磨过的铝片进行如下实验,下列分析不合理的是___________

| A.①中铝片发生了钝化 |
| B.②中产生的气泡是氮氧化合物,不是氢气 |
C.③中沉淀溶解的离子方程式是 |
| D.②中加水稀释过程中,仅发生了氧化还原反应 |
(5)某铝土矿的主要成分为
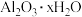 ,还含有
,还含有 和
和 杂质(已知
杂质(已知 难溶于水,且与稀硫酸及其它成分均不反应)。称取
难溶于水,且与稀硫酸及其它成分均不反应)。称取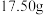 铝土矿样品,加入
铝土矿样品,加入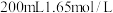 的稀硫酸,恰好完全反应,过滤得沉淀
的稀硫酸,恰好完全反应,过滤得沉淀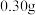 ,然后在滤液中加入足量的
,然后在滤液中加入足量的 溶液,得到沉淀
溶液,得到沉淀 。
。①该试样中
 的物质的量为
的物质的量为 。
。②样品中
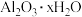 的
的
您最近半年使用:0次
6 . 工业废水中的氨氨(以NH3、 形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
(1)微生物法:(酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 作用生成N2。
作用生成N2。
① 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
② 与
与 在转化为N2的反应中消耗
在转化为N2的反应中消耗 与
与 的物质的量之比为
的物质的量之比为___________ 。
(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为N2而除去。NaClO氧化NH3的离子方程式为___________ 。
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比O3更强。

活性炭奥氧氧化氨氮的机理可描述为___________ 。
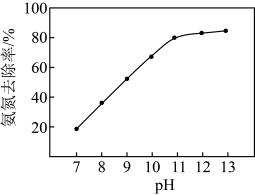
②其它条件不变调节废水的pH,废水中氨氮去除率随pH的变化如题17图-3所示。随pH增大氨氮去除率先明显增大,后变化较小,可能的原因是___________ 。
 形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。(1)微生物法:(酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 作用生成N2。
作用生成N2。①
 转化为
转化为 的离子方程式为
的离子方程式为②
 与
与 在转化为N2的反应中消耗
在转化为N2的反应中消耗 与
与 的物质的量之比为
的物质的量之比为(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为N2而除去。NaClO氧化NH3的离子方程式为
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比O3更强。

活性炭奥氧氧化氨氮的机理可描述为
②其它条件不变调节废水的pH,废水中氨氮去除率随pH的变化如题17图-3所示。随pH增大氨氮去除率先明显增大,后变化较小,可能的原因是

您最近半年使用:0次
名校
7 . 新型冠状病毒肺炎爆发以来,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液(有效成分 );②
);② (在水中一部分可以电离出阴、阳离子);③漂白粉;④
(在水中一部分可以电离出阴、阳离子);③漂白粉;④ ;⑤
;⑤ ;⑥碘酒;⑦
;⑥碘酒;⑦ 酒精;⑧过氧乙酸(
酒精;⑧过氧乙酸( );⑨高铁酸钠(
);⑨高铁酸钠( )。回答下列问题:
)。回答下列问题:
(1)上述杀菌消毒剂属于电解质的是___________ (填序号)。
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用导致游泳池藻类快速生长,池水变绿,写出该反应的化学方程式___________ 。
(3)实验室可用 溶液配制消毒液。
溶液配制消毒液。
①需要用托盘天平称量 固体的质量为
固体的质量为___________  ;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有
;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有___________ 。
②下列情况会导致所配制溶液浓度偏高的是___________ (填标号)。
a.称量时所用的砝码生锈
b.移液时,有少量液体浅出
c.定容时,俯视刻度线
(4)高铁酸钠 是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体:
是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体: 。当反应转移电子的数目是
。当反应转移电子的数目是 时,生成标准状况下
时,生成标准状况下 的体积约为
的体积约为___________ 。用 代替
代替 处理饮用水的优点是
处理饮用水的优点是___________ (只答一条即可)。
 );②
);② (在水中一部分可以电离出阴、阳离子);③漂白粉;④
(在水中一部分可以电离出阴、阳离子);③漂白粉;④ ;⑤
;⑤ ;⑥碘酒;⑦
;⑥碘酒;⑦ 酒精;⑧过氧乙酸(
酒精;⑧过氧乙酸( );⑨高铁酸钠(
);⑨高铁酸钠( )。回答下列问题:
)。回答下列问题:(1)上述杀菌消毒剂属于电解质的是
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用导致游泳池藻类快速生长,池水变绿,写出该反应的化学方程式
(3)实验室可用
 溶液配制消毒液。
溶液配制消毒液。①需要用托盘天平称量
 固体的质量为
固体的质量为 ;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有
;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有②下列情况会导致所配制溶液浓度偏高的是
a.称量时所用的砝码生锈
b.移液时,有少量液体浅出
c.定容时,俯视刻度线
(4)高铁酸钠
 是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体:
是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体: 。当反应转移电子的数目是
。当反应转移电子的数目是 时,生成标准状况下
时,生成标准状况下 的体积约为
的体积约为 代替
代替 处理饮用水的优点是
处理饮用水的优点是
您最近半年使用:0次
解题方法
8 . 硝酸镉晶体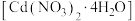 常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含
常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含 (难溶于水),含少量
(难溶于水),含少量 、
、 、
、 、
、 ]为原料制备硝酸镉晶体,制作流程如图所示。
]为原料制备硝酸镉晶体,制作流程如图所示。
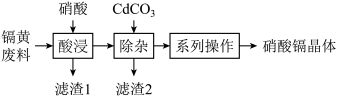
已知:①温度较高时,硝酸镉易分解;
②25℃,部分氢氧化物的 如下表所示:
如下表所示:
回答下列问题:
(1)“酸浸”时, 、
、 与一定浓度稀硝酸反应,均生成单质硫和
与一定浓度稀硝酸反应,均生成单质硫和 ,
, 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为___________ ,该反应中参加反应的硝酸中,被还原的硝酸与未被还原的硝酸的物质的量之比为___________ 。“酸浸”所得溶液中,含有的阳离子有 、
、 、
、___________ 。
(2)当溶液中离子浓度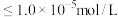 时,认为该离子已完全除去。若“除杂”所得滤液中
时,认为该离子已完全除去。若“除杂”所得滤液中 ,则
,则___________ (填“能”或“不能”)调节溶液 ,以达到除去硝酸镉溶液中的
,以达到除去硝酸镉溶液中的 的目的,原因是
的目的,原因是___________ 。
(3)硝酸镉与硝酸锌的溶解度随温度的变化关系如图。

“系列操作”依次为:
步骤i:将除杂所得滤液加热浓缩至溶液表面生成薄膜为止;
步骤ii:……
步骤iii:……
步骤iv:在低温烘干,制得硝酸镉晶体成品。
①“步骤i”加热浓缩滤液,用到的仪器有蒸发皿、铁架台(带铁圈)、玻璃棒、石棉网,还需要用到的仪器有___________ (填标号)。
a. b.
b.  c.
c. d.
d.
②“步骤ii”、“步骤iii”分别为___________ ,___________ 。
③“步骤iv”中,采用低温烘干的原因是___________ 。
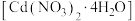 常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含
常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含 (难溶于水),含少量
(难溶于水),含少量 、
、 、
、 、
、 ]为原料制备硝酸镉晶体,制作流程如图所示。
]为原料制备硝酸镉晶体,制作流程如图所示。
已知:①温度较高时,硝酸镉易分解;
②25℃,部分氢氧化物的
 如下表所示:
如下表所示: |  |  |  | |
 |  | 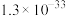 | 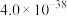 | 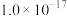 |
(1)“酸浸”时,
 、
、 与一定浓度稀硝酸反应,均生成单质硫和
与一定浓度稀硝酸反应,均生成单质硫和 ,
, 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为 、
、 、
、(2)当溶液中离子浓度
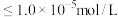 时,认为该离子已完全除去。若“除杂”所得滤液中
时,认为该离子已完全除去。若“除杂”所得滤液中 ,则
,则 ,以达到除去硝酸镉溶液中的
,以达到除去硝酸镉溶液中的 的目的,原因是
的目的,原因是(3)硝酸镉与硝酸锌的溶解度随温度的变化关系如图。

“系列操作”依次为:
步骤i:将除杂所得滤液加热浓缩至溶液表面生成薄膜为止;
步骤ii:……
步骤iii:……
步骤iv:在低温烘干,制得硝酸镉晶体成品。
①“步骤i”加热浓缩滤液,用到的仪器有蒸发皿、铁架台(带铁圈)、玻璃棒、石棉网,还需要用到的仪器有
a.
 b.
b.  c.
c. d.
d.
②“步骤ii”、“步骤iii”分别为
③“步骤iv”中,采用低温烘干的原因是
您最近半年使用:0次
解题方法
9 . 以二氧化铈(CeO2)为原料制备碳酸铈(Ce2(CO3)3)的工业流程如下:
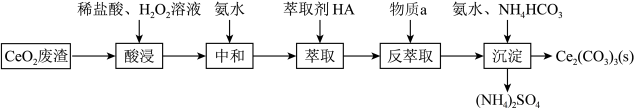
已知水溶液中的Ce3+能被有机萃取剂(HA)萃取,萃取原理可表示为 ;回答下列问题:
;回答下列问题:
(1)写出两条可以提高酸浸效率的措施___________ 、___________ 。
(2)写出酸浸过程中发生反应的离子方程式___________ ,其中H2O2的作用是___________ 。
(3)萃取前加氨水中和的目的是___________ (用平衡移动的原理解释)。
(4)写出物质a的化学式___________ 。
(5)写出沉淀过程的离子方程式___________ 。
(6)该流程中可循环使用的试剂为___________ 。

已知水溶液中的Ce3+能被有机萃取剂(HA)萃取,萃取原理可表示为
 ;回答下列问题:
;回答下列问题:(1)写出两条可以提高酸浸效率的措施
(2)写出酸浸过程中发生反应的离子方程式
(3)萃取前加氨水中和的目的是
(4)写出物质a的化学式
(5)写出沉淀过程的离子方程式
(6)该流程中可循环使用的试剂为
您最近半年使用:0次
解题方法
10 . 铅(Pb)元素的主要化合价有+2价和+4价,溶液中铅为+2价(Pb2+或 ,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
(1)Pb3O4 俗名红丹,在涂料工业中用作防锈颜料,Pb3O4中+2价铅和+4价铅的原子个数之比为
(2)Pb、PbO2可用于制造铅蓄电池,铅蓄电池工作时的反应方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,该反应中还原产物为
(3)工业上利用铅渣(主要成分是PbO、Pb,以及少量不溶于硝酸的杂质)生产PbSO4的流程如图:
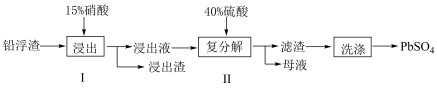
已知步骤1有NO产生,试写出Pb与硝酸反应的化学方程式
(4)血铅是指血液中铅元素的含量。血铅超标会引起机体的神经系统、血液系统、消化系统的一系列异常表现。某人血液中铅的浓度为0.4μg/mL,若转化为物质的量浓度为
您最近半年使用:0次



