1 . 实验小组制备高铁酸钾( )并探究其性质。
)并探究其性质。
资料: 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
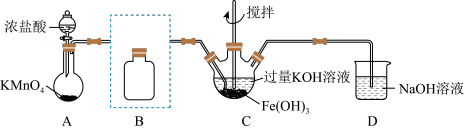
①A为氯气发生装置。A中反应离子方程式是_______
②除杂装置B的作用是:_______ 所用试剂为_______
③C中得到紫色固体和溶液。C中 发生的反应有:
发生的反应有: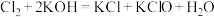 ,
, 。
。
(2)探究 的性质
的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
i.由方案Ⅰ中溶液变红可知a中含有 离子,但
离子,但 不一定是
不一定是 将
将 还原产生的,还可能由
还原产生的,还可能由_______ 产生(用离子方程式表示)。
ⅱ.方案Ⅱ可证明 氧化了
氧化了 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是_______ 。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
 )并探究其性质。
)并探究其性质。资料:
 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)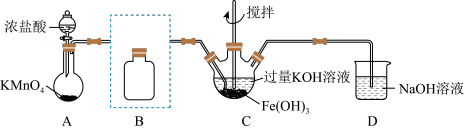
①A为氯气发生装置。A中反应离子方程式是
②除杂装置B的作用是:
③C中得到紫色固体和溶液。C中
 发生的反应有:
发生的反应有: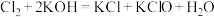 ,
, 。
。(2)探究
 的性质
的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色|溶液b,取少量b,滴加盐酸,有 溶出,得到紫色|溶液b,取少量b,滴加盐酸,有 产生。 产生。 |
 离子,但
离子,但 不一定是
不一定是 将
将 还原产生的,还可能由
还原产生的,还可能由ⅱ.方案Ⅱ可证明
 氧化了
氧化了 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
名校
解题方法
2 . 高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
 。回答下列问题:
。回答下列问题:
(1)上述反应中的
_______ ,
_______ 。
(2)写出方程式,并用单线桥表示出电子转移方向_______ 。
(3)亚硝酸钠( )是一种工业盐,某化学兴趣小组设计实验探究
)是一种工业盐,某化学兴趣小组设计实验探究 的性质。请完善表格中的实验现象和结论(已知
的性质。请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
遇淀粉变蓝)。
通过上述实验可知, 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。
 )是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
 。回答下列问题:
。回答下列问题:(1)上述反应中的


(2)写出方程式,并用单线桥表示出电子转移方向
(3)亚硝酸钠(
 )是一种工业盐,某化学兴趣小组设计实验探究
)是一种工业盐,某化学兴趣小组设计实验探究 的性质。请完善表格中的实验现象和结论(已知
的性质。请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
遇淀粉变蓝)。| 实验 | 实验操作及现象或结果 | 结论 |
| ① | 取5  溶液于试管中,加入少量 溶液于试管中,加入少量 溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 |  具有 具有 |
| ② | 取2  溶液(先酸化好)于试管中,滴加足量的 溶液(先酸化好)于试管中,滴加足量的 溶液,可观察到的实验现象为 溶液,可观察到的实验现象为 |  具有还原性 具有还原性 |
| ③ |  固体与70%硫酸反应生成了 固体与70%硫酸反应生成了 和 和 两种气体 两种气体 |  具有 具有 |
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为
您最近一年使用:0次
名校
3 . 从下列实验事实所得出的相应结论不正确的是
| 实验事实 | 结论 | |
| A | 铁与硫单质生成FeS,与Cl2生成FeCl3 | 氧化性:Cl2>S |
| B | 将CO2通入到时Na2SiO3溶液中产生白色浑浊(H2SiO3) | 酸性:H2CO3>H2SiO3 |
| C | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| D | 某无色溶液加入盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液一定有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-27更新
|
243次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学 2022-2023学年高三下学期2月月考化学试题
名校
解题方法
4 . 下面四个反应都可以生成氯气,有关说法不正确的是
①4HCl(浓)
②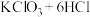 (浓)
(浓)
③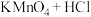 (浓)
(浓)
④
①4HCl(浓)

②
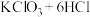 (浓)
(浓)
③
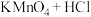 (浓)
(浓)
④

| A.四个反应中盐酸均表现还原性和酸性 |
B.反应②中,氧化产物与还原产物的质量比为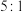 |
C.反应③的离子方程式为 |
D.根据①反应可知,物质氧化性由强到弱的顺序为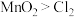 |
您最近一年使用:0次
名校
解题方法
5 . 下列实验设计能达到实验目的的是
| 实验目的 | 实验设计 | |
| A | 酸性条件下,氧化性:H2O2>Fe3+ | 向 溶液中滴加用硫酸化的 溶液中滴加用硫酸化的 溶液,溶液变黄色 溶液,溶液变黄色 |
| B | 干燥的氯气没有漂白性 | 将一片鲜花花瓣放入盛有干燥氯气的集气瓶中 |
| C | 酸性:CH3COOH>HClO | 用pH试纸分别测定同浓度的CH3COOH溶液和HClO溶液的pH |
| D | 还原性:Fe2+>Br- | 将少量的氯水滴入FeBr2溶液中,再滴加CCl4振荡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-02更新
|
149次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学2023-2024学年高三上学期1月月考化学试题
6 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)“维生素C可以将食物中的 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有_____ (填“氧化性”或“还原性”)。
(2) 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下:
_____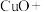 _____
_____
 _____
_____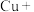 _____
_____ _____
_____ _____
_____
①配平上述氧化还原反应_____ 。
②该反应中,氧化剂是_____ (填化学式),被氧化的元素是_____ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为
的反应为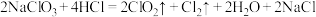
①该反应中的还原产物是_____ (写化学式),反应中每生成1个 分子,转移电子的数目为
分子,转移电子的数目为_____ 。
②用双线桥标出反应中电子转移的方向和数目_____ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是_____ (填序号)
A. B.
B. C.KI D.
C.KI D.
(4)双氧水是公认的绿色氧化剂。已知氧化性强弱顺序为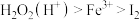 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为_____ 。
(1)“维生素C可以将食物中的
 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有(2)
 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下:_____
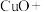 _____
_____
 _____
_____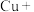 _____
_____ _____
_____ _____
_____
①配平上述氧化还原反应
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为
的反应为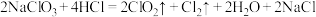
①该反应中的还原产物是
 分子,转移电子的数目为
分子,转移电子的数目为②用双线桥标出反应中电子转移的方向和数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是A.
 B.
B. C.KI D.
C.KI D.
(4)双氧水是公认的绿色氧化剂。已知氧化性强弱顺序为
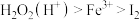 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
您最近一年使用:0次
2023-07-05更新
|
445次组卷
|
2卷引用:新疆石河子第一中学2023-2024学年高一上学期9月月考化学试题
7 . 常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br﹣②2Br﹣+Cl2=Br2+2Cl﹣③2Fe3++2I﹣=2Fe2++I2,由此判断下列说法正确的是
| A.铁元素在反应①中被还原,在③中被氧化 |
| B.反应②中当有1 个Cl2分子被氧化时,有2 个Br-被还原 |
| C.氧化性强弱顺序为Cl2>I2>Br2>Fe3+ |
| D.还原性强弱顺序为I->Fe2+>Br->Cl- |
您最近一年使用:0次
2022-10-19更新
|
293次组卷
|
3卷引用:新疆昌吉市教育共同体2022-2023学年高一上学期第一次月考化学试题
名校
解题方法
8 . 常温下,在溶液中可发生以下反应:
①2Fe2++Br2=2Fe3++2Br- ②2Br-+Cl2=Br2+2Cl- ③2Fe3++2I-=2Fe2++I2;
由此判断下列说法错误的是
①2Fe2++Br2=2Fe3++2Br- ②2Br-+Cl2=Br2+2Cl- ③2Fe3++2I-=2Fe2++I2;
由此判断下列说法错误的是
| A.铁元素在反应①和③中均被氧化 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2>Br2>Fe3+>I2 |
| D.还原性强弱顺序为:I->Fe2+>Br->Cl- |
您最近一年使用:0次
2021-12-03更新
|
620次组卷
|
24卷引用:新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一上学期第二次月考化学试题
新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一上学期第二次月考化学试题2014-2015吉林省长春外国语高一上第二次月考化学试卷2016届吉林省汪清县第六中学高三9月月考化学试卷吉林省延边朝鲜族自治州汪清县第四中学2019-2020学年高一上学期第二次阶段考试化学试题黑龙江省大庆十中2019-2020学年高一上学期第二次月考化学试题(已下线)【浙江新东方】27(已下线)【浙江新东方】HZOMO化学003天津市第八中学2020-2021学年高一上学期第三次统练化学试题宁夏回族自治区银川市六盘山市高级中学2020-2021学年高一上学期第二次月考化学试题新疆哈密市第八中学2020-2021学年高一上学期期末考试化学试题四川省绵阳东辰国际学校2021-2022学年高一上学期第二次月考(10月)化学试题河北省邯郸市大名县第一中学2021-2022学年高一上学期第二次月考化学试题2014-2015黑龙江省双鸭山市一中高一上期末化学试卷高中化学人教版 必修1 第二章 化学物质及其变化 3.氧化还原反应 氧化剂和还原剂【全国市级联考】福建省福州市八县市协作校2017-2018学年高一上学期期末联考化学试题成都龙泉第二中学2019-2020学年高二上学期入学考试化学试题甘肃省会宁县第一中学2019-2020学年高一上学期期中考试化学试题广西柳州市柳江中学2019-2020学年高一上学期期中考试化学试题贵州省黔南布依族苗族自治州瓮安第二中学2019-2020学年高一上学期期末考试化学试题安徽省肥东县第二中学2019-2020学年高一下学期期中考试(共建班)化学试题陕西省西安中学2021届高三上学期期中考试化学试题湖南省长沙市广益中学2020-2021学年高一上学期期中考试化学试题第三节 氧化还原反应 第2课时 氧化剂和还原剂青海省西宁市海湖中学2021-2022学年高三上学期期中考试化学试题
名校
解题方法
9 . 常温下,在溶液中能发生如下反应:
①2A2++B2=2A3++2B﹣;
②2B﹣+Z2=B2+2Z﹣;
③16H++10Z﹣+2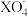 =2X2++5Z2+8H2O,
=2X2++5Z2+8H2O,
由此判断下列说法错误的是
①2A2++B2=2A3++2B﹣;
②2B﹣+Z2=B2+2Z﹣;
③16H++10Z﹣+2
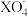 =2X2++5Z2+8H2O,
=2X2++5Z2+8H2O,由此判断下列说法错误的是
A.氧化性强到弱顺序是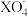 、Z2、B2、A3+ 、Z2、B2、A3+ | B.还原性强到弱顺序是A2+、B﹣、Z﹣、X2+ |
| C.Z2+2A2+=2A3++2Z﹣反应可以进行 | D.Z元素在②③反应中均被还原 |
您最近一年使用:0次
2020-11-12更新
|
425次组卷
|
12卷引用:新疆生产建设兵团第一师高级中学2022-2023学年高一上学期第一次月考化学试题
新疆生产建设兵团第一师高级中学2022-2023学年高一上学期第一次月考化学试题山西省晋中市祁县中学校2019-2020学年高一12月月考化学试题辽宁省大连市一〇三中学2020-2021学年高一10月月考化学试题广东省东莞市第二高级中学2020-2021学年高一上学期第一次月考化学试题山东省嘉祥县第一中学2020-2021学年高一上学期10月月考化学试题江西省靖安中学2020-2021学年高一上学期第二次月考化学试题浙江省瓯海中学2022-2023学年高一上学期10月月考化学试题山东省济宁邹城市第二中学2023-2024学年高一上学期10月月考化学试题黑龙江省肇东市第四中学校2020-2021学年高一上学期期中考试化学试题北京市第一五六中学2020—2021学年高一上学期期中测试化学试题湖北省鄂州市2020-2021学年高一上学期期末质量监测化学试题(已下线)易错专题08 氧化还原反应规律的应用及相关计算-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)
10 . 已知常温下,在溶液中发生如下反应:
①16H+ + 10Z-+ 2XO = 2X2+ + 5Z2 + 8H2O
= 2X2+ + 5Z2 + 8H2O
②2A2+ + B2 = 2A3++ 2B-;
③2B-+ Z2 = B2 + 2Z-。由此推断下列说法正确的是
①16H+ + 10Z-+ 2XO
 = 2X2+ + 5Z2 + 8H2O
= 2X2+ + 5Z2 + 8H2O②2A2+ + B2 = 2A3++ 2B-;
③2B-+ Z2 = B2 + 2Z-。由此推断下列说法正确的是
| A.Z元素在①、③反应中均被还原 |
| B.反应Z2 + 2A2+ = 2A3+ + 2Z- 可以进行 |
C.氧化性由强到弱的顺序是:XO 、Z2、A3+、B2 、Z2、A3+、B2 |
| D.还原性由强到弱的顺序是:Z-、B-、A2+、X2+ |
您最近一年使用:0次
2020-11-22更新
|
318次组卷
|
9卷引用:新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年上学期高三第一次月考化学试题
新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年上学期高三第一次月考化学试题湖南省邵阳市第二中学2021-2022学年高一上学期第一次月考化学试题新疆生产建设兵团第十师北屯高级中学2021-2022学年高一上学期期中考试化学试题云南省丽江润泽高级中学2023-2024学年高一上学期11月月考化学试题广东省珠海市第二中学2019-2020学年高一上学期期中考试化学试题(已下线)1.3.3 氧化还原反应的规律及应用-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)湖南常德市桃花源风景名胜区第一中学2020-2021学年高一上学期期中考试化学试题江西省吉安市永丰县永丰中学2021届高三上学期期中考试化学试题(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练



