1 . 五氯化锑 主要用作氟化工的催化剂,纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应
主要用作氟化工的催化剂,纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应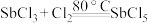 ,利用如下装置制备
,利用如下装置制备 (加热及夹持装置略)。
(加热及夹持装置略)。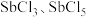 的部分性质如下:
的部分性质如下:
实验室制备 的步骤如下:
的步骤如下:
(i)连接好仪器,检验装置气密性,加入药品;
(ii)……,控制三颈烧瓶反应温度在 ,通入
,通入 至反应结束,通入
至反应结束,通入 排净装置中
排净装置中 ;
;
(iii)在b处连接减压装置,……,打开减压装置,三颈烧瓶中液体流入双颈烧瓶,……,减压蒸馏,收集目标物质。
(1)步骤(ii)反应温度控制在 的主要目的是
的主要目的是_______ 。
(2)步骤(iii)打开减压装置前的操作是_______ ,用减压蒸馏而不用常压蒸馏的主要原因是_______ 。
(3)减压蒸馏时若控制压强为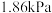 ,温度计的读数应为
,温度计的读数应为_______ ℃,减压蒸馏时玻璃毛细管的作用是_______ 。
(4)该实验装置存在一处明显的设计缺陷,该缺陷是_______ 。
(5)氟锑酸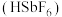 是一种超强酸,可由
是一种超强酸,可由 与
与 反应制得,反应的化学方程式是
反应制得,反应的化学方程式是_______ ,制备时,应选用_______ 材质的仪器(填标号)。
A.玻璃 B.陶瓷 C.铁或铝 D.聚四氟乙烯
 主要用作氟化工的催化剂,纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应
主要用作氟化工的催化剂,纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应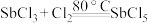 ,利用如下装置制备
,利用如下装置制备 (加热及夹持装置略)。
(加热及夹持装置略)。
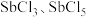 的部分性质如下:
的部分性质如下:| 物质 | 熔点/℃ | 沸点/℃ | 性质 |
 | 73.4 |  | 均极易水解 |
 | 2.8 |  | |
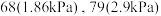 |
 的步骤如下:
的步骤如下:(i)连接好仪器,检验装置气密性,加入药品;
(ii)……,控制三颈烧瓶反应温度在
 ,通入
,通入 至反应结束,通入
至反应结束,通入 排净装置中
排净装置中 ;
;(iii)在b处连接减压装置,……,打开减压装置,三颈烧瓶中液体流入双颈烧瓶,……,减压蒸馏,收集目标物质。
(1)步骤(ii)反应温度控制在
 的主要目的是
的主要目的是(2)步骤(iii)打开减压装置前的操作是
(3)减压蒸馏时若控制压强为
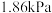 ,温度计的读数应为
,温度计的读数应为(4)该实验装置存在一处明显的设计缺陷,该缺陷是
(5)氟锑酸
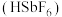 是一种超强酸,可由
是一种超强酸,可由 与
与 反应制得,反应的化学方程式是
反应制得,反应的化学方程式是A.玻璃 B.陶瓷 C.铁或铝 D.聚四氟乙烯
您最近一年使用:0次
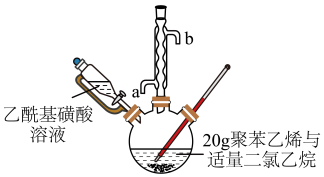
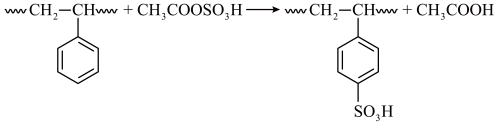
2 . 磺化聚苯乙烯可用于制作高性能离子交换膜。某研究小组探究乙酰基磺酸 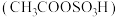 制备磺化聚苯乙烯的过程与效果。
制备磺化聚苯乙烯的过程与效果。
 .乙酰基磺酸的制备
.乙酰基磺酸的制备
向装有一定量二氯乙烷溶剂的烧杯中,加入 7.6 mL 乙酸酐 ,控制溶液温度在10℃以下,边搅拌边分批加入2.7 mL浓硫酸,得到乙酰基磺酸溶液。
,控制溶液温度在10℃以下,边搅拌边分批加入2.7 mL浓硫酸,得到乙酰基磺酸溶液。
(1)制备过程中需使用的玻璃仪器有烧杯、温度计、___________ 。
(2)控制溶液温度在10℃以下的目的是___________ 。
(3)乙酸酐与浓硫酸按物质的量之比1:1反应的化学方程式为___________ 。
 .聚苯乙烯的磺化
.聚苯乙烯的磺化
按如图装置(夹持设备略去),控制反应温度为65 ℃,缓慢滴加乙酰基磺酸溶液,得到浅棕色液体。将所得浅棕色液体慢慢滴入装有沸水的烧杯中,得到淡黄色的磺化聚苯乙烯颗粒,过滤、洗涤、干燥。___________ 进行加热。冷却水应从___________ (填“a” 或“b” ) 口通入。
(5)产品是否洗涤干净,可通过检测洗涤液中是否存在 来判断,检测的方法是
来判断,检测的方法是___________ 。
 .磺化度的测定
.磺化度的测定
称取0.500g干燥的磺化聚苯乙烯样品于锥形瓶,用苯-甲醇混合液溶解,以酚酞为指示剂,用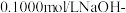 甲醇标准溶液滴定至终点,消耗标准液体积为10.00 mL, 计算磺化度。
甲醇标准溶液滴定至终点,消耗标准液体积为10.00 mL, 计算磺化度。
已知:i.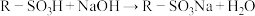 。
。
ii.聚苯乙烯链节的式量为104,磺化聚苯乙烯中含磺酸基链节的式量为184。
(6)该样品的磺化度=___________ (磺化度=含磺酸基链节数×100%)。
(7)若样品未充分干燥,将导致测得的磺化度___________ (填“偏高”“偏低”或“无影响”)。
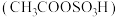 制备磺化聚苯乙烯的过程与效果。
制备磺化聚苯乙烯的过程与效果。 .乙酰基磺酸的制备
.乙酰基磺酸的制备向装有一定量二氯乙烷溶剂的烧杯中,加入 7.6 mL 乙酸酐
 ,控制溶液温度在10℃以下,边搅拌边分批加入2.7 mL浓硫酸,得到乙酰基磺酸溶液。
,控制溶液温度在10℃以下,边搅拌边分批加入2.7 mL浓硫酸,得到乙酰基磺酸溶液。(1)制备过程中需使用的玻璃仪器有烧杯、温度计、
(2)控制溶液温度在10℃以下的目的是
(3)乙酸酐与浓硫酸按物质的量之比1:1反应的化学方程式为
 .聚苯乙烯的磺化
.聚苯乙烯的磺化按如图装置(夹持设备略去),控制反应温度为65 ℃,缓慢滴加乙酰基磺酸溶液,得到浅棕色液体。将所得浅棕色液体慢慢滴入装有沸水的烧杯中,得到淡黄色的磺化聚苯乙烯颗粒,过滤、洗涤、干燥。
(5)产品是否洗涤干净,可通过检测洗涤液中是否存在
 来判断,检测的方法是
来判断,检测的方法是 .磺化度的测定
.磺化度的测定称取0.500g干燥的磺化聚苯乙烯样品于锥形瓶,用苯-甲醇混合液溶解,以酚酞为指示剂,用
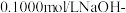 甲醇标准溶液滴定至终点,消耗标准液体积为10.00 mL, 计算磺化度。
甲醇标准溶液滴定至终点,消耗标准液体积为10.00 mL, 计算磺化度。已知:i.
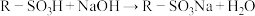 。
。ii.聚苯乙烯链节的式量为104,磺化聚苯乙烯中含磺酸基链节的式量为184。
(6)该样品的磺化度=
(7)若样品未充分干燥,将导致测得的磺化度
您最近一年使用:0次
3 . 焦亚硫酸钠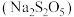 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
Ⅰ.焦亚硫酸钠的制备
实验室制备少量 的装置如图所示。
的装置如图所示。 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、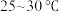 干燥,可获得
干燥,可获得 固体。
固体。
(1)装置Y的作用是___________ 。
(2)控制反应温度在 左右的原因是
左右的原因是___________ 。
(3)因为 具有
具有___________ 性,所以产品 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是___________ 。
(4)工业上亦可用 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:___________ 。
Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数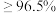 。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为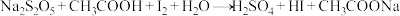 (未配平),
(未配平), 。
。
准确称取 样品,快速置于预先加入
样品,快速置于预先加入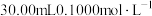 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。
(5)滴定终点的现象是___________ 。
(6)该样品中焦亚硫酸钠的质量分数为___________ %,___________ (填“是”或“不是”)优质品。
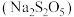 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:Ⅰ.焦亚硫酸钠的制备
实验室制备少量
 的装置如图所示。
的装置如图所示。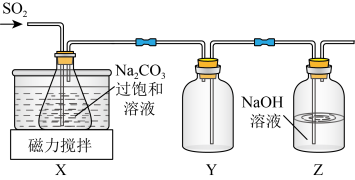
 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、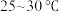 干燥,可获得
干燥,可获得 固体。
固体。(1)装置Y的作用是
(2)控制反应温度在
 左右的原因是
左右的原因是(3)因为
 具有
具有 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是(4)工业上亦可用
 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数
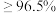 。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为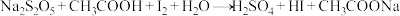 (未配平),
(未配平), 。
。准确称取
 样品,快速置于预先加入
样品,快速置于预先加入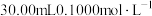 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。(5)滴定终点的现象是
(6)该样品中焦亚硫酸钠的质量分数为
您最近一年使用:0次
名校
4 . 实验是化学的基本方法,它的学习功能是难以代替的,下列实验能达到实验目的的是
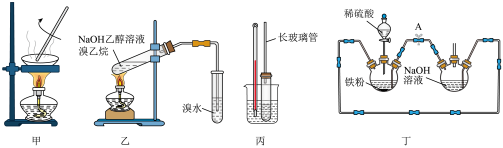
A.用装置甲蒸发 溶液制备少量硫酸镁晶体 溶液制备少量硫酸镁晶体 | B.装置乙中溴水逐渐褪色,能说明生成乙烯 |
| C.装置丙测定苯甲酸在一定温度下的溶解度 | D.装置丁制备少量氢氧化亚铁,并观察其颜色 |
您最近一年使用:0次
名校
5 . 焦亚硫酸钠 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
I.焦亚硫酸钠的制备
实验室制备少量 的装置如图所示。
的装置如图所示。 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 ,
, 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、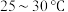 干燥,可获得
干燥,可获得 固体。
固体。
(1) 的VSEPR模型名称为
的VSEPR模型名称为__________ 。
(2)控制反应温度在 左右的原因是
左右的原因是_____________ 。
(3)装置 的作用是
的作用是__________ 。
(4)工业上亦可用 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:_______________ 。
(5)因为 具有
具有_________ 性,所以产品 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是_____________ 。
Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数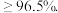 通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为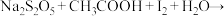
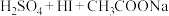 (未配平),
(未配平), 。
。
准确称取 样品,快速置于预先加入
样品,快速置于预先加入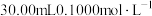 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。
(6)滴定终点的现象是_____________ 。
(7)该样品中焦亚硫酸钠的质量分数为__________  ,
,__________ (填“是”或“不是”)优质品。
 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:I.焦亚硫酸钠的制备
实验室制备少量
 的装置如图所示。
的装置如图所示。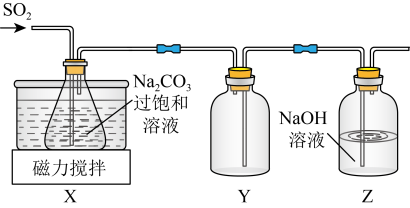
 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 ,
, 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、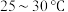 干燥,可获得
干燥,可获得 固体。
固体。(1)
 的VSEPR模型名称为
的VSEPR模型名称为(2)控制反应温度在
 左右的原因是
左右的原因是(3)装置
 的作用是
的作用是(4)工业上亦可用
 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:(5)因为
 具有
具有 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数
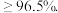 通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为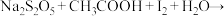
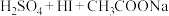 (未配平),
(未配平), 。
。准确称取
 样品,快速置于预先加入
样品,快速置于预先加入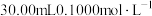 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。(6)滴定终点的现象是
(7)该样品中焦亚硫酸钠的质量分数为
 ,
,
您最近一年使用:0次
7日内更新
|
125次组卷
|
2卷引用:河北省保定市九校2024届高三下学期二模化学试题
6 . 富马酸亚铁[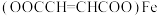 ]又称富马铁,是一种安全、高效的有机营养补铁剂,可由富马酸(
]又称富马铁,是一种安全、高效的有机营养补铁剂,可由富马酸( )与硫酸亚铁制取,其制备装置(夹持装置略)如图所示。
)与硫酸亚铁制取,其制备装置(夹持装置略)如图所示。
②柠檬酸易溶于水和乙醇,酸性较强,具有强还原性。
③富马酸亚铁易溶于水,性质稳定,难溶于无水乙醇。
实验步骤如下:
Ⅰ.打开活塞 、
、 ,关闭
,关闭 ,向d中通入气体,待d中空气被排尽后,将b中溶液压入d中。
,向d中通入气体,待d中空气被排尽后,将b中溶液压入d中。
Ⅱ.在50℃恒温条件下用电磁搅拌器不断搅拌,然后向d中滴加 溶液,调节溶液
溶液,调节溶液 ,使反应物充分反应。
,使反应物充分反应。
Ⅲ.反应完成后,向d中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器a的名称是_______ ,相对于c,仪器a的优点是_______ 。
(2)步骤Ⅰ中将b中溶液压入d中的操作是_______ 。
(3)反应混合液中加入柠檬酸的作用是_______ 。
(4)写出步骤Ⅱ中生成富马酸亚铁的化学方程式:_______ 。
(5)步骤Ⅲ中加入无水乙醇的作用是_______ ,沉淀洗涤时用_______ 作洗涤剂。
(6)若富马酸的投料量为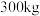 ,产出纯品
,产出纯品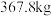 ,则富马酸亚铁的产率为
,则富马酸亚铁的产率为_______ (保留两位有效数字)。
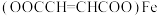 ]又称富马铁,是一种安全、高效的有机营养补铁剂,可由富马酸(
]又称富马铁,是一种安全、高效的有机营养补铁剂,可由富马酸( )与硫酸亚铁制取,其制备装置(夹持装置略)如图所示。
)与硫酸亚铁制取,其制备装置(夹持装置略)如图所示。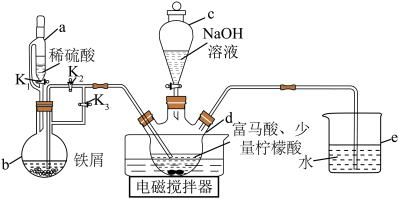
②柠檬酸易溶于水和乙醇,酸性较强,具有强还原性。
③富马酸亚铁易溶于水,性质稳定,难溶于无水乙醇。
实验步骤如下:
Ⅰ.打开活塞
 、
、 ,关闭
,关闭 ,向d中通入气体,待d中空气被排尽后,将b中溶液压入d中。
,向d中通入气体,待d中空气被排尽后,将b中溶液压入d中。Ⅱ.在50℃恒温条件下用电磁搅拌器不断搅拌,然后向d中滴加
 溶液,调节溶液
溶液,调节溶液 ,使反应物充分反应。
,使反应物充分反应。Ⅲ.反应完成后,向d中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器a的名称是
(2)步骤Ⅰ中将b中溶液压入d中的操作是
(3)反应混合液中加入柠檬酸的作用是
(4)写出步骤Ⅱ中生成富马酸亚铁的化学方程式:
(5)步骤Ⅲ中加入无水乙醇的作用是
(6)若富马酸的投料量为
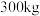 ,产出纯品
,产出纯品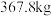 ,则富马酸亚铁的产率为
,则富马酸亚铁的产率为
您最近一年使用:0次
7 . 为解决铜与稀硝酸反应过程中装置内氧气对实验现象的干扰,以及实验后装置内氮氧化物的绿色化处理问题。某实验小组对装置进行微型化改造,设计如图所示的装置(试管底部有孔隙)。下列说法错误的是

A.装置内发生的化学反应方程式为: |
| B.实验开始前需除去试管内的氧气,可拉动注射器B |
| C.该装置可通过控制止水夹和注射器来控制反应的开始与停止 |
| D.实验终止时,需将铜丝提拉上来后再拉动注射器A |
您最近一年使用:0次
8 . 利用席夫碱L(结构简式为 ,相对分子质量为416)制备金属缓蚀剂
,相对分子质量为416)制备金属缓蚀剂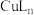 ,并测定n值。
,并测定n值。
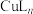
向烧瓶中加入席夫碱L和
 (沸点为39.8℃),置于35℃恒温水浴(如图所示)。滴加
(沸点为39.8℃),置于35℃恒温水浴(如图所示)。滴加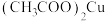 溶液,回流1h。反应结束后将烧瓶置于冰水浴中冷却,过滤、洗涤、干燥,得到固体
溶液,回流1h。反应结束后将烧瓶置于冰水浴中冷却,过滤、洗涤、干燥,得到固体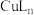 。
。
(2)洗涤所用最佳试剂为_______(填标号)。
| A.去离子水 | B.无水乙醇 | C.NaOH溶液 | D. 溶液 溶液 |
Ⅱ.测定n值
称取0.478g
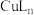 焙烧,将焙烧产物用稀
焙烧,将焙烧产物用稀 充分溶解,滴加NaOH溶液调pH为3~4,加入过量浓KI溶液,用
充分溶解,滴加NaOH溶液调pH为3~4,加入过量浓KI溶液,用 标准溶液滴定至浅黄色,加入淀粉溶液,继续滴定至浅蓝色,再加入KSCN溶液滴定至终点,共消耗
标准溶液滴定至浅黄色,加入淀粉溶液,继续滴定至浅蓝色,再加入KSCN溶液滴定至终点,共消耗 标准溶液20.00mL。
标准溶液20.00mL。已知:ⅰ.
 (棕黄色);
(棕黄色); ;
; 能吸附
能吸附 。
。ⅱ.25℃时,
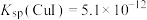 ,
,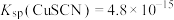 。
。(3)滴加NaOH溶液调pH为3~4,若pH过高,则测定结果
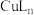 释放出的
释放出的 与
与 反应的离子方程式为
反应的离子方程式为(4)加入KSCN溶液的目的是
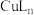 中
中
您最近一年使用:0次
9 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
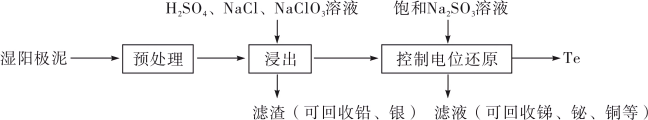
(1)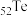 的基态原子的电子排布式为
的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是___________ ;氧化后的原料还需粉碎、过筛,目的是___________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式___________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成___________ (填化学式)。
(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为___________ 。若Te的原子半径为rpm,碲化锌晶胞中面心与顶点的碲原子相切,晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  (列出计算式)。
(列出计算式)。
| 物质 | 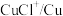 | 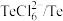 | 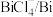 | 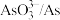 | 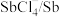 |
| 氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)
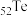 的基态原子的电子排布式为
的基态原子的电子排布式为(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为
 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出计算式)。
(列出计算式)。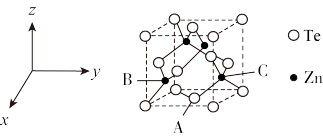
您最近一年使用:0次
名校
10 . 某小组设计实验制备三苯甲醇并探究其性质,反应原理如下: )。
)。
步骤2:先将三分之一的混合液滴入三颈烧瓶中,数分钟后即见镁屑表面有气泡产生,溶液轻微浑浊,碘的颜色开始消失。若不发生反应,可用水浴温热或再加入一小粒碘。反应开始后开动搅拌磁子,缓缓滴入其余的溴苯醚溶液,滴加速度保持溶液呈微沸状态。加毕,水浴继续回流半小时,使镁屑几乎完全反应。
步骤3:将已制好的苯基溴化镁置于冷水浴中,在搅拌下由滴液漏斗滴加1.9mL苯甲酸乙酯和7mL无水乙醚的混合液,控制滴加速度保持反应平稳地进行。滴毕,将混合物在水浴上回流半小时,这时混合物分层,用冰水浴冷却,在搅拌下由滴液漏斗慢慢滴加由 配成的饱和水溶液(15mL)。
配成的饱和水溶液(15mL)。
步骤4:先蒸馏,再将残留物进行水蒸气蒸馏(如图2),瓶中剩余物冷却后凝为固体,抽滤,用80%的乙醇进行重结晶、干燥后称量白色产品为2.0g。
(1)仪器A是__________ (填名称);图2装置中导管1的作用是__________ 。
(2)步骤1中碘的作用是__________ 。
(3)步骤2中不能一次性加入溴苯陡溶液或滴加过快,其原因是__________ 。
(4)步骤3中可能会有 生成,写出
生成,写出 与其反应的离子方程式:
与其反应的离子方程式:__________ 。若苯甲酸乙酯和乙醚中含有乙醇,对实验影响的是__________ 。
(5)探究“三苯甲基碳正离子”的性质。在一洁净的干燥试管中,加入少许三苯甲醇(约0.02g)及2mL冰醋酸,温热使其溶解,向试管中滴加2~3滴浓硫酸,立即生成橙红色溶液,然后加入2mL水,颜色消失,并有白色沉淀生成。写出生成“橙红色溶液”的离子方程式:__________ 。

 )。
)。步骤2:先将三分之一的混合液滴入三颈烧瓶中,数分钟后即见镁屑表面有气泡产生,溶液轻微浑浊,碘的颜色开始消失。若不发生反应,可用水浴温热或再加入一小粒碘。反应开始后开动搅拌磁子,缓缓滴入其余的溴苯醚溶液,滴加速度保持溶液呈微沸状态。加毕,水浴继续回流半小时,使镁屑几乎完全反应。
步骤3:将已制好的苯基溴化镁置于冷水浴中,在搅拌下由滴液漏斗滴加1.9mL苯甲酸乙酯和7mL无水乙醚的混合液,控制滴加速度保持反应平稳地进行。滴毕,将混合物在水浴上回流半小时,这时混合物分层,用冰水浴冷却,在搅拌下由滴液漏斗慢慢滴加由
 配成的饱和水溶液(15mL)。
配成的饱和水溶液(15mL)。步骤4:先蒸馏,再将残留物进行水蒸气蒸馏(如图2),瓶中剩余物冷却后凝为固体,抽滤,用80%的乙醇进行重结晶、干燥后称量白色产品为2.0g。

已知:①反应前后, 质量和化学性质保持不变;溴苯和镁的反应是放热反应;②苯基溴化镁易MgBr与水、醇等含活泼氢的物质反应;例如:
质量和化学性质保持不变;溴苯和镁的反应是放热反应;②苯基溴化镁易MgBr与水、醇等含活泼氢的物质反应;例如: ;③三苯甲醇(
;③三苯甲醇( )与冰醋酸在浓硫酸催化下易生成橙红色的三苯甲基碳正离子(
)与冰醋酸在浓硫酸催化下易生成橙红色的三苯甲基碳正离子( )。
)。
(1)仪器A是
(2)步骤1中碘的作用是
(3)步骤2中不能一次性加入溴苯陡溶液或滴加过快,其原因是
(4)步骤3中可能会有
 生成,写出
生成,写出 与其反应的离子方程式:
与其反应的离子方程式:(5)探究“三苯甲基碳正离子”的性质。在一洁净的干燥试管中,加入少许三苯甲醇(约0.02g)及2mL冰醋酸,温热使其溶解,向试管中滴加2~3滴浓硫酸,立即生成橙红色溶液,然后加入2mL水,颜色消失,并有白色沉淀生成。写出生成“橙红色溶液”的离子方程式:
您最近一年使用:0次
2024-05-11更新
|
122次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷



