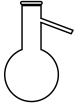
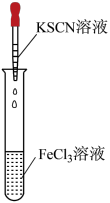1 . 关于下列仪器使用的说法正确的是
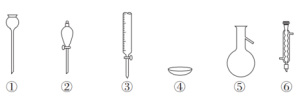
| A.仪器①、②可用于物质分离 |
| B.仪器②、③使用时需要检查是否漏水 |
| C.仪器④、⑤可用酒精灯直接加热 |
| D.仪器③、⑥使用前需要烘干 |
您最近半年使用:0次
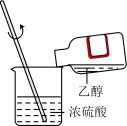
2 . 中华传统文化源远流长。下图是传统酿酒工艺的装置。

|
|
| A.直形冷凝管 | B.蒸馏烧瓶 |
|
|
| C.分液漏斗 | D.锥形瓶 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
3 . 实验安全至关重要,下列做法错误 的是
A.金属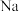 着火时,可用潮湿的沙土灭火 着火时,可用潮湿的沙土灭火 |
| B.闻气体时用手轻轻扇动,使少量的气体飘进鼻孔 |
| C.电器起火,先切断电源,再用二氧化碳灭火器灭火 |
| D.蒸馏操作过程中,若发现忘加沸石,应立即停止加热,待烧瓶冷却后再加入沸石 |
您最近半年使用:0次
名校
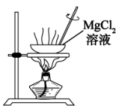
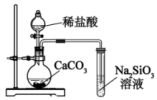
4 . 下列操作规范且能达到实验目的的是
|
|
| A.检验装置气密性 | B.测定醋酸浓度 |
|
|
| C.制取无水氯化镁 | D.比较碳酸和硅酸的酸性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
5 . 下列试剂的实验室保存方法正确的是
| A.水玻璃保存在玻璃塞磨口瓶中 | B.无水硫酸铜固体保存在干燥器中 |
| C.HF溶液保存在细口玻璃瓶中 | D.AgNO3溶液保存在无色试剂瓶中 |
您最近半年使用:0次
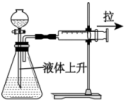
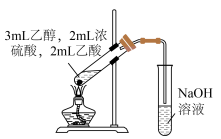
6 . 为达到下列实验目的,其实验操作正确的是
| 实验目的 | A.验证温度对水解平衡的影响 | B.检查装置的气密性 |
| 实验操作 |
|
|
| 实验目的 | C.混合浓硫酸和乙醇 | D.检验溶液的 |
| 实验操作 |
|
|
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
7日内更新
|
47次组卷
|
2卷引用:天津市河北区2023-2024学年高三下学期二模化学试卷
名校
7 . 焦亚硫酸钠 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
I.焦亚硫酸钠的制备
实验室制备少量 的装置如图所示。
的装置如图所示。 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 ,
, 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、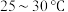 干燥,可获得
干燥,可获得 固体。
固体。
(1) 的VSEPR模型名称为
的VSEPR模型名称为__________ 。
(2)控制反应温度在 左右的原因是
左右的原因是_____________ 。
(3)装置 的作用是
的作用是__________ 。
(4)工业上亦可用 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:_______________ 。
(5)因为 具有
具有_________ 性,所以产品 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是_____________ 。
Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数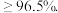 通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为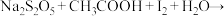
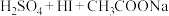 (未配平),
(未配平), 。
。
准确称取 样品,快速置于预先加入
样品,快速置于预先加入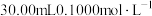 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。
(6)滴定终点的现象是_____________ 。
(7)该样品中焦亚硫酸钠的质量分数为__________  ,
,__________ (填“是”或“不是”)优质品。
 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:I.焦亚硫酸钠的制备
实验室制备少量
 的装置如图所示。
的装置如图所示。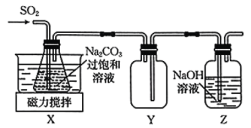
 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 ,
, 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、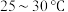 干燥,可获得
干燥,可获得 固体。
固体。(1)
 的VSEPR模型名称为
的VSEPR模型名称为(2)控制反应温度在
 左右的原因是
左右的原因是(3)装置
 的作用是
的作用是(4)工业上亦可用
 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:(5)因为
 具有
具有 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数
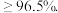 通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为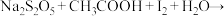
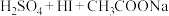 (未配平),
(未配平), 。
。准确称取
 样品,快速置于预先加入
样品,快速置于预先加入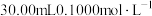 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。(6)滴定终点的现象是
(7)该样品中焦亚硫酸钠的质量分数为
 ,
,
您最近半年使用:0次
7日内更新
|
52次组卷
|
2卷引用:河北省保定市九校2024届高三下学期二模化学试题
名校
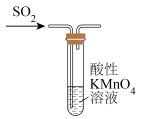
8 . 下列实验操作正确的是
|
|
| A.验证SO2具有漂白性 | B.配制 NaOH溶液 NaOH溶液 |
|
|
| C.苯萃取碘水中I2放出下层液体 | D.乙酸乙酯的制备和收集 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
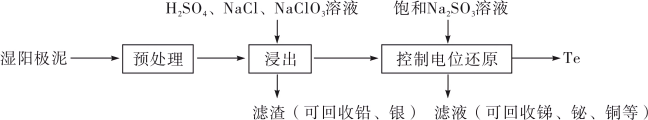
9 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)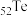 的基态原子的电子排布式为
的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是___________ ;氧化后的原料还需粉碎、过筛,目的是___________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式___________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成___________ (填化学式)。
(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为___________ 。若Te的原子半径为rpm,碲化锌晶胞中面心与顶点的碲原子相切,晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  (列出计算式)。
(列出计算式)。
| 物质 | 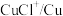 | 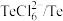 | 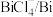 | 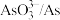 | 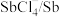 |
| 氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)
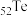 的基态原子的电子排布式为
的基态原子的电子排布式为(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为
 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出计算式)。
(列出计算式)。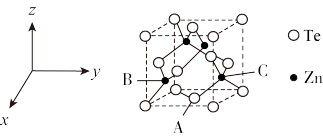
您最近半年使用:0次
10 . 葡萄糖酸锌(Zn(C6H11O7)2)是目前最常用的补锌剂,某实验小组的同学查阅资料后,用以下两种方法合成了葡萄糖酸锌。回答下列问题:
Ⅰ.直接合成法
将一定量的ZnSO4·7H2O完全溶于水,在90℃水浴条件下逐渐加入一定量的葡萄糖酸钙,20分钟后趁热抽滤,滤液转移至仪器A中浓缩至粘稠状,冷却后加入95%的乙醇并不断搅拌,待沉淀转变为晶体状后抽滤得产品。
(1)仪器A的名称为___________ 。
(2)写出直接合成法生成葡萄糖酸锌的化学反应方程式___________ 。
(3)趁热抽滤所得滤渣为___________ (写化学式),趁热抽滤的目的是___________ 。
(4)此法所得产品中易有较多的 ,原因是
,原因是___________ 。
Ⅱ.间接合成法
①制备葡萄糖酸:向蒸馏水中加入少量浓硫酸,搅拌下分批加入一定量的葡萄糖酸钙,抽滤除去沉淀,滤液经离子交换树脂纯化后得无色高纯度的葡萄糖酸溶液。
②制备葡萄糖酸锌:取上述高纯溶液,加入一定的ZnO,60℃水浴充分反应后除去不溶物,向滤液中加入无水乙醇后用冰水浴冷却,有白色晶体析出,重结晶得纯度较高的葡萄糖酸锌。
(5)制备葡萄糖酸时常得到淡黄色滤液,可加入一定量___________ 进行物理脱色。
(6)重结晶步骤的具体操作为:将粗产品以温水溶解后,加入___________ ,过滤、洗涤、___________ ,称重。
(7)产品中锌含量测定:准确称取0.400g葡萄糖酸锌溶于20mL温水中,加入10mL缓冲溶液,4滴指示剂,用c mol/LEDTA标准溶液滴定至终点,平行测定三次,消耗标准溶液的平均值为V mL,计算产品中锌的质量分数为___________ %(已知锌离子与EDTA按物质的量之比1∶1反应)。
Ⅰ.直接合成法
将一定量的ZnSO4·7H2O完全溶于水,在90℃水浴条件下逐渐加入一定量的葡萄糖酸钙,20分钟后趁热抽滤,滤液转移至仪器A中浓缩至粘稠状,冷却后加入95%的乙醇并不断搅拌,待沉淀转变为晶体状后抽滤得产品。
(1)仪器A的名称为
(2)写出直接合成法生成葡萄糖酸锌的化学反应方程式
(3)趁热抽滤所得滤渣为
(4)此法所得产品中易有较多的
 ,原因是
,原因是Ⅱ.间接合成法
①制备葡萄糖酸:向蒸馏水中加入少量浓硫酸,搅拌下分批加入一定量的葡萄糖酸钙,抽滤除去沉淀,滤液经离子交换树脂纯化后得无色高纯度的葡萄糖酸溶液。
②制备葡萄糖酸锌:取上述高纯溶液,加入一定的ZnO,60℃水浴充分反应后除去不溶物,向滤液中加入无水乙醇后用冰水浴冷却,有白色晶体析出,重结晶得纯度较高的葡萄糖酸锌。
(5)制备葡萄糖酸时常得到淡黄色滤液,可加入一定量
(6)重结晶步骤的具体操作为:将粗产品以温水溶解后,加入
(7)产品中锌含量测定:准确称取0.400g葡萄糖酸锌溶于20mL温水中,加入10mL缓冲溶液,4滴指示剂,用c mol/LEDTA标准溶液滴定至终点,平行测定三次,消耗标准溶液的平均值为V mL,计算产品中锌的质量分数为
您最近半年使用:0次