人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 高考帮
全国
高二
课后作业
2020-10-06
426次
整体难度:
适中
考查范围:
化学反应原理、物质结构与性质
人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 高考帮
全国
高二
课后作业
2020-10-06
426次
整体难度:
适中
考查范围:
化学反应原理、物质结构与性质
一、计算题 添加题型下试题
计算题
|
适中(0.65)
1. (1)Shoichi研究了467℃、489℃时水煤气变换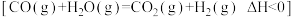 中CO和
中CO和 分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的
分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的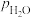 和
和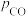 相等、
相等、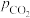 和
和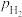 相等。
相等。

计算曲线a的反应在30~90min内的平均速率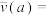
__________  。
。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时 分解反应:
分解反应:

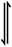

其中 二聚为
二聚为 的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示[
的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示[ 时,
时, 完全分解]:
完全分解]:
研究表明, 分解的反应速率
分解的反应速率 。
。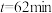 时,测得体系中a,则此时的
时,测得体系中a,则此时的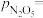
__________ kPa,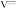
__________ 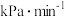 。
。
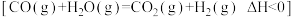 中CO和
中CO和 分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的
分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的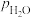 和
和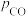 相等、
相等、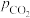 和
和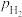 相等。
相等。
计算曲线a的反应在30~90min内的平均速率
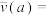
 。
。(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时
 分解反应:
分解反应:
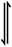

其中
 二聚为
二聚为 的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示[
的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示[ 时,
时, 完全分解]:
完全分解]:| t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
| p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
研究表明,
 分解的反应速率
分解的反应速率 。
。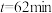 时,测得体系中a,则此时的
时,测得体系中a,则此时的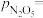
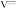
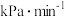 。
。
您最近一年使用:0次
二、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
2. (1)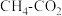 催化重整不仅可以得到合成气(
催化重整不仅可以得到合成气( 和
和 ),还对温室气体的减排具有重要意义。在一定温度下,测得某催化剂上沉积碳的生成速率方程为
),还对温室气体的减排具有重要意义。在一定温度下,测得某催化剂上沉积碳的生成速率方程为 (k为速率常数)。在
(k为速率常数)。在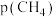 一定时,不同
一定时,不同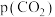 下积碳量随时间的变化趋势如图所示,则
下积碳量随时间的变化趋势如图所示,则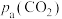 、
、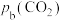 、
、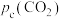 从大到小的顺序为
从大到小的顺序为________ 。

(2)对于反应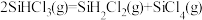 ,采用大孔弱碱性阴离子交换树脂催化剂,在
,采用大孔弱碱性阴离子交换树脂催化剂,在 和
和 时
时 的转化率随时间变化的结果如图所示:
的转化率随时间变化的结果如图所示:

比较a、b处反应速率大小:
_______  (填“大于”“小于”或“等于”)。反应速率
(填“大于”“小于”或“等于”)。反应速率 ,
, 、
、 分别为正、逆向反应速率常数,x为物质的量分数,计算a处的
分别为正、逆向反应速率常数,x为物质的量分数,计算a处的
________ (保留1位小数)。
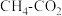 催化重整不仅可以得到合成气(
催化重整不仅可以得到合成气( 和
和 ),还对温室气体的减排具有重要意义。在一定温度下,测得某催化剂上沉积碳的生成速率方程为
),还对温室气体的减排具有重要意义。在一定温度下,测得某催化剂上沉积碳的生成速率方程为 (k为速率常数)。在
(k为速率常数)。在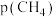 一定时,不同
一定时,不同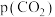 下积碳量随时间的变化趋势如图所示,则
下积碳量随时间的变化趋势如图所示,则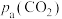 、
、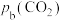 、
、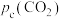 从大到小的顺序为
从大到小的顺序为
(2)对于反应
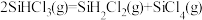 ,采用大孔弱碱性阴离子交换树脂催化剂,在
,采用大孔弱碱性阴离子交换树脂催化剂,在 和
和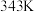 时
时 的转化率随时间变化的结果如图所示:
的转化率随时间变化的结果如图所示:
比较a、b处反应速率大小:

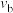 (填“大于”“小于”或“等于”)。反应速率
(填“大于”“小于”或“等于”)。反应速率 ,
, 、
、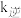 分别为正、逆向反应速率常数,x为物质的量分数,计算a处的
分别为正、逆向反应速率常数,x为物质的量分数,计算a处的
您最近一年使用:0次
2020-09-17更新
|
233次组卷
|
2卷引用:鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率
三、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
3.  歧化反应的方程式为
歧化反应的方程式为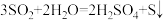 ,
, 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
(1)i.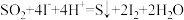
ii.
__________ =__________ +__________ 
(2)探究i、ii反应速率与 歧化反应速率的关系,实验如下:分别将18mL
歧化反应速率的关系,实验如下:分别将18mL 饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:
饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)
①B是A的对比实验,则
__________ 。
②比较A、B、C,可得出的结论是_________________________ 。
③实验表明, 的歧化反应速率
的歧化反应速率 。结合i、ii反应速率解释原因:
。结合i、ii反应速率解释原因:_____________________ 。
 歧化反应的方程式为
歧化反应的方程式为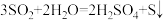 ,
, 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
歧化反应的催化剂,可能的催化过程如下。将ii补充完整。(1)i.
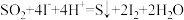
ii.


(2)探究i、ii反应速率与
 歧化反应速率的关系,实验如下:分别将18mL
歧化反应速率的关系,实验如下:分别将18mL 饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:
饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)| 序号 | A | B | C | D |
| 试剂组成 | 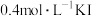 |  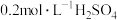 | 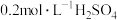 | 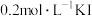 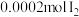 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则

②比较A、B、C,可得出的结论是
③实验表明,
 的歧化反应速率
的歧化反应速率 。结合i、ii反应速率解释原因:
。结合i、ii反应速率解释原因:
您最近一年使用:0次
2020-10-04更新
|
273次组卷
|
3卷引用:人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 高考帮
人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 高考帮(已下线)考向21 化学反应速率及影响因素-备战2022年高考化学一轮复习考点微专题广东省梅州市蕉岭县蕉岭中学2022-2023学年高三上学期高二第二次质检化学试题
四、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
解题方法
4. 环戊二烯容易发生聚合生成二聚体,该反应为可逆反应(假设用2A A2表示该反应)。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
A2表示该反应)。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是

 A2表示该反应)。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
A2表示该反应)。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
| A.T1>T2 |
| B.a点的反应速率小于c点的反应速率 |
| C.a点的正反应速率大于b点的逆反应速率 |
| D.b点时环戊二烯的浓度为0.45 mol/L |
您最近一年使用:0次
2020-09-25更新
|
386次组卷
|
8卷引用:四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题
四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题江苏省盐城市大丰区新丰中学2019-2020学年高二上学期期末考试化学试题四川省乐山市2019-2020学年高二上学期期末教学质量检测化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第三节 化学反应的快慢和限度 高考帮人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 高考帮黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题福建省漳州市华安县正兴学校2022-2023学年高二上学期期中联考化学试题
单选题
|
适中(0.65)
真题
名校
5. 某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应 ,在其他条件相同时,测得实验数据如下表:
,在其他条件相同时,测得实验数据如下表:
根据表中数据,下列说法正确的是
 ,在其他条件相同时,测得实验数据如下表:
,在其他条件相同时,测得实验数据如下表:| 压强/(×105Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
| 50% | 90% | 98% | ||
| 1.0 | 30 | 12 | 250 | 2830 |
| 90 | 25 | 510 | 5760 | |
| 8.0 | 30 | 0.2 | 3.9 | 36 |
| 90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
| A.升高温度,反应速率加快 |
| B.增大压强,反应速率变慢 |
| C.在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡 |
| D.若进入反应塔的混合气体为amol,反应速率以v=Δn/Δt表示,则在8.0×105Pa、30℃条件下转化率从50%增至90%时段NO的反应速率为4a/370mol/s |
您最近一年使用:0次
2018-11-09更新
|
2952次组卷
|
18卷引用:浙江省普通高校招生选考科目2018年4月考试化学试题
浙江省普通高校招生选考科目2018年4月考试化学试题河南省驻马店市2018-2019学年高二下学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——化学反应速率(提升练习)浙江省绍兴市柯桥区2019-2020学年高一上学期期末教学质量检测(实验班) 化学试题(已下线)专题06 化学反应的速率和限度(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率(已下线)第02章 化学反应速率与化学平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第三节 化学反应的快慢和限度 高考帮人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 高考帮高中化学苏教2019版必修第二册-专题6 第一单元综合拔高练(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度浙江省绍兴市诸暨中学2020-2021学年高一下学期4月期中考试(实验班)化学试题黑龙江省大庆市铁人中学2020-2021学年高一下学期期末考试化学试题(已下线)专题12.化学反应速率与化学平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题宁夏回族自治区银川一中2021-2022学年高一下学期期中考试化学试题(已下线)专题06 化学反应与能量-2023年高考化学一轮复习小题多维练(全国通用)浙江省湖州市长兴县等三县2019-2020学年高二上学期期中考试化学试题
五、多选题 添加题型下试题
多选题
|
适中(0.65)
6. 对于反应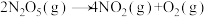 ,R.A.Ogg提出如下反应历程:
,R.A.Ogg提出如下反应历程:
第一步 快速平衡
快速平衡
第二步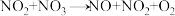 慢反应
慢反应
第三步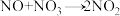 快反应
快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是。
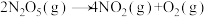 ,R.A.Ogg提出如下反应历程:
,R.A.Ogg提出如下反应历程:第一步
 快速平衡
快速平衡第二步
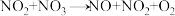 慢反应
慢反应第三步
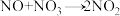 快反应
快反应其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是。
A.v(第一步的逆反应)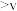 (第二步反应) (第二步反应) |
B.反应的中间产物只有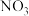 |
C.第二步中 与 与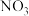 的碰撞仅部分有效 的碰撞仅部分有效 |
| D.第三步反应活化能较高 |
您最近一年使用:0次
2020-10-04更新
|
539次组卷
|
4卷引用:人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 高考帮
人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 高考帮山东省济宁市泗水县2020-2021学年高二上学期期中考试化学试题(已下线)小题28 化学反应速率的计算与影响因素 ——备战2021年高考化学经典小题考前必刷(全国通用)山东省临沂市平邑县第一中学2022-2023学年高二上学期10月月考化学试题
试卷分析
整体难度:适中
考查范围:化学反应原理、物质结构与性质
试卷题型(共 6题)
题型
数量
计算题
1
填空题
1
解答题
1
单选题
2
多选题
1
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、计算题 | |||
| 1 | 0.65 | 化学平衡常数的影响因素及应用 化学平衡题中基于图表数据的相关计算 | |
| 二、填空题 | |||
| 2 | 0.65 | 化学反应速率计算 化学反应速率的图像 化学平衡题中基于图表数据的相关计算 | |
| 三、解答题 | |||
| 3 | 0.65 | 催化剂对化学反应速率的影响 化学反应条件控制的相关实验 | 实验探究题 |
| 四、单选题 | |||
| 4 | 0.65 | 影响化学反应速率的因素 化学反应速率的图像 化学平衡的有关计算 化学平衡图像分析 | |
| 5 | 0.65 | 化学反应速率计算 压强对化学反应速率的影响 温度对化学反应速率的影响 化学平衡状态的判断方法 | |
| 五、多选题 | |||
| 6 | 0.65 | 碰撞理论及活化能 催化剂对化学反应速率的影响 研究物质结构的历程及意义 | |



