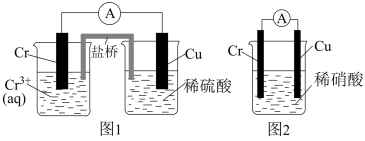
原电池的电极反应式不仅与电极材料的性质有关,也与电解质溶液有关。下列说法错误的是( )
| A.由Fe、Cu、FeCl3溶液组成的原电池,负极反应式为Cu-2e-=Cu2+ |
| B.由Al、Cu、稀硫酸组成的原电池,负极反应式为Al-3e-=Al3+ |
C.由Al、Mg、NaOH溶液组成的原电池,负极反应式为Al+4OH--3e-=AlO +2H2O +2H2O |
| D.由Al、Cu、浓硝酸组成的原电池,负极反应式为Al-3e-=Al3+ |
19-20高二·全国·课时练习 查看更多[2]
更新时间:2020-08-27 17:01:40
|
相似题推荐
多选题
|
适中
(0.65)
【推荐1】某锂碘电池以LiI- Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb。下列说法正确的是
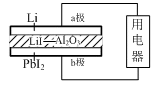

| A.电子由a极经用电器流向b极 |
| B.放电时I-由a极通过固体电解质传递到b极 |
| C.b极上的电极反应式为: PbI2+2e-=Pb+ 2I- |
| D.放电时电池将电能转化为化学能 |
您最近一年使用:0次
多选题
|
适中
(0.65)
【推荐2】镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。下列说法正确的是
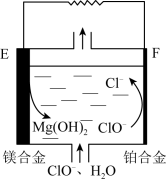

| A.随着反应的进行,正极区pH升高 |
| B.放电时,F极生成的Cl-移动方向与内电路电子移动方向相同 |
| C.放电时,E极的电势比F极的高 |
D.每生成1 mol  ,则有1 mol ,则有1 mol 被还原 被还原 |
您最近一年使用:0次
多选题
|
适中
(0.65)
【推荐1】新研发的车载双电极镍氢电池于2021年7月投入量产,有助于实现“双碳”目标。其原理如图所示。放电时a、c电极的反应物为吸附了氢气的稀土合金,可表示为MH;充电时b、d电极的反应物为Ni(OH)2,下列叙述错误的是
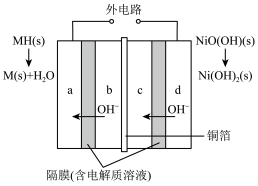

| A.b、d为电池的负极 |
| B.铜箔的作用是隔开电极,传递电子 |
| C.上图示过程中,b电极的电极反应式:NiO(OH)+e-+H2O=Ni(OH)2+OH- |
| D.充电时,每转移1mol电子,该电池的负极共增重1g |
您最近一年使用:0次
多选题
|
适中
(0.65)
【推荐2】目前人们正在研究一种高能电池——钠硫电池, 它是以熔融的钠、硫为两极,以Na+导放电电的β-Al2O3陶瓷作固体电解质,反应式为2Na + xS Na2Sx,以下说法中,正确的是
Na2Sx,以下说法中,正确的是
 Na2Sx,以下说法中,正确的是
Na2Sx,以下说法中,正确的是| A.放电时钠作正极,硫作负极 |
| B.充电时钠极与外电源的正极相连,硫与外电源的负极相连 |
C.充电时,阳极发生的反应为: S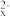 -2e-=xS -2e-=xS |
| D.放电时钠极发生氧化反应 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐1】一种以液态肼( )为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
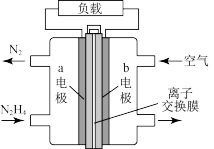
 )为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
| A.b极发生氧化反应 |
B.a极的电极反应为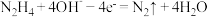 |
| C.放电时,电流从a极经过负载流向b极 |
| D.其中的离子交换膜需选用阴离子交换膜 |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
【推荐2】锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应式为2Zn+O2+4OH-+2H2O=2[Zn(OH)4]2-。下列说法正确的是
| A.电解质溶液中K+向负极移动 |
| B.电解质溶液中c(OH-)逐渐减小 |
| C.负极反应式为Zn+4OH--2e-=[Zn(OH)4]2- |
| D.电路中通过2mol电子,消耗氧气22.4L(标准状况) |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐1】某化学小组为了探究铝电极在原电池中的作用,进行了下列实验,实验结果记录如表。下列说法正确的是
| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| ① | Mg、Al | 稀盐酸 | 偏向Al |
| ② | Al、Cu | 稀盐酸 | 偏向Cu |
| ③ | Al、石墨 | 稀盐酸 | 偏向____ |
| ④ | Mg、Al | NaOH溶液 | 偏向Mg |
| A.实验①和②中,Al电极的作用不相同 |
| B.实验③中,电流表指针偏向Al |
| C.实验④中,Mg为负极,电极反应式为:Mg-2e-=Mg2+ |
| D.综合以上实验,铝在原电池中的作用,与另一个电极材料和电解质溶液有关 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐2】锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,该电池的总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是( )
| A.电解质溶液中混入水,对电池反应无影响 |
| B.上述过程中是化学能转化成电能 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被氧化为Li2SO3 |
| D.电池放电时,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1 |
您最近一年使用:0次

 的迁移方向如图所示。下列有关说法
的迁移方向如图所示。下列有关说法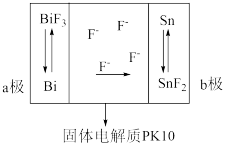
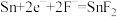
 ,a极反应消耗1mol
,a极反应消耗1mol