将6.4g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余。试计算:
(1)生成的SO2的体积(标准状况下)。__________
(2)若用4mol·L-1的NaOH溶液吸收生成的SO2,反应生成Na2SO3,计算需要NaOH溶液的体积。__________
(1)生成的SO2的体积(标准状况下)。
(2)若用4mol·L-1的NaOH溶液吸收生成的SO2,反应生成Na2SO3,计算需要NaOH溶液的体积。
更新时间:2020/11/06 07:39:04
|
【知识点】 化学方程式计算中物质的量的运用解读
相似题推荐
计算题
|
较易
(0.85)
【推荐1】有10.2 g镁铝合金恰好溶于250 mL 4 mol·L-1的盐酸中,现加入2 mol·L-1的氢氧化钠溶液。请回答以下问题(要求有计算过程):
(1)10.2 g镁铝合金中各物质的质量分别是多少?
(2)要使产生的沉淀的质量最大,需加入的氢氧化钠溶液的体积是多少?
(3)要使产生的沉淀只有氢氧化镁,至少需加入的氢氧化钠溶液的体积是多少?
(1)10.2 g镁铝合金中各物质的质量分别是多少?
(2)要使产生的沉淀的质量最大,需加入的氢氧化钠溶液的体积是多少?
(3)要使产生的沉淀只有氢氧化镁,至少需加入的氢氧化钠溶液的体积是多少?
您最近一年使用:0次
计算题
|
较易
(0.85)
【推荐2】常温下 为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。
为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。 可通过如下反应制备:
可通过如下反应制备: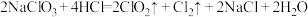 。现往足量
。现往足量 中通入
中通入 (标准状况下)气体制
(标准状况下)气体制 ,请计算:
,请计算:
(1)通入的HCl气体物质的量为___________ mol。
(2)充分反应后,转移电子数目为___________ 个。
(3)若将生成的混合气体通过装有亚氯酸钠( )的干燥管,可吸收
)的干燥管,可吸收 并生成
并生成 。通过两步制备共产生
。通过两步制备共产生 质量为
质量为___________ g。
 为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。
为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。 可通过如下反应制备:
可通过如下反应制备: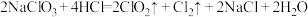 。现往足量
。现往足量 中通入
中通入 (标准状况下)气体制
(标准状况下)气体制 ,请计算:
,请计算:(1)通入的HCl气体物质的量为
(2)充分反应后,转移电子数目为
(3)若将生成的混合气体通过装有亚氯酸钠(
 )的干燥管,可吸收
)的干燥管,可吸收 并生成
并生成 。通过两步制备共产生
。通过两步制备共产生 质量为
质量为
您最近一年使用:0次



