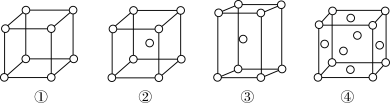
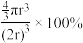下列有关分子与晶体的说法正确的是
| A.金刚石、氮化硼、C60熔化需克服的作用力类型相同 |
| B.晶体中有阴离子,必有阳离子;反之晶体中有阳离子,也必有阴离子 |
| C.钋单质为简单立方堆积,则晶胞中钋原子配位数为6 |
| D.COS 与CO2互为等电子体,故COS 是直线形的非极性分子 |
更新时间:2020-12-02 10:06:28
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】某化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为1.3.3°。下列推断不正确的是
| A.AB2分子的立体构型为V形 |
| B.A-B键为极性共价键,AB2分子为非极性分子 |
| C.AB2与H2O相比,AB2的熔点、沸点比H2O的低 |
| D.AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】CO2、CH4、BF3都是非极性分子,HF、H2O、NH3都是极性分子,由此推测ABn型分子是非极性分子的经验规律正确的是( )
| A.所有原子在同一平面 |
| B.分子中每个键的键长应相等 |
| C.在ABn中A原子没有孤对电子 |
| D.A的相对原子质量小于B |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列关于物质性质的说法,不正确的是
| A.I2晶体升华时破坏了分子内共价键 |
| B.丙氨酸(CH3CH(NH2)COOH)分子是手性分子 |
| C.HF、HCl、HBr、HI的稳定性依次减弱 |
| D.酸性:CF3COOH>CCl3COOH>CH3COOH |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】关于共价化合物的描述正确的是
| A.只含非金属元素 | B.属于强电解质 |
| C.只含有共价键 | D.晶体硬度很大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列晶体中由原子直接构成的单质有 ( )
| A.金属钾 | B.氢气 | C.金刚石 | D.白磷 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】有关晶体的叙述中正确的是
| A.在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子 |
| B.在28 g晶体硅中,含Si-Si共价键个数为4NA |
| C.金刚石的熔沸点高于晶体硅,是因为C-C键键能小于Si-Si键 |
| D.镁型和铜型金属晶体的配位数均为12 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】化学上存在许多的递变关系,下列递变关系完全正确的是
A.熔沸点 ;硬度: ;硬度: |
B.稳定性: ;沸点: ;沸点: |
C.酸性: ;非金属性: ;非金属性: |
D.第一电离能: ;电负性: ;电负性: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法不正确 的是
| A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 |
| B.常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 |
| C.金属易导电、易导热、有延展性、易锈蚀均能用金属的电子气理论解释 |
| D.石墨晶体中既有共价键,又有金属键还有范德华力,是一种混合晶体 |
您最近一年使用:0次