已知某H2SO4、FeSO4、Fe2(SO4)3混合溶液100 mL,其中阳离子浓度相等,SO 浓度为3 mol/L,此溶液可溶解铁粉的质量为
浓度为3 mol/L,此溶液可溶解铁粉的质量为
 浓度为3 mol/L,此溶液可溶解铁粉的质量为
浓度为3 mol/L,此溶液可溶解铁粉的质量为| A.5.6g | B.11.2g | C.16.8g | D.33.6 g |
更新时间:2021-03-04 08:02:31
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】将标准状况下,将VLA气体(摩尔质量为Mg/L)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为
A.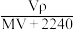 | B.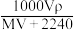 | C.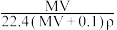 | D.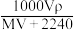 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.0.3 mol H2和0.1 mol N2于密闭容器中充分反应后,其分子总数小于0.2 NA |
| B.标准状况下,11.2 L NH3与11.2 L HCl充分混合后分子总数为0.5 NA |
| C.标准状况下,2.24 L CH3Cl含有0.3 NA个C—H键 |
| D.pH=2的Fe2(SO4)3溶液中由水电离出的H+的数目为0.01 NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列叙述中正确的是
| A.钠与水、镁与热水、铁与水蒸气反应均得到相应的碱和氢气 |
| B.二氧化硫是有毒气体,严禁将其添加到任何食品和饮料中 |
| C.向Na2CO3溶液中逐滴加入足量的盐酸,初始时无气泡放出 |
| D.向FeBr2溶液中滴加少量氯水,再加CCl4振荡,静置,有机层呈橙色 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列实验操作、现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向某无色溶液中滴加BaCl2溶液 | 产生白色沉淀 | 该无色溶液中一定含有 |
| B | 向某溶液中通入Cl2,再加入KSCN溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将铝箔置于酒精灯上加热 | 铝箔融化且滴落 | 证明铝箔熔点低 |
| D | 将铁丝伸入Cl2中点燃 | 剧烈燃烧,且产生棕黄色的烟 | 该反应方程式为: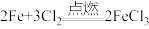 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列实验操作、现象及实验结论均正确的一组是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 用注射器多次抽取硫酸厂附近的空气样品慢慢注入盛有品红的同一试管中,品红不变色 | 空气样品中几乎不含 |
| B | 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的剌激性气味的气体 | 该溶液中一定含有 |
| C | 向铜与浓硫酸反应后的溶液中加入适量水稀释,溶液呈蓝色 | 溶液中含有 |
| D | 将 样品溶于稀硫酸中,滴入KSCN溶液,溶液变红 样品溶于稀硫酸中,滴入KSCN溶液,溶液变红 |  样品已变质 样品已变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列实验,预测的实验现象正确的是
| 选项 | 实验内容 | 预测的实验现象 |
| A | 检验溶液中是否含有 | 滴加少量浓NaOH溶液,观察试管口湿润的蓝色石蕊试纸是否变红 |
| B | 检验铁锈中是否含有二价铁 | 铁锈溶于稀盐酸, 滴入KSCN溶液,溶液变血红色 |
| C | 检验Na2SO3是否变质 | 向Na2SO3溶液中加入BaCl2和稀盐酸,观察是否产生白色沉淀 |
| D | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列有关实验操作、现象、解释和结论都正确的是( )
| 操作 | 现象 | 解释、结论 | |
| A | 过量的Fe粉中加入硝酸充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | Al箔插入稀硝酸中 | 无现象 | Al在硝酸中钝化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列变化过程不涉及 氧化还原反应的是( )
| A | B | C | D |
| 氯化亚铁溶液中滴入氯水,溶液变黄 | 向FeCl2溶液中滴加KSCN溶液,不变色,滴加氯水后溶液显红色 | 向Na2SO3固体中加入硫酸,生成无色气体 | 向包有Na2O2粉末的脱脂棉上滴几滴蒸馏水,脱脂棉燃烧 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次




 +SO
+SO +H2O
+H2O +2H2O+4NH
+2H2O+4NH

