皮革厂的废水中含有一定量的氨氮(以 NH3、NH 形式存在),通过沉淀和氧化两步处理后可使水中氨氮达到国家规定的排放标准。
形式存在),通过沉淀和氧化两步处理后可使水中氨氮达到国家规定的排放标准。
(1)沉淀:向酸性废水中加入适量 Fe2(SO4)3溶液,废水中的氨氮转化为 NH4Fe3(SO4)2(OH)6沉淀。
①该反应的离子方程式为___________ 。
②废水中氨氮去除率随 pH 的变化如图-1 所示,当 1.3 < pH < 1.8 时,氨氮去除率随 pH 升高而降低的原因是___________ 。

(2)氧化:调节经沉淀处理后的废水 pH 约为 6,加入 NaClO 溶液进一步氧化处理。
①NaClO 将废水中的氨氮转化为 N2,该反应的离子方程式为___________ 。
②研究发现,废水中氨氮去除率随温度升高呈先升后降趋势。当温度大于 30℃时,废水中氨氮去除率随着温度升高而降低,其原因是___________ 。
③n(ClO-)/n(氨氮)对废水中氨氮去除率和总氮去除率的影响如图-2 所示。当 n(ClO-)/n(氨氮)>1.54 后,总氮去除率下降的原因是___________ 。
(3)如图是用一种新型锂电池电解处理含 NH 的工业废水的装置图。处理过程中,NH
的工业废水的装置图。处理过程中,NH 转化为可参与大气循环的气体。其中,
转化为可参与大气循环的气体。其中,

①W极为___________ 极,
②在左侧装置中质子移动方向___________
③X极的电极反应式为:___________
 形式存在),通过沉淀和氧化两步处理后可使水中氨氮达到国家规定的排放标准。
形式存在),通过沉淀和氧化两步处理后可使水中氨氮达到国家规定的排放标准。(1)沉淀:向酸性废水中加入适量 Fe2(SO4)3溶液,废水中的氨氮转化为 NH4Fe3(SO4)2(OH)6沉淀。
①该反应的离子方程式为
②废水中氨氮去除率随 pH 的变化如图-1 所示,当 1.3 < pH < 1.8 时,氨氮去除率随 pH 升高而降低的原因是

(2)氧化:调节经沉淀处理后的废水 pH 约为 6,加入 NaClO 溶液进一步氧化处理。
①NaClO 将废水中的氨氮转化为 N2,该反应的离子方程式为
②研究发现,废水中氨氮去除率随温度升高呈先升后降趋势。当温度大于 30℃时,废水中氨氮去除率随着温度升高而降低,其原因是
③n(ClO-)/n(氨氮)对废水中氨氮去除率和总氮去除率的影响如图-2 所示。当 n(ClO-)/n(氨氮)>1.54 后,总氮去除率下降的原因是
(3)如图是用一种新型锂电池电解处理含 NH
 的工业废水的装置图。处理过程中,NH
的工业废水的装置图。处理过程中,NH 转化为可参与大气循环的气体。其中,
转化为可参与大气循环的气体。其中,
①W极为
②在左侧装置中质子移动方向
③X极的电极反应式为:
更新时间:2021-03-16 20:40:48
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】二氧化碳捕集与封存是应对气候变化问题的解决方案之一。回答下列问题:
(l)我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将CO2和CH4一步转化为化工产品。试写出 CO2与CH4合成乙酸的热化学方程式:____ 。
(甲烷和乙酸的燃烧热分别为-890.31 kJ/mol、-876.72 kJ/mol)
(2)在某一钢性密闭容器中CH4、CO2的分压分别为15 kPa、20 kPa,加入Ni/α-Al2 O3催化剂并加热至1123 K使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.28 10-2﹒p(CH4)
10-2﹒p(CH4) p(CO2)(kPa
p(CO2)(kPa s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=
s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___ kPa,v(CO)=___ kPa s-1。
s-1。
②达到平衡后测得体系压强是起始时的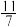 ,则该反应的平衡常数Kp=
,则该反应的平衡常数Kp=____ kPa)2。
(3)氮化镓(GaN)与Cu可组成如图所示的人工光合系统,该装置能以CO2和H2O为原料合成CH4。
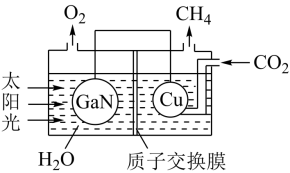
①该装置工作时H+移向____ (填“GaN”或“Cu”)电极,该电极上的电极反应式为 ___ 。
②该装置每产生1 mol CH4,左极室溶液质量减少____ g。
③本实验条件下,若CO2转化为烃(如甲烷、乙烯等)的转化率为10%,生成CH4的选择性为12%,现收集到12 mol CH4,则通入的CO2为____ mol。(已知:选择性=生成目标产物消耗的原料量/原料总的转化量)
(4)上述人工光合系统装置也可以制备乙烯、乙炔等重要化工原料。2010年Sheth等研究得出乙炔在Pd表面选择加氢的反应机理,如下图所示。其中吸附在Pd表面的物质用“*”标注。

上述吸附反应为____ 填“吸热”或“放热”)反应,该过程中最小能垒(活化能)为___ kJ mol-1,该步骤的化学方程式为
mol-1,该步骤的化学方程式为____ 。
(l)我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将CO2和CH4一步转化为化工产品。试写出 CO2与CH4合成乙酸的热化学方程式:
(甲烷和乙酸的燃烧热分别为-890.31 kJ/mol、-876.72 kJ/mol)
(2)在某一钢性密闭容器中CH4、CO2的分压分别为15 kPa、20 kPa,加入Ni/α-Al2 O3催化剂并加热至1123 K使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。①研究表明CO的生成速率v(CO)=1.28
 10-2﹒p(CH4)
10-2﹒p(CH4) p(CO2)(kPa
p(CO2)(kPa s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=
s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)= s-1。
s-1。②达到平衡后测得体系压强是起始时的
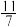 ,则该反应的平衡常数Kp=
,则该反应的平衡常数Kp=(3)氮化镓(GaN)与Cu可组成如图所示的人工光合系统,该装置能以CO2和H2O为原料合成CH4。

①该装置工作时H+移向
②该装置每产生1 mol CH4,左极室溶液质量减少
③本实验条件下,若CO2转化为烃(如甲烷、乙烯等)的转化率为10%,生成CH4的选择性为12%,现收集到12 mol CH4,则通入的CO2为
(4)上述人工光合系统装置也可以制备乙烯、乙炔等重要化工原料。2010年Sheth等研究得出乙炔在Pd表面选择加氢的反应机理,如下图所示。其中吸附在Pd表面的物质用“*”标注。

上述吸附反应为
 mol-1,该步骤的化学方程式为
mol-1,该步骤的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 减排策略主要有三种:减少排放、捕集封存、转化利用。其中
减排策略主要有三种:减少排放、捕集封存、转化利用。其中 转化利用生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。
转化利用生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。
(1)甲醇是燃料电池的常用燃料,也是有机合成的重要化工原料。已知 时,甲醇、氢气燃烧热分别为
时,甲醇、氢气燃烧热分别为 、
、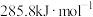 ,
, 甲醇蒸气、水蒸气液化分别放出
甲醇蒸气、水蒸气液化分别放出 、
、 的热量。则
的热量。则 与
与 反应生成甲醇蒸气和水蒸气的热化学方程式为
反应生成甲醇蒸气和水蒸气的热化学方程式为_________________________ 。
(2)通过计算机分析,我们可从势能图(峰值数据是峰谷和峰值物质能量的差值)认识 加氢制甲醇在不同催化条件下存在的两种反应路径,如图1所示。
加氢制甲醇在不同催化条件下存在的两种反应路径,如图1所示。
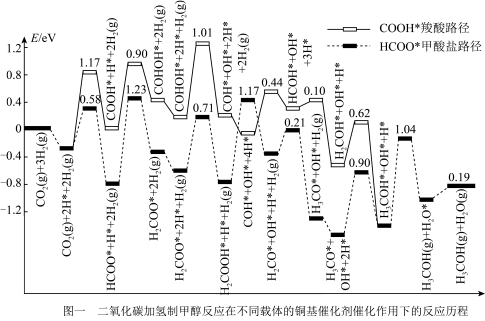
①写出甲酸盐路径决速步的化学方程式_______________ 。
②下列说法正确的有_______________ 。
A.增大催化剂表面积可提高 在催化剂表面的吸附速率
在催化剂表面的吸附速率
B.不考虑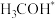 ,两种路径中产生的含碳中间体种类均有5种
,两种路径中产生的含碳中间体种类均有5种
C.中间体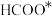 比
比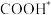 更稳定
更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率
(3)向恒压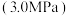 密闭装置中通入反应物混合气[混合比例
密闭装置中通入反应物混合气[混合比例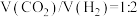 ],测定甲醇的平均生成速率随温度的变化曲线,如图2所示。
],测定甲醇的平均生成速率随温度的变化曲线,如图2所示。

①甲醇的平均生成速率呈“抛物线”形状的原因_______________ ,最佳催化剂及最佳反应温度是______________ 。
②二氧化碳加氢制甲醇的速率方程可表示为: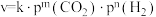 ,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响。使用
,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响。使用 催化剂时,反应温度由
催化剂时,反应温度由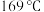 升高到
升高到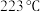 ,若
,若 反应级数
反应级数 ,
, 反应级数不变,则速率常数之比
反应级数不变,则速率常数之比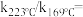
______________ 。
(4)在 催化加氢制甲醇过程中也存在竞争性的反应:
催化加氢制甲醇过程中也存在竞争性的反应: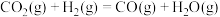
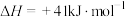 。在恒温密闭容器中,维持压强和投料不变,将
。在恒温密闭容器中,维持压强和投料不变,将 和
和 按一定流速通过反应器,二氧化碳转化率和甲醇选择性
按一定流速通过反应器,二氧化碳转化率和甲醇选择性 随温度变化关系如图3所示。
随温度变化关系如图3所示。
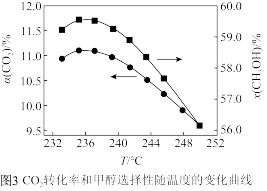
①若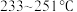 时催化剂活性受温度影响不大,则
时催化剂活性受温度影响不大,则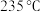 后图中曲线下降的原因
后图中曲线下降的原因________________ 。
②某温度时,向压强为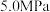 的恒压装置中加入
的恒压装置中加入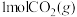 和
和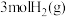 反应并达到平衡状态,
反应并达到平衡状态, 平衡转化率为
平衡转化率为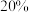 ,甲醇选择性为
,甲醇选择性为 ,则甲醇的平衡分压为
,则甲醇的平衡分压为___________ (结果保留2位有效数字) 。
 减排策略主要有三种:减少排放、捕集封存、转化利用。其中
减排策略主要有三种:减少排放、捕集封存、转化利用。其中 转化利用生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。
转化利用生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。(1)甲醇是燃料电池的常用燃料,也是有机合成的重要化工原料。已知
 时,甲醇、氢气燃烧热分别为
时,甲醇、氢气燃烧热分别为 、
、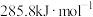 ,
, 甲醇蒸气、水蒸气液化分别放出
甲醇蒸气、水蒸气液化分别放出 、
、 的热量。则
的热量。则 与
与 反应生成甲醇蒸气和水蒸气的热化学方程式为
反应生成甲醇蒸气和水蒸气的热化学方程式为(2)通过计算机分析,我们可从势能图(峰值数据是峰谷和峰值物质能量的差值)认识
 加氢制甲醇在不同催化条件下存在的两种反应路径,如图1所示。
加氢制甲醇在不同催化条件下存在的两种反应路径,如图1所示。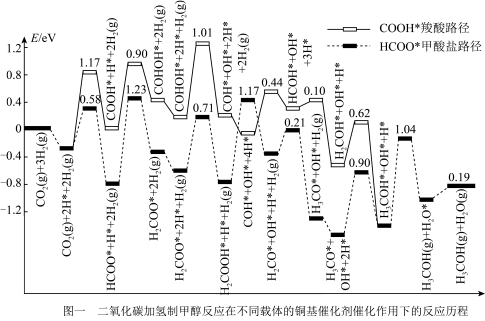
①写出甲酸盐路径决速步的化学方程式
②下列说法正确的有
A.增大催化剂表面积可提高
 在催化剂表面的吸附速率
在催化剂表面的吸附速率B.不考虑
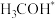 ,两种路径中产生的含碳中间体种类均有5种
,两种路径中产生的含碳中间体种类均有5种C.中间体
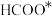 比
比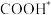 更稳定
更稳定D.使用高活性催化剂可降低反应焓变,加快反应速率
(3)向恒压
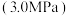 密闭装置中通入反应物混合气[混合比例
密闭装置中通入反应物混合气[混合比例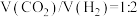 ],测定甲醇的平均生成速率随温度的变化曲线,如图2所示。
],测定甲醇的平均生成速率随温度的变化曲线,如图2所示。
①甲醇的平均生成速率呈“抛物线”形状的原因
②二氧化碳加氢制甲醇的速率方程可表示为:
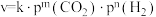 ,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响。使用
,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响。使用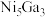 催化剂时,反应温度由
催化剂时,反应温度由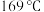 升高到
升高到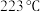 ,若
,若 反应级数
反应级数 ,
, 反应级数不变,则速率常数之比
反应级数不变,则速率常数之比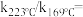
(4)在
 催化加氢制甲醇过程中也存在竞争性的反应:
催化加氢制甲醇过程中也存在竞争性的反应: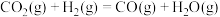
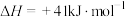 。在恒温密闭容器中,维持压强和投料不变,将
。在恒温密闭容器中,维持压强和投料不变,将 和
和 按一定流速通过反应器,二氧化碳转化率和甲醇选择性
按一定流速通过反应器,二氧化碳转化率和甲醇选择性 随温度变化关系如图3所示。
随温度变化关系如图3所示。
①若
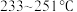 时催化剂活性受温度影响不大,则
时催化剂活性受温度影响不大,则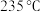 后图中曲线下降的原因
后图中曲线下降的原因②某温度时,向压强为
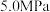 的恒压装置中加入
的恒压装置中加入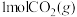 和
和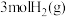 反应并达到平衡状态,
反应并达到平衡状态, 平衡转化率为
平衡转化率为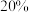 ,甲醇选择性为
,甲醇选择性为 ,则甲醇的平衡分压为
,则甲醇的平衡分压为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)=C2H4(g)+H2(g)△H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+ O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
则△H=___ kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)=C2H5OH(g)。向某恒容密闭容器中充入amolC2H4(g)和amol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:

①该反应为___ 热反应(填“吸”或“放”)。
②A点时容器中气体的总物质的量为___ 。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为bMPa,则A点对应温度下的KP=___ MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___ (填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率___ 10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为____ 极(填“阴”或“阳”),对应的电极反应式为___ 。
(1)乙烯的制备:工业上常利用反应C2H6(g)=C2H4(g)+H2(g)△H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+
 O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;Ⅲ.C2H6(g)+
 O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。则△H=
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)=C2H5OH(g)。向某恒容密闭容器中充入amolC2H4(g)和amol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:

①该反应为
②A点时容器中气体的总物质的量为
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】回答下列有关问题。
(1)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
某同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:原溶液中所含阳离子是___________________ ,阴离子是_____________________ 。
(2)光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
①图1中N型半导体为____________ (填“正极”或“负极”)
②该系统工作时,A极的电极反应式为___________________________________________ 。
③若A极产生7.00gN2,则此时B极产生_____________ LH2(标准状况下)。
(1)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 | K+ | Cu2+ | Fe3+ | Al3+ | Fe2+ |
| 阴离子 | Cl- | CO32— | NO3— | SO42— | SiO32— |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:原溶液中所含阳离子是
(2)光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

图1 图2
①图1中N型半导体为
②该系统工作时,A极的电极反应式为
③若A极产生7.00gN2,则此时B极产生
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
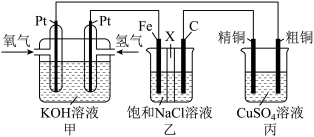
【推荐2】某同学设计了如图所示装置,可探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)甲装置中通入氧气的电极为___________ (填“正极”或“负极”),负极的电极反应式为___________ 。
(2)乙装置中Fe电极为___________ (填“阳极”或“阴极”);C电极上发生___________ (填“氧化”或“还原”)反应,电极反应式为___________ 。
(3)反应一段时间后,乙装置中氢氧化钠主要在___________ (填“Fe电极”或“C电极”)区生成。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后, 溶液的浓度
溶液的浓度___________ (填“增大”“减小”或“不变”)。

根据要求回答相关问题:
(1)甲装置中通入氧气的电极为
(2)乙装置中Fe电极为
(3)反应一段时间后,乙装置中氢氧化钠主要在
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后,
 溶液的浓度
溶液的浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解 溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
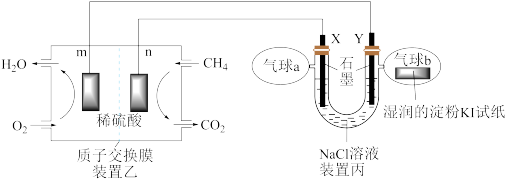
(1)m极为_______ 极,该电极发生的电极反应式为_______
(2)装置丙Y极电极反应式为_______ ;装置乙中n电极发生反应的电极反应式为:_______
(3)另一化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(H3PO3)具有较强的还原性,能被酸性高锰酸钾溶液氧化为磷酸。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:_______ 。
②已知三次滴定数据如下表,该亚磷酸溶液的物质的量浓度为_______  。(保留小数点后两位)
。(保留小数点后两位)
③某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是_______ 。
A. 实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B. 如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C. 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D. 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
 溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
(1)m极为
(2)装置丙Y极电极反应式为
(3)另一化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(H3PO3)具有较强的还原性,能被酸性高锰酸钾溶液氧化为磷酸。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:
②已知三次滴定数据如下表,该亚磷酸溶液的物质的量浓度为
 。(保留小数点后两位)
。(保留小数点后两位)| 试验编号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 22.00 |
| 2 | 0.50 | 22.50 |
| 3 | 0.50 | 25.50 |
A. 实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B. 如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C. 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D. 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
您最近一年使用:0次
【推荐1】甲醇、乙醇是重要的化工原料,可以用多种方法合成。
⑴已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H=-37.3kJ/mol,则CO2与H2反应生成甲醇蒸气和液态水的热化学方程式为___ 。
⑵若在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下列能说明该反应达到平衡状态的是
CH3OH(g)+H2O(g),下列能说明该反应达到平衡状态的是___ 。
A.混合气体平均相对分子质量不变
B.混合气体密度不变
C.容器内压强恒定不变
D.反应速率满足以下关系:v正(CO2)=3v逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1∶3∶1∶1
F.单位时间内断裂3NAH—H键的同时形成2molH—O键
⑶将CO2和H2按物质的量之比1∶3充入体积为2.0L的恒容密闭容器中反应[生成H2O(g)],图1表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。
a、b两点化学反应速率分别用va、vb表示,则va___ vb(填“>”、“<”或“=”)。
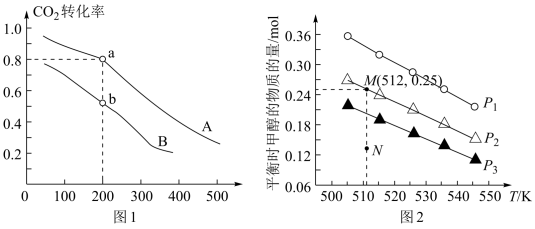
⑷在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是___ 。
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点平衡常数K约为1.04×10-2
D.在P2及512K时,图中N点v(正)<v(逆)
⑸以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。

离子交换膜a为___ (填“阳膜”、“阴膜”),阳极的电极反应式为___ 。
⑹N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O N2H
N2H +OH-K1=10-a;
+OH-K1=10-a;
N2H +H2O
+H2O N2H
N2H +OH-K2=10-b;
+OH-K2=10-b;
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H )>c(N2H4),同时c(N2H
)>c(N2H4),同时c(N2H )>c(N2H
)>c(N2H ),应控制溶液pH范围
),应控制溶液pH范围___ (用含a、b式子表示)。
⑴已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H=-37.3kJ/mol,则CO2与H2反应生成甲醇蒸气和液态水的热化学方程式为
⑵若在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),下列能说明该反应达到平衡状态的是
CH3OH(g)+H2O(g),下列能说明该反应达到平衡状态的是A.混合气体平均相对分子质量不变
B.混合气体密度不变
C.容器内压强恒定不变
D.反应速率满足以下关系:v正(CO2)=3v逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1∶3∶1∶1
F.单位时间内断裂3NAH—H键的同时形成2molH—O键
⑶将CO2和H2按物质的量之比1∶3充入体积为2.0L的恒容密闭容器中反应[生成H2O(g)],图1表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。
a、b两点化学反应速率分别用va、vb表示,则va

⑷在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点平衡常数K约为1.04×10-2
D.在P2及512K时,图中N点v(正)<v(逆)
⑸以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。

离子交换膜a为
⑹N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O
 N2H
N2H +OH-K1=10-a;
+OH-K1=10-a;N2H
 +H2O
+H2O N2H
N2H +OH-K2=10-b;
+OH-K2=10-b;25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H
 )>c(N2H4),同时c(N2H
)>c(N2H4),同时c(N2H )>c(N2H
)>c(N2H ),应控制溶液pH范围
),应控制溶液pH范围
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氮氧化物(NOx)能够引起光化学烟雾、酸雨等系列环境问题。减少NOx排放,并将其转化为无害气体,已成为当今世界的热点议题。请回答下列问题:
(1)已知:
N2(g)+O2(g)=2NO(g) ΔH1
2C(s)+O2(g)=2CO(g) ΔH2
2CO(g)+2NO(g)=2CO2(g)+N2(g) ΔH3
则C(s)+2NO(g)=CO2(g)+N2(g) ΔH4=_______ (用含有ΔH1、ΔH2、ΔH3的代数式表示)。
(2)在600°C的恒容密闭容器中发生反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH3<0,该反应的平衡常数表达式为K=
2CO2(g)+N2(g) ΔH3<0,该反应的平衡常数表达式为K=_______ ,达到平衡状态的依据为_______ (填标号)。
a.混合气体总质量保持不变
b.各组分气体的体积分数保持不变
c.容器内混合气体密度保持不变
d.容器内混合气体压强保持不变
(3)NO能与氧气反应生成NO2,其反应历程如下:
第1步:2NO(g) N2O2(g) (快反应)
N2O2(g) (快反应)
第2步:N2O2(g)+O2(g) 2NO2(g) (慢反应)
2NO2(g) (慢反应)
则总反应的反应速率由第_______ 步决定。
(4)在一定条件下,NH3能与NO2反应生成N2,该反应的化学方程式为_______ ,消耗17gNH3时,转移电子数为_______ 。
(5)利用电化学法能将NO转化为N2,其工作原理如下图所示:

①电极I应连接外电源_______ 极:
②电极II上发生的电极反应式为_______ 。
(1)已知:
N2(g)+O2(g)=2NO(g) ΔH1
2C(s)+O2(g)=2CO(g) ΔH2
2CO(g)+2NO(g)=2CO2(g)+N2(g) ΔH3
则C(s)+2NO(g)=CO2(g)+N2(g) ΔH4=
(2)在600°C的恒容密闭容器中发生反应:2CO(g)+2NO(g)
 2CO2(g)+N2(g) ΔH3<0,该反应的平衡常数表达式为K=
2CO2(g)+N2(g) ΔH3<0,该反应的平衡常数表达式为K=a.混合气体总质量保持不变
b.各组分气体的体积分数保持不变
c.容器内混合气体密度保持不变
d.容器内混合气体压强保持不变
(3)NO能与氧气反应生成NO2,其反应历程如下:
第1步:2NO(g)
 N2O2(g) (快反应)
N2O2(g) (快反应)第2步:N2O2(g)+O2(g)
 2NO2(g) (慢反应)
2NO2(g) (慢反应)则总反应的反应速率由第
(4)在一定条件下,NH3能与NO2反应生成N2,该反应的化学方程式为
(5)利用电化学法能将NO转化为N2,其工作原理如下图所示:

①电极I应连接外电源
②电极II上发生的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】NaClO广泛用作消杀剂、水处理剂及漂白剂等。
已知:NaClO溶液中物种分布分数与溶液pH的关系如图1所示。

(1)向NaClO溶液中通入CO2,发生反应的离子方程式为___ (H2CO3的lgKa1、lgKa2依次为-6.38、-10.21);反应ClO-+H2O HClO+OH-的lgK=
HClO+OH-的lgK=____ 。
(2)用Na+导体陶瓷膜电解法生产次氯酸钠溶液的装置如图2所示。
①阳极产生Cl2的电极反应式为____ 。
②其他条件不变,若撤去“Na+导体陶瓷膜”,NaClO的产率则会降低,其主要原因是___ 。
(3)NaClO溶液中ClO-与H2O产生更强氧化性的HClO,可将水体中氨氮氧化为N2(NH3比NH 更易被氧化)。室温时,取氨氮废水200mL,在转速、NaClO投加量相同且均反应30min时,反应初始pH对剩余氨氮浓度及氨氮去除率的影响如图3所示。
更易被氧化)。室温时,取氨氮废水200mL,在转速、NaClO投加量相同且均反应30min时,反应初始pH对剩余氨氮浓度及氨氮去除率的影响如图3所示。

①NaClO氧化NH3的化学方程式为___ 。
②pH在3~7时,随pH增大氨氮去除率升高的原因是___ 。
③pH在7~9时,随pH增大氨氮去除率降低的原因是__ 。
已知:NaClO溶液中物种分布分数与溶液pH的关系如图1所示。

(1)向NaClO溶液中通入CO2,发生反应的离子方程式为
 HClO+OH-的lgK=
HClO+OH-的lgK=(2)用Na+导体陶瓷膜电解法生产次氯酸钠溶液的装置如图2所示。
①阳极产生Cl2的电极反应式为
②其他条件不变,若撤去“Na+导体陶瓷膜”,NaClO的产率则会降低,其主要原因是
(3)NaClO溶液中ClO-与H2O产生更强氧化性的HClO,可将水体中氨氮氧化为N2(NH3比NH
 更易被氧化)。室温时,取氨氮废水200mL,在转速、NaClO投加量相同且均反应30min时,反应初始pH对剩余氨氮浓度及氨氮去除率的影响如图3所示。
更易被氧化)。室温时,取氨氮废水200mL,在转速、NaClO投加量相同且均反应30min时,反应初始pH对剩余氨氮浓度及氨氮去除率的影响如图3所示。
①NaClO氧化NH3的化学方程式为
②pH在3~7时,随pH增大氨氮去除率升高的原因是
③pH在7~9时,随pH增大氨氮去除率降低的原因是
您最近一年使用:0次



